【化学】福建省龙岩市连城县第一中学2019-2020学年高二上学期第一次月考试卷(解析版)
福建省龙岩市连城县第一中学2019-2020学年高二上学期第一次月考试卷
可能用到的相对原子质量:H-1 O-16 C-12 Ca-40
一、选择题(每题只有1个正确选项,每题3分,共48分)
1.下列说法正确的是( )
A. “煮豆燃豆萁,豆在釜中泣”诗中涉及的能量变化主要是化学能转化为热能和光能
B. 已知4P(红磷,s)= P4(白磷,s)△H=+17 kJ/mol ,则白磷比红磷更稳定
C. 同温同压下,H2(g)+Cl2(g) = 2HCl(g)在光照和点燃条件下的ΔH不同
D. 已知 H+(aq) + OH-(aq) = H2O(aq) △H= —57.3kJ/mol ,则1molH2SO4与1mol Ba(OH)2的反应热△H=2×(—57.3) kJ/mol
【答案】A
【解析】
【详解】A、燃豆萁涉及能量变化主要是化学能转化成热能和光能,故A说法正确;
B、物质能量越低,物质越稳定,该反应为吸热反应,即红磷的能量小于白磷,红磷比白磷更稳定,故B说法错误;
C、△H只与始态和终态有关,与反应条件无关,因此在光照和点燃条件下,△H相同,故C说法错误;
D、H2SO4和Ba(OH)2发生反应:H2SO4+Ba(OH)2=BaSO4↓+2H2O,生成BaSO4伴随能量的变化,△H不等于2×(-57.3)kJ·mol-1,故D说法错误。
2.反应2A(g) 2B(g)+C(g);△H>0,达平衡时,要使υ(正)降低、C(A)增大,应采取的措施是( )
A. 加压 B. 减压 C. 升温 D. 降温
【答案】D
【解析】
【详解】A.加压,平衡向逆反应移动,c(A)增大,但v(正)增大,故A错误;
B.减压,v(正)降低,但平衡向正反应移动,c(A)降低,故B错误;
C.升高温度平衡向正反应移动,c(A)增大,同时v(正)增大,故C错误;
D.降低温度,v(正)降低,平衡向逆反应移动,c(A)增大,故D正确。
故选D。
3.在恒温恒容的密闭容器中,发生可逆反应2NO(g) + O2(g)2NO2(g),不能说明该反应已经达到平衡状态的是( )
A. 正反应生成NO2的速率和逆反应生成NO的速率相等
B. 反应容器中压强不随时间的延长而变化
C. 混合气体颜色深浅保持不变
D. 混合气体的密度不随时间延长而变化
【答案】D
【解析】分析:反应达到平衡状态时,正逆反应速率相等,平衡时各种物质的物质的量、浓度等不再发生变化,可由此进行判断。
详解:A.正反应生成NO2的速率和逆反应生成O2的速率等于2:1时,说明正逆反应速率相等,反应达到平衡状态,故A不选;
B.反应前后气体的化学计量数之和不相等,当达到平衡时,气体的压强不变,故B不选;
C.当反应达到平衡状态时,二氧化氮的浓度不变,则混合气体颜色深浅不变,故C不选;
D.反应前后气体的总质量不变,容器的容积不变,则混合气体的密度始终不变,故选D;
答案选D。
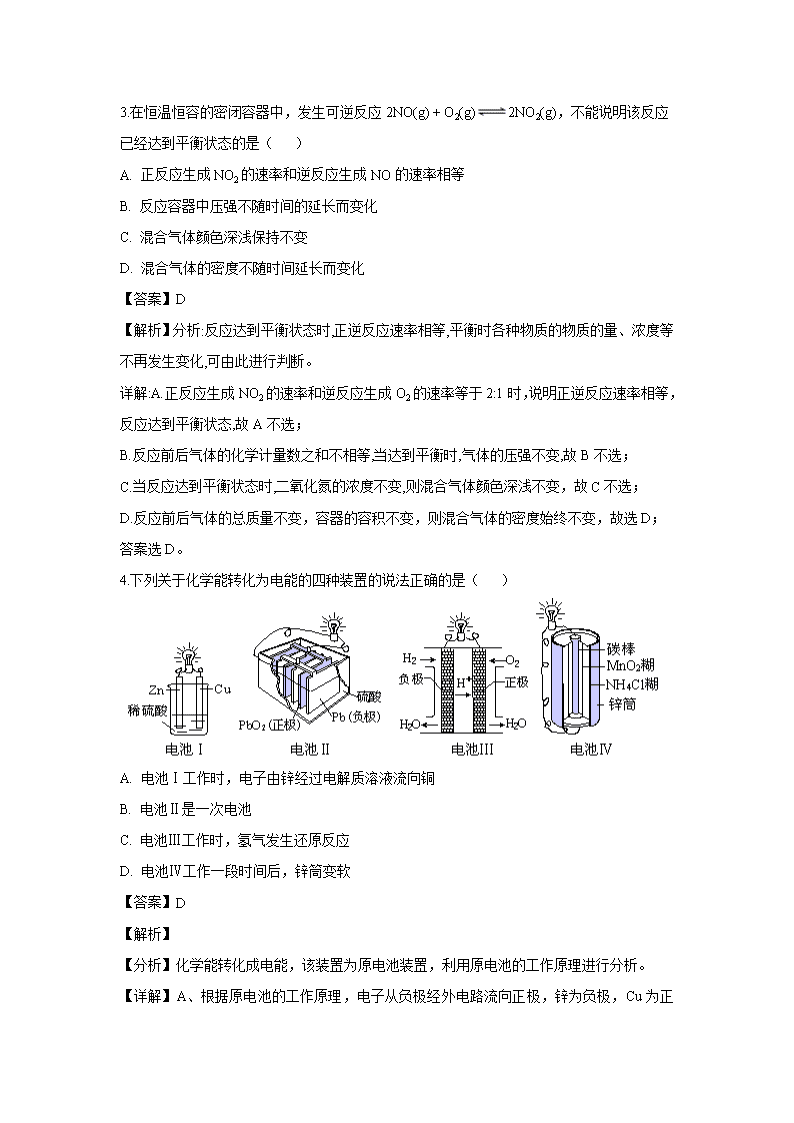
4.下列关于化学能转化为电能的四种装置的说法正确的是( )
A. 电池Ⅰ工作时,电子由锌经过电解质溶液流向铜
B. 电池Ⅱ是一次电池
C. 电池Ⅲ工作时,氢气发生还原反应
D. 电池Ⅳ工作一段时间后,锌筒变软
【答案】D
【解析】
【分析】化学能转化成电能,该装置为原电池装置,利用原电池的工作原理进行分析。
【详解】A、根据原电池的工作原理,电子从负极经外电路流向正极,锌为负极,Cu为正极,即电子从锌电极经外电路流向Cu极,故A错误;
B、电池II为二次电池,故B错误;
C、电池III是燃料电池,负极上发生氧化反应,即氢气发生氧化反应,故C错误;
D、电池IV:Zn为负极,Zn失去电子,转化成Zn2+,锌筒变薄变软,故D正确。
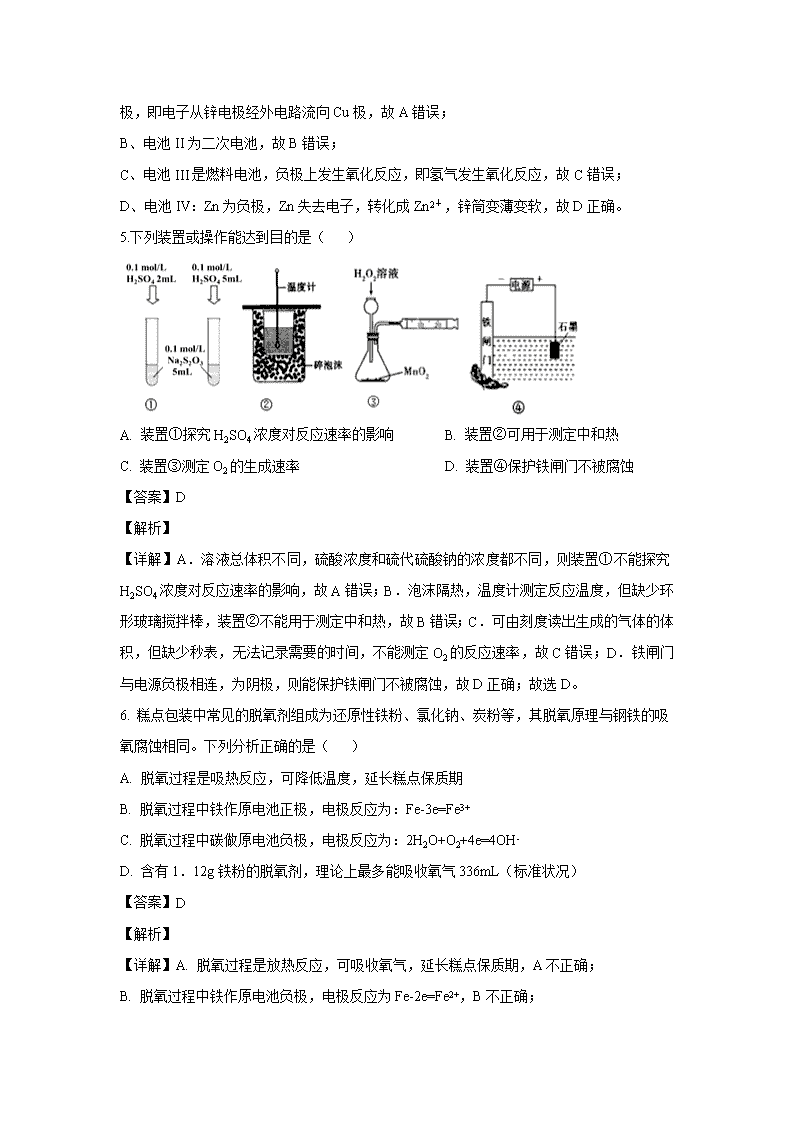
5.下列装置或操作能达到目的是( )
A. 装置①探究H2SO4浓度对反应速率的影响 B. 装置②可用于测定中和热
C. 装置③测定O2的生成速率 D. 装置④保护铁闸门不被腐蚀
【答案】D
【解析】
【详解】A.溶液总体积不同,硫酸浓度和硫代硫酸钠的浓度都不同,则装置①不能探究H2SO4浓度对反应速率的影响,故A错误;B.泡沫隔热,温度计测定反应温度,但缺少环形玻璃搅拌棒,装置②不能用于测定中和热,故B错误;C.可由刻度读出生成的气体的体积,但缺少秒表,无法记录需要的时间,不能测定O2的反应速率,故C错误;D.铁闸门与电源负极相连,为阴极,则能保护铁闸门不被腐蚀,故D正确;故选D。
6. 糕点包装中常见的脱氧剂组成为还原性铁粉、氯化钠、炭粉等,其脱氧原理与钢铁的吸氧腐蚀相同。下列分析正确的是( )
A. 脱氧过程是吸热反应,可降低温度,延长糕点保质期
B. 脱氧过程中铁作原电池正极,电极反应为:Fe-3e=Fe3+
C. 脱氧过程中碳做原电池负极,电极反应为:2H2O+O2+4e=4OH-
D. 含有1.12g铁粉的脱氧剂,理论上最多能吸收氧气336mL(标准状况)
【答案】D
【解析】
【详解】A. 脱氧过程是放热反应,可吸收氧气,延长糕点保质期,A不正确;
B. 脱氧过程中铁作原电池负极,电极反应为Fe-2e=Fe2+,B不正确;
C. 脱氧过程中碳做原电池正极,电极反应为2H2O+O2+4e=4OH-,C不正确;
D. 含有1.12g铁粉的脱氧剂,铁的物质的量为0.02mol,其最终被氧化为氢氧化铁,电子转移总量为0.06mol,理论上最多能吸收氧气0.015mol,其体积在标准状况下为336mL,D正确。
故选D。
7.下列事实不用原电池原理解释的是( )
A. 轮船水线以下的船壳上装一定数量的锌块
B. 铁被钝化处理后不易腐蚀
C. 纯锌与稀硫酸反应时,滴入少量CuSO4溶液后反应速率加快
D. 烧过菜的铁锅加入清水放置,出现红棕色的锈斑
【答案】B
【解析】A、轮船水线下的船壳装上锌块后,可保护船壳在海水中不被腐蚀,因为Zn比Fe活泼,Zn与Fe构成原电池,在海水中锌被腐蚀,从而保护船壳,发生原电池反应可用电化学知识解释,选项A不选;B、铁被钝化后,在金属表面上会形成一层致密的金属氧化膜,保护内部金属不被腐蚀,不能用原电池原理解释,选项B选;C、纯Zn和稀H2SO4反应速率慢,滴入CuSO4后,发生Zn+Cu2+=Zn2++Cu的反应,生成的Cu和Zn组成原电池,加快Zn与H2SO4的反应速率;发生原电池反应而可用电化学知识解释,选项C不选;D、烧过菜的铁锅加入清水放置,出现红棕色的锈斑属于钢铁的电化学腐蚀,选项D不选。答案选B。
8.下列说法正确的是( )
A. 放热反应均是自发反应
B. H2、I2、HI平衡混合气加压后颜色变深,能用勒夏特列原理解释
C. 物质量增加的反应,△S为正值
D. 2CO(g)=2C(s)+O2(g) 已知△H>0,则一定不能自发进行
【答案】D
【解析】
【分析】反应能否自发进行,取决于焓变与熵变的综合判据,当△H-T•△S<0时,反应可自发进行,否则不能,以此解答。
【详解】A.放热反应不一定能发生进行,如铝热反应为放热反应,在常温下不能自发进行,故A项错误;B.H2、I2
、HI平衡混合气加压后,浓度变大,所以颜色变深,平衡不移动,不能用勒夏特列原理解释,故B项错误;C.只有气体的物质的量增加的反应,△S为正值,故C项错误;D.2CO(g)=2C(s)+O2(g) 已知△H>0,△S<0,由△G=△H-T△S可知,△G>0,则一定不能自发进行,故D项正确。综上,本题选D。
9.对反应N2O4(g)2NO2(g);△H>0,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是( )
A. A、C两点的反应速率:A>C
B. A、C两点气体的颜色:A深,C浅
C. 由状态B到状态A,可以用加热的方法
D. B、C两点NO2的体积分数相同,所以平衡常数也相同
【答案】C
【解析】
【分析】N2O4(g)2NO2(g);△H>0该反应为吸热反应,升高温度,化学平衡正向移动,NO2的体积分数增大。增大压强,化学平衡逆向移动,NO2的体积分数减小,结合图象来分析解答。A. A、C两点都在等温线上,压强越大,反应速率越快;B.增大压强,平衡向逆反应方向进行,向逆反应进行是因为减小体积增大压强,导致浓度增大趋势,但到达平衡仍比原平衡浓度大;C.升高温度,化学平衡正向移动,NO2的体积分数增大。由图像可知T1
T1,温度越高达到平衡所用时间越短,升温平衡逆向移动,氢气体积分数越小,所以C选项是符合的;
D、Fe是固态,其物质的量的增加对反应速率无影响,所以D选项是符合的。
故选A。
13.在KIO3、KHSO3的酸性混合溶液中加入少量KI和淀粉,不停地搅拌,有下列反应发生:①
IO3-+5I-+6H+===3I2+3H2O;②I2+HSO3-+H2O===2I-+SO42-+3H+。当反应进行到15 min时,溶液颜色迅速变蓝,随之又很快消失,这一反应称为时钟反应,有人用它来解释生物钟现象,下列说法中错误的是( )
A. 在整个反应过程中,起催化作用的物质是KI
B. 时钟反应的快慢由反应②决定
C. 上述两个反应中,反应速率较快的是②
D. “溶液颜色迅速变蓝,随之又很快消失”这一现象与①②的反应速率有关
【答案】C
【解析】试题分析:由反应①②可以得出KI是KIO3、KHSO3反应催化剂,反应中生成的I2能使淀粉溶液变蓝色,由题给信息——反应进行到15分钟时,溶液变蓝,说明反应①很慢,它决定了时钟反应的快慢,属于答案选C。
14.某密闭容器中发生如下反应:2X(g)+Y(g) 2Z(g) △H<0,下图是表示该反应速率(v)随时间(t)变化的关系图。t1、t2、t5时刻外界条件均有改变(但都没有改变各物质的用量)。则下列说法中正确的是( )
A. t3时降低了温度 B. t5时增大了压强
C. t6时刻后反应物的转化率最低 D. t4时该反应的平衡常数小于t6时反应的平衡常数
【答案】C
【解析】
【详解】A.该反应 △H<0,若t3时降低了温度,平衡将右移,且速率减慢、正反应速率大于逆反应速率,与图示的不符,A错误;
B.该反应为体积减小的反应,若t5时增大了压强,速率将加快,且平衡右移、正反应速率大于逆反应速率,与图示的不符,B错误;
C.t2-t3 为使用催化剂,平衡不移动,转化率不变;t3-t4为减小压强,平衡左移,转化率减小,t5-t6为升高温度,平衡左移,转化率减小,因此整个过程中,t6时刻后反应物的转化率最低,C正确;
D. 该反应的正反应是放热反应,升高温度,平衡常数减小;相对于t4时,t6
时为升温过程,平衡左移,所以t4时该反应的平衡常数大于t6时反应的平衡常数,D错误;
综上所述,本题选C。
15.某温度下,将3molA和2molB充入2L一密闭容器中,发生反应:A(g)+B(g)⇌C(g)+D(g),5min后达到平衡。已知该温度下其平衡常数K=1,下列选项正确的是( )
A. C平衡浓度为1.2mol/L B. 速率v(B)= 0.08 mol/(L•min)
C. A的转化率为40% D. B的转化率为40%
【答案】C
【解析】
【分析】根据三行式计算化学反应中物质的平衡浓度、速率和转化率。
【详解】根据反应式可知
A(g)+B(g)⇌C(g)+D(g)
起始量(mol) 3 2 0 0
变化量(mol) x x x x
平衡量(mol) 3-x 2-x x x
所以有=1,计算得出x=1.2,
C平衡浓度为=0.6mol/L ;
速率v(B)== 0.12 mol/(L•min)
A的转化率为×100%=40%;
B的转化率为×100%=60%。
所以C选项是正确的。
16.将1molN2气体和3molH2气体在2L的恒容容器中,并在一定条件下发生如下反应:N2(g)+3H2(g) 2NH3(g),若经2s后测得NH3的浓度为0.6mol·L-1,现有下列几种说法:其中不正确的是( )
A. 用N2表示的反应速率为0.15mol·L-1·s-1 B. 2s时H2的转化率为40%
C. 2s时N2与H2的转化率相等 D. 2s时H2的浓度为0.6mol·L-1
【答案】B
【解析】分析:将1molN2气体和3molH2气体在2L的恒容容器中,若经2s后测得NH3
的浓度为0.6mol•L-1,生成氨气为2L×0.6mol/L=1.2mol,则:
N2(g)+3H2(g)⇌2NH3(g)
起始量(mol):1 3 0
变化量(mol):0.6 1.8 1.2
2s时(mol):0.4 1.2 1.2
A.根据v=计算用N2表示的反应速率;
B.根据=转化量/起始量×100%计算用H2的转化率;
C.N2、H2起始物质的量为1:3,二者按1:3反应,故N2与 H2的转化率相等;
D.根据c=计算。
详解:将1molN2气体和3molH2气体在2L的恒容容器中,若经2s后测得NH3的浓度为0.6mol•L-1,生成氨气为2L×0.6mol/L=1.2mol,则:
N2(g)+3H2(g)⇌2NH3(g)
起始量(mol):1 3 0
变化量(mol):0.6 1.8 1.2
2s时(mol):0.4 1.2 1.2
A.用N2表示的反应速率为:=0.15 mol•L-1•s-1,故A正确;
B. 2s时H2的转化率为:×100%=60%;故B错误;
C.N2、H2起始物质的量为1:3,二者按1:3反应,故N2与 H2的转化率相等,故C正确;
D.2s时H2的浓度为=0.6mol•L-1,故D正确。
所以本题答案选B。
17.甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上一般可采用如下方法来合成甲醇:
(1)用CO2生产甲醇。
已知:CO2(g)+3H2(g)═CH3OH(g)+H2O(l) △H=﹣akJ•mol﹣1;
2H2(g)+O2(g)═2H2O(l) △H=﹣b kJ•mol﹣1;
则表示CH3OH(g)燃烧热化学方程式为:____________________。
(2)用CO生产甲醇。
已知:CO(g)+2H2(g) CH3OH(g),下图是该反应在不同温度下CO的转化率随时间变化的曲线。
①该反应的焓变ΔH__________0(填“>”、“<”或“=”)。
②T1和T2温度下的平衡常数大小关系是K1_______K2 (填 “>”、“<”或“=”)。
③若容器容积不变,下列措施可增加甲醇产率的是______________。
A.升高温度 B. 将CH3OH(g)从体系中分离
C.使用合适的催化剂 D. 充入He,使体系总压强增大
(3)甲醇(CH3OH)可以用作燃料电池,该电池是采用铂或碳化钨作为电极催化剂,在稀硫酸电解液中直接加入纯化后的甲醇,同时向一个电极通入空气。负极发生的电极反应式是________________________,正极发生的电极反应式是_______________________。
【答案】(1). 2CH3OH(g)+3O2(g) =2CO2 (g)+4H2O(l) ΔH = + (2a -3b) kJ·mol-1 (2). < (3). > (4). B (5). 2CH3OH -12e-+2H2O=2CO2+12H+ (6). 3O2 + 12H+ + 12e- =6H2O
【解析】
【分析】(1)利用盖斯定律相加减,即可得出CH3OH燃烧的热化学方程式;
(2)①根据先拐先平法和温度对化学反应速率和化学平衡的影响来回答;
②温度对化学平衡常数的影响和反应的吸放热有关;
③化学平衡正向移动可增加甲醇产率;
(3)在甲醇燃料电池中,燃料甲醇作负极,发生失电子的氧化反应,氧气作正极,发生得电子的还原反应,即可得到正负极反应式。
【详解】(1)CO2(g)+3H2(g)═CH3OH(g)+H2O(l) △H=﹣akJ•mol﹣1 ①
2H2(g)+O2(g)═2H2O(l) △H=﹣b kJ•mol﹣1 ②
②×3-①×2得到2CH3OH(g)+3O2(g) =2CO2 (g)+4H2O(l) ΔH = + (2a -3b) kJ·mol-1 则表示CH3OH(g)燃烧的热化学方程式为:2CH3OH(g)+3O2(g) =2CO2 (g)+4H2O(l) ΔH = + (2a -3b) kJ·mol-1 ;
(2)①反应CO(g)+2H2(g)⇌CH3OH(g)中,根据图像T2先出现拐点,T2反应速率快,则T2>T1
,根据图像温度升高CO的平衡转化率减小,化学平衡向着逆反应方向移动,所以该反应是放热反应,ΔH<0,因此,本题正确答案是:<;
②对于放热反应,温度越高,化学平衡常数越小,T2>T1,反之越大,所以K1>K2,因此,本题正确答案是:>;
③A.若容器容积不变,升高温度,反应CO(g)+2H2(g)⇌CH3OH(g)平衡逆向移动,甲醇产率低,故A项错误;B.将CH3OH从体系中分离,反应CO(g)+2H2(g)⇌CH3OH(g)平衡正向移动,甲醇产率增大,故B正确;C.使用合适的催化剂不会引起化学平衡的移动,甲醇的转化率不变,故C错误;D.若容器容积不变,充入He,使体系总压强增大,各组分的浓度不变,化学平衡不移动,甲醇的转化率不变,故D错误;故选B;
(3)在甲醇燃料电池中,燃料甲醇作负极,发生失电子的氧化反应,氧气作正极,发生得电子的还原反应,负极发生的电极反应式是2CH3OH -12e-+2H2O=2CO2+12H+,正极发生的电极反应式是 3O2 + 12H+ + 12e- =6H2O
18.如图所示三套实验装置,分别回答下列问题。
图1 图 2 图 3
(1)图1中,① 若开始时开关K与a连接,则该装置为_____(填装置名称),电极A的电极反应式为________________________
②若开始时开关K与b连接,则总反应的离子方程式为 ___________________________
(2)2004年美国圣路易斯大学研制了一种新型的乙醇电池,它用磺酸类质子溶剂,在200°C左右时供电,电池示意如图2所示:
①______极(填a或b)为电池的正极,电池工作时电流方向为_________(填a→b或b→a)
②写出该电池负极的电极反应式________________________________________
(3)用图3装置电解硫酸钾溶液来制取氢气、氧气、硫酸和氢氧化钾(电解槽内的阳离子交换膜只允许阳离子通过,阴离子交换膜只允许阴离子通过)。
①该电解槽的阴极反应式为 _____________________。
②制得的硫酸溶液从出口____(填“A”、“D”)导出,并简述原因__________________________(请用化学用语和文字解释)
【答案】(1). 原电池 (2). 2H2O+O2+4e-=4OH- (3). 2H2O+2Cl-2OH-+H2↑+Cl2↑ (4). b (5). b→a (6). C2H5OH-12e-+3H2O=12H++2CO2 (7). 2H2O+2e-=2OH-+H2↑ 或2H++2e-=H2↑ (8). A (9). 2H2O-4e-=4H++O2↑,OH-在阳极放电,使水的电离平衡正向移动, c(H+)增大,SO42-通过阴离子交换膜进入阳极,和H+结合成硫酸
【解析】本题考查电化学。(1)图1中,开关K与a连接形成原电池反应,发生吸氧腐蚀,A电极石墨做正极溶液中氧气得到电子生成氢氧根离子,电极反应为:O2+2H2O+4e﹣=4OH﹣;②开关K与b连接,装置为电解池,石墨作阳极,铁为阴极,相当于电解饱和食盐水生成氢氧化钠、氢气和氯气,电解总反应的离子方程式为2Cl﹣+2H2O2OH﹣+H2↑+Cl2↑;(2)①燃料电池中,燃料乙醇在负极(a极)发生失电子的反应,氧气是在正极(b极)上发生得电子的反应,电流在电路中从正极流向负极,即b→a;②该电池负极的电极反应式为:C2H5OH+3H2O﹣12e﹣=2CO2+12H+;(3)①电解时,阴极上氢离子得电子发生还原反应,电极反应式为:2H++2e﹣=H2↑或2H2O+2e-=2OH-+H2↑;②阳极上失电子发生氧化反应,溶液中的氢氧根离子的放电能力大于硫酸根离子的放电能力,所以阳极上氢氧根离子失电子生成水和氧气4OH﹣﹣4e﹣=2H2O+O2↑,OH-在阳极放电,因此硫酸根离子向阳极移动,该电极上会产生硫酸,阴极氢离子放电,因此钾离子向阴极移动,电解产生的氢氧化钾在阴极生成,所以氢氧化钾溶液从出口D流出,制得的硫酸溶液从A口流出。
19.(I)某探究小组用HNO3与大理石反应过程中质量减小的方法,研究影响反应速率的因素。所用HNO3浓度为1.00 mol/L、2.00 mol/L,大理石有细颗粒和粗颗粒两种规格,实验温度为25℃、35℃,每次实验HNO3的用量为25.00 mL,大理石用量为10.00 g。
(1)请完成以下实验设计表,并在实验目的一栏中填空:
实验编号
温度(℃)
大理石规格
HNO3浓度(mol/L)
实验目的
①
25
粗颗粒
2.00
(Ⅰ)实验①和②探究浓度对反应速率影响;
(Ⅱ)实验①和③探究温度对反应速率的影响;
(Ⅲ)实验①和④探究e_______对反应速率的影响
②
25
粗颗粒
a______
③
b_______
粗颗粒
2.00
④
c________
细颗粒
d______
(2)实验①中CO2质量随时间变化的关系见下图。计算实验①中70 s~90 s范围内用HNO3表示的平均反应速率________(忽略溶液体积变化,不需要写出计算过程)。在0~70、70~90、90~200各相同的时间段里,反应速率最大的时间段是________。
(II)某小组利用H2C2O4溶液和硫酸酸化KMnO4溶液反应来探究“外界条件对化学反应速率的影响”。实验时通过测定酸性KMnO4溶液褪色所需时间来判断反应的快慢。该小组设计了如下方案。已知:2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+10CO2↑+8H2O
实验编号
0.1 mol·L-1酸性KMnO4溶液的体积/mL
0.6mol·L-1H2C2O4溶液的体积/mL
H2O的体积/mL
实验温度/℃
溶液褪色所需时间/min
①
10
V1
35
25
②
10
10
30
25
③
10
10
V2
50
(3)表中V1=_______mL,V2=_______mL。
(4)探究温度对化学反应速率影响的实验编号是________(填编号,下同),可探究反应物浓度对化学反应速率影响的实验编号是________。
(5)实验①测得KMnO4溶液的褪色时间为2min,忽略混合前后溶液体积的微小变化,这段时间内平均反应速率v(H2C2O4)=________mol·L-1·min-1。
【答案】(1). 1.00 (2). 35 (3). 25 (4). 2.00 (5). 大理石规格 (6). 0.01 mol/(L·s) (7). 0~70 (8). 5 (9). 30 (10). ②和③ (11). ①和② (12). 0.025
【解析】
【分析】I.(1)(I)实验①和②探究浓度对反应速率的影响,硝酸的浓度应该不同;
(Ⅱ)实验①和③探究温度对反应速率的影响,温度应该不同;
(Ⅲ)中实验①和④,大理石的规格不同,则其它条件应该相同;
(2)先根据图象,求出生成二氧化碳的物质的量,然后根据反应:CaCO3+2HNO3=Ca(NO3)2+CO2↑H2O,求出消耗的硝酸的物质的量,再由v(HNO3)=求出反应速率,物质浓度越大,反应速率越快。
II.(3)由控制变量法可知,应控制溶液的总体积相同;
(4)实验1、2的温度相同,实验2、3的浓度相同;
(5)结合v=、速率之比等于化学计量数之比计算。
【详解】(1)(I)由于①和②探究浓度对反应速率的影响,故硝酸的浓度不同,a应该是1.00mol/LHNO3;
(Ⅱ)由于①和③探究温度对反应速率的影响,故应该温度不同,b应该选35℃;
(Ⅲ)实验①和④的大理石规格不同,其它反应条件相同,探究的是固体物质的表面积对反应速率的影响,故c为25℃,d是2.00mol/L,e是固体物质的表面积,即大理石规格;
(2)由图可知70至90s,CO2生成的质量为m(CO2)=0.95g-0.84g=0.11g,物质的量为n(CO2)==0.0025molmol,根据反应CaCO3+2HNO3=Ca(NO3)2+CO2↑H2O,可知消耗HNO3的物质的量为n(HNO3)=2×0.0025mol=0.005mol,又由于硝酸溶液体积为0.025L,所以HNO3减少的浓度△c(HNO3)==0.2mol/L,反应的时间t=90s-70s=20s,所以HNO3在70~90s范围内的平均反应速率为v(HNO3)==0.01mol/(L•s);在大理石与硝酸的反应中,随着反应的进行,硝酸的浓度逐渐减低,在0~70s、70s~90s、90s~200s各相同的时间段里,浓度最大的是0~70s,所以反应速率最大的时间段是0~70s;
Ⅱ.(3)实验2混合液的总体积为10mL+10mL+30mL=50mL,则V1=50mL-10mL-35mL=5mL,V2=50mL-10mL-10mL=30mL;
(4)探究温度对化学反应速率影响,必须满足除了温度不同,其他条件完全相同,所以满足此条件的实验编号是:②和③;探究反应物浓度对化学反应速率影响,除了浓度不同,其他条件完全相同的实验编号是①和②;
(5)草酸的物质的量n(H2C2O4)=0.60mol/L×0.005L=0.003mol,高锰酸钾的物质的量n(KMnO4)=0.10mol•L-1×0.01L=0.001mol,草酸和高锰酸钾的物质的量之比为0.003mol:0.001mol=3:1,由2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+10CO2↑+8H2O可知草酸过量,高锰酸钾完全反应,混合后溶液中高锰酸钾的浓度c(KMnO4)==0.02mol/L,这段时间内平均反应速率v(KMnO4)==0.01 mol/(L•min),由速率之比等于化学计量数之比可知,这段时间内平均反应速率v(H2C2O4)=0.01mol/(L•min)×=0.025mol/(L•min)。
20.(1)参考合成反应CO(g)+2H2(g)CH3OH(g)的平衡常数,回答下列问题:
温度/℃
0
50
100
200
300
400
平衡常数
667
100
13
1.9×10-2
2.4×10-4
1×10-5
①该反应正反应是___________(填“放热”或“吸热”)反应;
②在T℃时,1L密闭容器中,投入0.1molCO和0.2molH2,达到平衡时,CO转化率为50%,则T=__________℃。
(2)CH3OH也可由CO2和H2合成。在体积为1L的密闭容器中,充入lmolCO2和3molH2,一定条件下反应:CO2(g)+3H2(g)CH3OH(g)+H2O(g) ΔH=-49.0kJ/mol,测得CO2和CH3OH(g)浓度随时间变化如图所示。
①该反应的平衡常数表达式为K=________;从反应开始到10min,v(H2)=______mol·L-1·min-1;
②下列情况能说明该反应一定达到平衡状态的是___________(填字母)
A.v(CO2)消耗=v(CH3OH)生成
B.气体的密度不再随时间改变
C.CO2和CH3OH的浓度之比不再随时间改变
D.气体的平均相对分子质量不再随时间改变
③为了加快化学反应速率且使体系中气体的物质的量增大,只改变下列某一条件,可采取的措施有___________ (填字母)
A.升高温度 B.缩小容器体积 C.再充入CO2气体 D.使用合适的催化剂
④相同温度下,在另一个容积为1 L的密闭容器中充入2mol CH3OH(g)和2molH2O(g),达到平衡时CO2的浓度____________(填“>”、“<”或“=”)0.25mol·L-1。
【答案】(1). 放热 (2). 50 (3). (4). 0.225 (5). CD (6). AC (7). >
【解析】
【分析】(1)①根据温度与化学平衡常数的关系,结合平衡移动原理分析;
②根据CO的平衡转化率计算该反应的平衡常数,结合表格数据判断反应进行的温度;
(2)①根据平衡常数的含义书写表达式,先根据图象计算v(CO2),然后根据反应速率与化学计量数关系计算从反应开始到10min的v(H2);
②根据可逆反应达到平衡状态时各种物质的浓度不变,含量不变,正逆反应速率不变分析;
③根据影响反应速率的因素和化学平衡影响因素分析判断;
④根据等效平衡分析判断。
【详解】(1)①根据表格数据可知:升高温度,该反应的化学平衡常数降低,说明:升高温度化学平衡逆向移动,由于升高温度化学平衡向吸热反应方向移动,逆反应为吸热反应,则该反应的正反应为放热反应;
②在T℃时,在1L密闭容器中,投入0.1molCO和0.2molH2,发生反应:CO(g)+2H2(g)CH3OH(g),达到平衡时,CO转化率为50%,则反应的CO物质的量浓度为0.05mol/L,则同时反应消耗H2的浓度为0.1mol/L,反应产生的CH3OH(g)浓度为0.05mol/L,则平衡时c(CO)=0.05mol/L,c(H2)=0.1mol/L,则该温度下的化学平衡常数K==100,根据温度与化学平衡常数的关系可知:反应温度为50℃;
(2)①化学平衡常数是可逆反应达到平衡状态时,各种生成物浓度幂之积与各种反应物浓度幂之积的比,对于反应CO2(g)+3H2(g)CH3OH(g)+H2O(g),其平衡常数表达式为K=;从反应开始到10min,v(CO2)=
=0.075mol/(L·min),由于反应用不同物质表示反应速率,速率比等于化学方程式中化学计量数的比,所以从反应开始到10min,v(H2)=3v(CO2)=0.225mol/(L·min);
②A.v(CO2)消耗 =v(CH3OH)生成表示的是反应正向进行,不能说明为平衡状态,A错误;
B.容器的容积不变,反应混合物都是气体,在任何条件下气体的密度都不变,因此不能根据气体的密度不再随时间改变判断反应处于平衡状态,B错误;
C.CO2和CH3OH的浓度之比不再随时间改变,说明反应混合物中任何物质的浓度不变,反应处于平衡状态,C正确;
D.反应前后气体的质量不变,而气体的物质的量改变,若反应混合物中,气体的平均相对分子质量不再随时间改变,说明气体的物质的量不再发生变化,反应达到平衡状态,D正确;
故合理选项是CD;
③A.升高温度化学反应速率增大,化学平衡向吸热的逆反应方向移动,气体的物质的量增大,A符合题意;
B.缩小容器体积物质的浓度增大,反应速率加快,反应体系压强也随之增大,增大压强,平衡向气体体积减小的正反应方向移动,气体的物质的量减小,B不符合题意;
C.再充入CO2气体,即增大了反应物的浓度,化学反应速率增大,化学平衡正向移动,总的来说气体的物质的量比原来增大,C符合题意;
D.使用合适的催化剂,化学反应速率加快,但化学平衡不发生移动,因此气体的物质的量不变,D不符合题意;
故合理选项是AC;
④对于反应CO2(g)+3H2(g)CH3OH(g)+H2O(g),在体积为1L的密闭容器中,充入lmolCO2和3molH2,由于该反应是反应前后气体体积不等的反应,所以其等效起始状态为向该容器中加入1mol CH3OH(g)和1molH2O(g),而现在是在另一个容积为1 L的密闭容器中充入2mol CH3OH(g)和2molH2O(g),相当于在1L密闭容器中加入1mol CH3OH(g)和1molH2O(g),反应达到平衡后再加入1mol CH3OH(g)和1molH2O(g),所以达到新的平衡时CO2的浓度大于原平衡时的浓度0.25mol/L。