- 2021-04-29 发布 |
- 37.5 KB |
- 8页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2019届高考化学一、二轮衔接专题整合(十四) 物质的分离、提纯作业
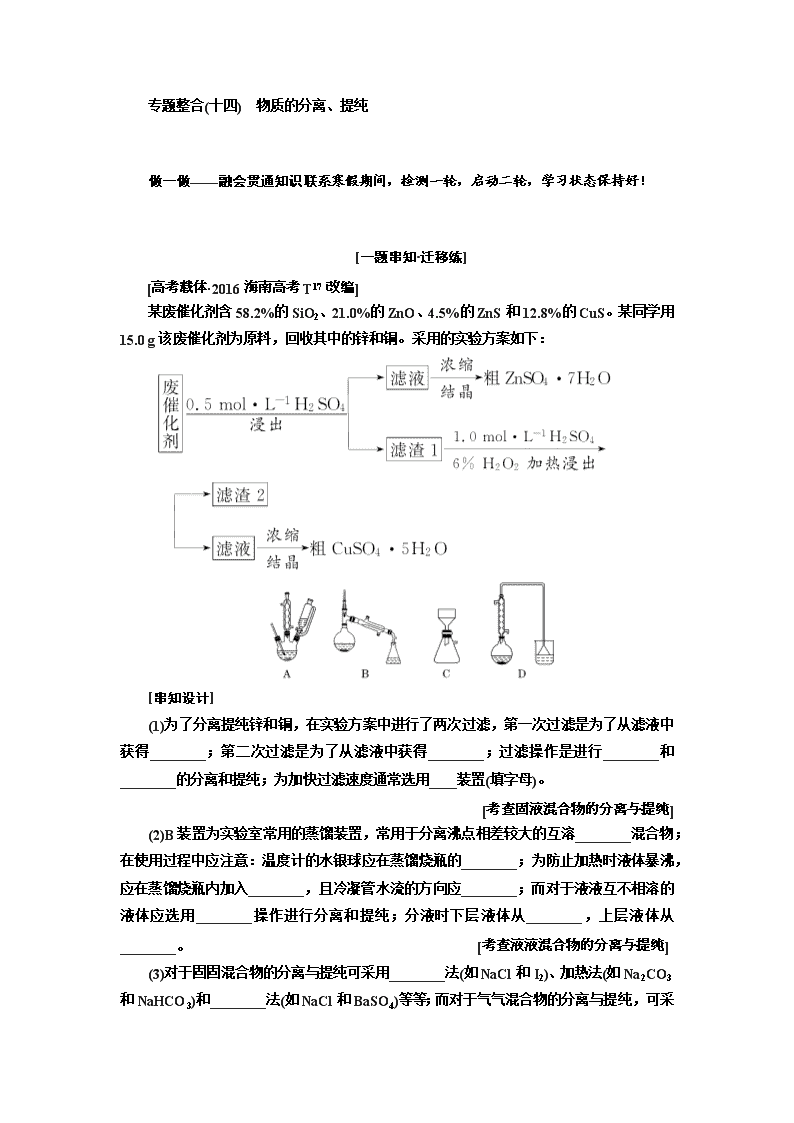
专题整合(十四) 物质的分离、提纯 做一做——融会贯通知识联系寒假期间,检测一轮,启动二轮,学习状态保持好! [一题串知·迁移练] 某废催化剂含58.2%的SiO2、21.0%的ZnO、4.5%的ZnS和12.8%的CuS。某同学用15.0 g该废催化剂为原料,回收其中的锌和铜。采用的实验方案如下: [串知设计] (1)为了分离提纯锌和铜,在实验方案中进行了两次过滤,第一次过滤是为了从滤液中获得________;第二次过滤是为了从滤液中获得________;过滤操作是进行________和________的分离和提纯;为加快过滤速度通常选用____装置(填字母)。 (2)B装置为实验室常用的蒸馏装置,常用于分离沸点相差较大的互溶________混合物;在使用过程中应注意:温度计的水银球应在蒸馏烧瓶的________;为防止加热时液体暴沸,应在蒸馏烧瓶内加入________,且冷凝管水流的方向应________;而对于液液互不相溶的液体应选用________操作进行分离和提纯;分液时下层液体从________,上层液体从________。 (3)对于固固混合物的分离与提纯可采用________法(如NaCl和I2)、加热法(如Na2CO3和NaHCO3)和________法(如NaCl和BaSO4)等等;而对于气气混合物的分离与提纯,可采 用洗气法、灼烧法等等。 答案:(1)ZnSO4·7H2O CuSO4·5H2O 固体 液体 C (2)液体 支管口处 碎瓷片或沸石 低进高出 分液 下口流出 上口倒出 (3)升华 过滤 [保分题目·综合练] 1.下列物质提纯的方法可能涉及化学变化的是( ) A.蒸馏 B.过滤 C.分液 D.洗气 解析:选D 用蒸馏、过滤、分液进行混合物的分离均是物理变化过程;洗气时有可能发生化学反应,涉及化学变化过程,如用饱和NaHCO3溶液除去CO2中的HCl气体。 2.为达到下列实验目的,所采用的方法正确的是( ) A.分离饱和食盐水和沙子的混合物——过滤 B.分离水和汽油的混合物——蒸馏 C.从硝酸钾和氯化钾混合液中获取硝酸钾——蒸发 D.从溴水中提取溴——分液 解析:选A 沙子不溶于水,食盐溶于水,则利用过滤法可分离,故A正确;水和汽油的混合物分层,则利用分液法分离,故B错误;KNO3、KCl的溶解度受温度影响不同,若蒸发均从溶液中析出,应利用重结晶法分离,故C错误;溴水不分层,不能利用分液分离,溴易溶于有机溶剂,不易溶于水,应利用萃取分液,故D错误。 3.下列有关除杂的实验操作合理的是( ) A.除去二氧化碳中混有的少量一氧化碳:通入适量氧气后点燃 B.除去氧气中的少量氮气:使气体通过炽热的铜粉 C.除去石英中的少量碳酸钙:用稀盐酸溶解后过滤 D.除去氯化钠固体中的少量纯碱:加入足量氯化钙,过滤、蒸发、结晶 解析:选C A项,二氧化碳中混有少量一氧化碳,通入适量氧气后无法点燃,因为二氧化碳不支持燃烧;B项,将氧气和氮气通过炽热的铜粉,这样反应掉的将是氧气;D项,能除去杂质纯碱,但引入了新的杂质CaCl2。 4.下列分离提纯方法不正确的是( ) A.分离KNO3和NaCl,常用重结晶法 B.提纯含有碘单质的NaCl,常用升华法 C.去除乙醇中的水分常用萃取法 D.分离苯和酸性高锰酸钾溶液可用分液法 解析:选C KNO3的溶解度随温度变化较大,而NaCl的溶解度随温度变化不大,故常用重结晶法分离KNO3和NaCl;碘单质易升华,而NaCl的熔点和沸点都很高,常用升华法提纯含有碘单质的NaCl;苯和酸性高锰酸钾溶液互不相溶,可用分液法分离;去除乙醇中的水分,常加入生石灰再蒸馏。 5.下表中除去物质中杂质选用的试剂或操作方法正确的选项是( ) 序号 物质 杂质 除去杂质选用的试剂或操作方法 ① KNO3溶液 KOH 加入适量FeCl3溶液,并过滤 ② FeSO4溶液 CuSO4 加入过量铁粉,并过滤 ③ H2 CO2 通过盛有足量NaOH溶液的洗气瓶,再通过盛有浓硫酸的洗气瓶 ④ NaNO3 CaCO3 溶解、过滤、蒸发 A.①②③ B.①③④ C.②③④ D.①②④ 解析:选C 加入氯化铁会引入杂质Cl-,故①不正确;加入铁粉置换出铜,通过过滤除去铜及过量的铁粉,故②正确;利用氢氧化钠溶液吸收二氧化碳气体,再用浓硫酸干燥氢气,故③正确;碳酸钙不溶于水,溶解后过滤,再蒸发即可得到纯净的NaNO3,故④正确。 6.将空气缓慢通过如图所示装置后,在试管中收集到少量稀有气体。空气在通过a~d装置时,依次除去的气体是( ) A.O2、N2、H2O、CO2 B.CO2、H2O、O2、N2 C.H2O、CO2、N2、O2 D.N2、O2、CO2、H2O 解析:选B 氢氧化钠溶液显碱性,吸收二氧化碳,带出水蒸气,浓硫酸吸收水分,铜粉除去氧气,镁粉除去氮气。 7.下列四种分离乙醇、乙酸的方案中最佳的一组是( ) 选项 a b c d A CaO固体 乙酸钙 H2SO4 蒸馏 B Na2CO3固体 乙酸钠 HCl 过滤 C CaO固体 乙酸钙 HCl 过滤 D Na2CO3饱和溶液 乙酸钠 HCl 蒸馏 解析:选A B、C两项中加入HCl的浓溶液后,得到的均是溶液,不能采用过滤操作,B、C项不符合题意;加入Na2CO3饱和溶液,蒸馏时乙醇中可能混有大量水,且b应为CH3COONa与Na2CO3的混合溶液,D项不符合题意;加入CaO固体,可除去原混合液中的水,且CaO吸水放热,利于乙醇的挥发,故A项符合题意。 8.某硝酸钠固体中混有少量硫酸铵和碳酸氢钠杂质,现设计一实验方案,既除去杂质,又配成硝酸钠溶液。实验方案:先将固体溶于蒸馏水配成溶液,选择合适的试剂和操作完成表格中各步实验。 选择试剂 ① Na2CO3溶液 ④ 实验操作 ② ③ 加热 下列试剂或操作不合理的是( ) A.试剂①为Ba(OH)2溶液 B.操作②为结晶 C.操作③为过滤 D.试剂④为稀HNO3 解析:选B 选择Ba(OH)2溶液除去SO、NH和HCO,NH3·H2O通过加热除去,操作②为加热。过量的Ba2+用Na2CO3溶液除去,过量的OH-和CO用硝酸除去,则操作③为过滤,试剂④为HNO3。 9.下列除杂与收集气体的实验不能达到实验目的的是( ) 选项 实验目的 X Y A 除去N2中的Cl2,并收集N2 FeSO4 H2O B 除去CO中的CO2,并收集CO NaOH H2O C 除去Cl2中的HCl,并收集纯净的Cl2 NaCl H2O D 除去NO中的NO2,并收集NO H2O H2O 解析:选C 氯气与FeSO4发生氧化还原反应,氮气不反应,则可除去杂质,故A正确;CO2与NaOH反应,CO不反应,洗气可分离,故B正确;食盐水可抑制氯气的溶解, 但氯气中混有水蒸气,应选浓硫酸干燥得到纯净的氯气,故C错误;NO2与水反应生成NO,洗气可除杂,故D正确。 10.物质中杂质(括号内为杂质)的检验、除杂的试剂或方法都正确的是( ) 选项 物质及其杂质 检验 除杂 A Cl2(HCl) 湿润的淀粉KI试纸 饱和食盐水 B NO(NO2) 观察颜色或湿润的淀粉KI试纸 水 C CO2(HCl) AgNO3溶液(含稀硝酸) 饱和Na2CO3溶液 D NaHCO3溶液(Na2CO3) Ca(OH)2溶液 过量CO2 解析:选B A项,湿润的淀粉KI试纸可以检验HCl中Cl2,但不能检验Cl2中HCl;B项,NO中含有NO2,可以通过观察气体颜色(红棕色)或通过淀粉KI试纸(NO2将I-氧化为I2,试纸变蓝色)来检验,除去NO中NO2,选择水,发生反应:3NO2+H2O===2HNO3+NO;C项,除去CO2中HCl,应选择饱和NaHCO3溶液;D项,检验NaHCO3溶液中Na2CO3,不能用Ca(OH)2溶液,因为无论是否含有Na2CO3,均会产生沉淀,应选择CaCl2溶液。 11.下列实验中,所采取的分离方法与对应原理都正确的是( ) 选项 目的 分离方法 原理 A 除去KCl中的MnO2 蒸发结晶 溶解度不同 B 除去碘中的NaCl 加热、升华 NaCl的熔点高,碘易升华 C 分离 KNO3和NaCl 重结晶 KNO3的溶解度大于NaCl D 分离食用油和汽油 分液 食用油和汽油的密度不同 解析:选B A项,应用溶解过滤的方法,错误;C项中原因是KNO3的溶解度受温度影响大,而NaCl的溶解度几乎不受温度影响,错误;D项中两者互溶,不能用分液的方法,错误。 12.实验室从含溴化氢的废液中提取溴单质,下列操作中能达到实验目的的是( ) A.装置甲用Cl2氧化废液中的溴化氢 B.用装置乙分离CCl4层和水层 C.用装置丙分离CCl4和液溴 D.用仪器丁长期贮存液溴 解析:选B 甲中导管应“长进短出”,A错误;CCl4密度比水大且与水互不相溶,可用分液的方法分离,B正确;C项装置中温度计水银球应在蒸馏烧瓶的支管口处,错误;液溴易挥发,能腐蚀橡胶,D错误。 看一看——主干知识牢记心间寒假自修,平时浏览,考前温故,基础知识何时都不能丢! 1.物质分离、提纯的常用装置 2.物质分离、提纯的四种类型 (1)“固+固”混合物的分离与提纯 (2)“固+液”混合物的分离与提纯 (3)“液+液”混合物的分离与提纯 (4)“气+气”混合物的分离与提纯 3.物质分离、提纯的注意事项 (1)“四原则” ①不增,不得引入新杂质; ②不减,尽量不减少被提纯的物质; ③易分,使被提纯或分离的物质跟其他物质易分离; ④复原,被提纯的物质要易恢复原状态。 (2)“三必须” ①除杂试剂必须过量; ②过量试剂必须除尽(除去过量试剂带入的新杂质,同时注意加入试剂的顺序); ③选择最佳的除杂途径。 4.常见混合物的除杂 (1)常见固体混合物的除杂 固体混合物(括号内为杂质) 除杂试剂 分离方法 Na2CO3(NaHCO3) 加热 — NaHCO3(Na2CO3) CO2和H2O — NaCl(NH4Cl) — 加热分解 I2(SiO2) 加热 升华 Fe2O3(Al2O3) 过量NaOH溶液 过滤 NH4Cl(FeCl3) 适量氨水 过滤、结晶 KNO3(NaCl) 水 结晶、重结晶 炭粉(CuO) 稀盐酸 过滤 镁粉(铝粉) 过量NaOH溶液 过滤 铁粉(铝粉) 过量NaOH溶液 过滤 (2)常见混合气体的除杂 混合气体(括号内为杂质) 除杂试剂 分离方法 H2(NH3) 浓硫酸 洗气 Cl2(HCl) 饱和NaCl溶液 洗气 CO2(HCl) 饱和NaHCO3溶液 洗气 CO2(SO2) 饱和NaHCO3溶液 洗气 CO2(CO) 灼热CuO — CO(CO2) 石灰乳或NaOH溶液 洗气 NO(NO2) 水 洗气 N2(O2) 灼热铜网 — CH4(C2H4) 溴水 洗气 酸性高锰酸钾和石灰乳 洗气查看更多