- 2021-04-28 发布 |
- 37.5 KB |
- 14页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2019届一轮复习人教版氧化还原反应学案(1)
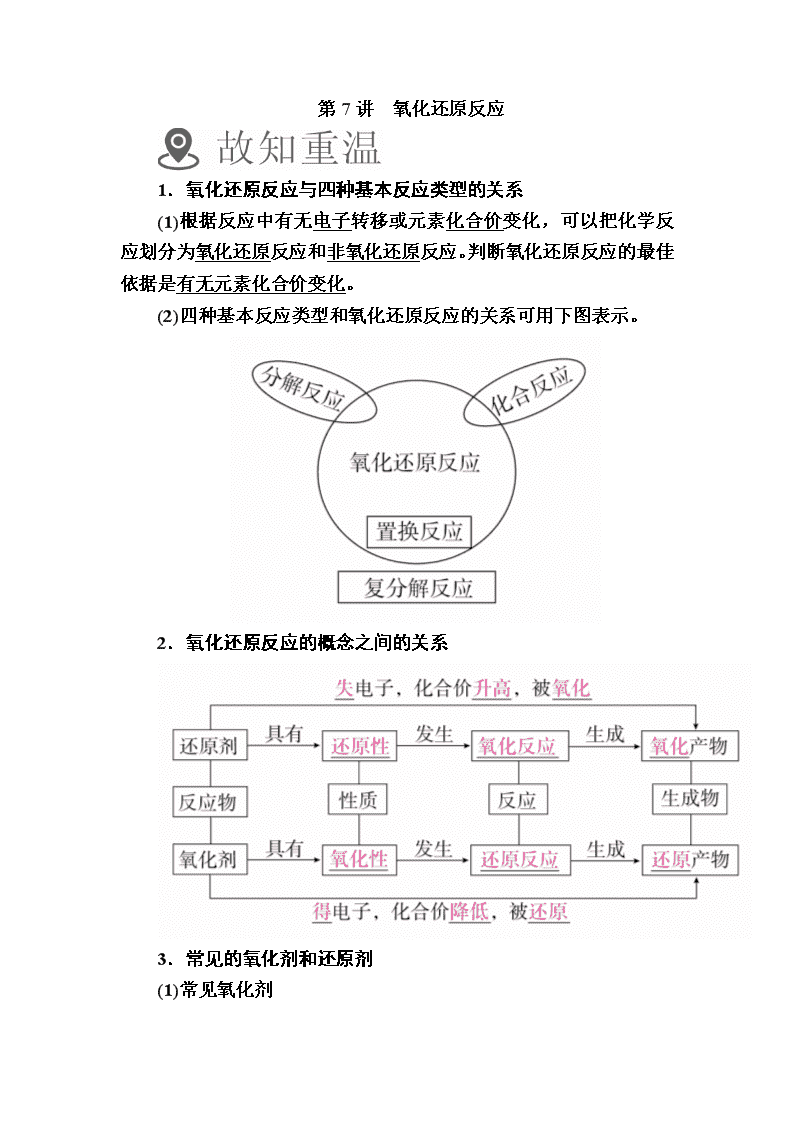
第7讲 氧化还原反应 1.氧化还原反应与四种基本反应类型的关系 (1)根据反应中有无电子转移或元素化合价变化,可以把化学反应划分为氧化还原反应和非氧化还原反应。判断氧化还原反应的最佳依据是有无元素化合价变化。 (2)四种基本反应类型和氧化还原反应的关系可用下图表示。 2.氧化还原反应的概念之间的关系 3.常见的氧化剂和还原剂 (1)常见氧化剂 常见氧化剂包括某些非金属单质、含有高价态元素的化合物、过氧化物等。如:Cl2、浓硫酸、HNO3、Fe3+、KMnO4(H+)、Cr2O(H+)等。 (2)常见还原剂 常见还原剂包括活泼的金属单质、非金属阴离子及含低价态元素的化合物、低价金属阳离子、某些非金属单质及其氢化物等。如:H2、CO、Fe2+、H2S、I-等。 (3)元素化合价处于中间价态的物质既有氧化性,又有还原性。如Fe2+、SO(H2SO3)、H2O2等。 1.正误判断,正确的画“√”,错误的画“×”。 (1)大量的碘富集在海藻中,用水浸取后浓缩,再向浓缩液中加MnO2和H2SO4,即可得到I2。该反应的还原产物为MnSO4或Mn2+。( ) (2)有单质参加或有单质生成的化学反应一定是氧化还原反应。( ) (3)金属阳离子一定只具有氧化性。( ) (4)氧化还原反应中有一种元素被氧化时,一定有另一种元素被还原。( ) (5)在氧化还原反应中H2O2只能是氧化剂不可作还原剂。( ) (6)某元素从游离态变为化合态,该元素可能被氧化也可能被还原。( ) 答案 (1)√ (2)× (3)× (4)× (5)× (6)√ 2.教材改编题 (据人教必修一P39 T8)在Fe+H2SO4===H2↑+FeSO4的反应中,Fe( ) A.是氧化剂 B.被氧化 C.得电子 D.被还原 答案 B 考点1 氧化还原反应的基本概念 典例1 (2017·永丰县调研)新型纳米材料氧缺位铁酸盐(MFe2Ox)(3<x<4;M表示Mn、Co、Zn或Ni的二价离子),常温下,它能使工业废气中的SO2、NO2等氧化物转化为单质,转化流程如图所示:有关上述转化过程的下列叙述正确的是( ) A.MFe2O4表现了还原性 B.MFe2Ox表现还原性 C.SO2和NO2表现了还原性 D.SO2和NO2发生了分解反应 解析 A项,由信息可知,MFe2O4与氢气的反应中,M元素的化合价降低,则为氧化剂,具有氧化性;B项,MFe2Ox在常温下,它能使工业废气中的SO2、NO2等氧化物转化为单质,则氧化物为氧化剂,MFe2Ox为还原剂,体现其还原性;C项,由B可知,SO2和NO2表现了氧化性;D项,SO2和NO2发生了还原反应。 答案 B 名师精讲 1.解决氧化还原反应概念的一般思路 找变价、判类型、分升降、定其他。其中“找变价”是非常关键的一步,特别是不同反应物中含有同种元素的氧化还原反应,必须弄清元素化合价的变化情况,熟记8个字“升、失、氧、还、降、得、还、氧”。 2.确定元素化合价 (1)常见元素的化合价口诀: 一价氢、氯、钾、钠、银;二价氧、钙、镁、钡、锌;三铝、四硅、五价磷;二三铁、二四碳,二四六硫都齐全;铜汞二价最常见。 (2)近几年高考中一些特殊物质中元素化合价: CF2、K2eO4、Li2H、Al、Na22O3、2O、 H、。 1.被称为万能还原剂的NaBH4溶于水并和水反应:NaBH4+2H2O===NaBO2+4H2↑,下列说法中正确的是(NaBH4中H为-1价)( ) A.NaBH4既是氧化剂又是还原剂 B.NaBH4是氧化剂,H2O是还原剂 C.硼元素被氧化,氢元素被还原 D.被氧化的元素与被还原的元素质量之比为1∶1 答案 D 解析 首先分析四种元素价态的变化:Na的价态反应前后都是+1价,B反应前后都是+3价,O反应前后都是-2 价,变价元素只有H,NaBH4中-1价氢被H2O中+1价氢氧化,发生归中反应生成H2。 2.某种飞船以N2H4和N2O4为动力源发生反应:2N2H4+N2O4===3N2+4H2O,反应温度可高达2700 ℃,对于该反应,下列说法中正确的是( ) A.该反应属于置换反应 B.N2H4是氧化剂 C.N2O4是还原剂 D.N2既是氧化产物又是还原产物 答案 D 解析 该反应的反应物中无单质,不属于置换反应;该反应实际上是不同价态的氮元素之间发生的归中反应,N2H4是还原剂,N2O4是氧化剂,N2既是氧化产物又是还原产物。 考点2 电子转移的方向和数目 典例2 (2017·江西赣州模拟)氮化铝(AlN,Al和N的相对原子质量分别为27和14)广泛应用于电子、陶瓷等工业领域,在一定条件下,AlN可通过反应Al2O3+N2+3C2AlN+3CO合成。下列叙述正确的是( ) A.上述反应中,N2是还原剂,Al2O3是氧化剂 B.上述反应中,每生成1 mol AlN需转移3 mol电子 C.AlN中氮元素的化合价为+3价 D.AlN的摩尔质量为41 g 解析 得到2×3e-+3 失去3×2e-O反应中氮元素由0价降低到-3价,碳元素由0价升高到+2价,所以N2是氧化剂,C是还原剂,每生成1 mol AlN转移3 mol电子,D项摩尔质量的单位为g/mol。 答案 B 名师精讲 1.双线桥法 注意事项 ①箭头必须由反应物指向生成物,且两端对准同种元素;②得失电子总数必须相等。 2.单线桥法 注意事项 ①箭头必须由还原剂中失电子的元素指向氧化剂中得电子的元素;②箭头方向表示电子转移的方向;③在“桥”上标明转移的电子总数。 3.对于反应:3BrF3+5H2O===Br2+HBrO3+O2↑+9HF,下列说法正确的是( ) A.该反应中,有三种元素化合价发生改变 B.该反应的氧化剂为BrF3,氧化产物为O2 C.1.5 mol BrF3参加反应,有4 mol e-转移 D.1.5 mol H2O参加反应,被H2O还原的BrF3为0.4 mol 答案 D 解析 BrF3中Br为+3价,反应中部分Br的化合价升高,部分Br的化合价降低,O的化合价升高,F的化合价不变,该反应中BrF3既是氧化剂又是还原剂,氧化产物为HBrO3和O2,还原产物为Br2,A、B错误;每3 mol BrF3参加反应,生成1 mol还原产物Br2,转移6 mol电子,故1.5 mol BrF3参加反应时,转移3 mol电子,C错误;每5 mol H2O参加反应,H2O失去4 mol电子,则1.5 mol H2O参加反应,H2O失去1.2 mol电子,故被H2O还原的BrF3为=0.4 mol,D正确。 4.H2O2在Fe2(SO4)3催化下发生分解反应,写出H2O2分解反应方程式并用双线桥标出电子转移的方向和数目: __________________________________________________________。 答案 解析 硫酸铁在反应中做催化剂,其反应为H2O2分解生成水和氢气,故H2O2中的O元素一部分化合价升高,一部分化合价降低。 (建议用时:40分钟) 一、选择题(每题7分,共84分) 1.下列化工生产过程中,未涉及氧化还原反应的是( ) A.海带提碘 B.氯碱工业 C.侯氏制碱法 D.海水提溴 答案 C 解析 海带提碘要将碘离子氧化为碘单质,故A不符合题意;氯碱工业的原理是2NaCl+2H2O2NaOH+H2↑+Cl2↑,该反应属于氧化还原反应,B不符合题意;侯氏制碱法的反应为NH3+CO2+H2O===NH4HCO3、NaCl+NH4HCO3===NaHCO3↓+NH4Cl、2NaHCO3Na2CO3+CO2↑+H2O,以上反应均为非氧化还原反应,C符合题意;海水提溴要将溴离子氧化为溴单质,故D不符合题意。 2.化学与生活密切相关。下列应用中利用了物质氧化性的是( ) A.明矾净化水 B.纯碱去油污 C.食醋除水垢 D.漂白粉漂白织物 答案 D 解析 A项,明矾净化水,利用Al3+水解生成的Al(OH)3具有吸附性,吸附水中悬浮杂质;B项,纯碱去油污,利用纯碱水解使溶液显碱性,油污在碱性条件下发生水解反应生成可溶性的高级脂肪酸盐和甘油;C项,食醋除水垢,利用的是CH3COOH与CaCO3的复分解反应;D项,漂白粉漂白织物,利用漂白粉溶于水Ca(ClO)2转化为HClO有强氧化性。 3.下列说法错误的是( ) A.(天津高考)Na2SO3与H2O2的反应为氧化还原反应 B.(天津高考)NO2溶于水时发生氧化还原反应 C.(江苏高考)在氧化还原反应中,还原剂失去电子的总数等于氧化剂得到电子的总数 D.(山东高考)化合反应均为氧化还原反应 答案 D 解析 有化合价变化的反应(或有电子转移的反应)为氧化还原反应,Na2SO3与H2O2反应时,硫元素价态升高,氧元素价态降低,A正确;NO2溶于水时,发生反应:3NO2+H2O===2HNO3+NO,氮元素化合价发生变化,则该反应是氧化还原反应,B正确;氧化还原反应中,氧化剂得到电子总数等于还原剂失去电子总数,C正确;有单质参加的化合反应为氧化还原反应,D错误。 4.(2017·合肥调研)亚氨基锂(Li2NH)是一种储氢容量高、安全性好的固体储氢材料,其储氢原理可表示为:Li2NH+H2??LiNH2+LiH,下列有关说法正确的是( ) A.Li2NH中N的化合价是-1 B.LiH的电子式为Li+∶H- C.该反应中H2既是氧化剂又是还原剂 D.LiNH2是还原产物,LiH是氧化产物 答案 C 解析 Li2NH中Li的化合价为+1,H的化合价为+1,故N 的化合价为-3,A错误;LiH为离子化合物,其电子式为Li+[∶H]-,B错误;LiNH2中H的化合价为+1,LiH中的H的化合价为-1,故该反应中H2既是氧化剂又是还原剂,C正确;LiNH2是氧化产物,LiH是还原产物,D错误。 5.把图2中的物质补充到图1中,可得到一个完整的氧化还原反应的离子方程式(未配平)。 对该氧化还原反应的离子方程式,下列说法不正确的是( ) A.IO作氧化剂,具有氧化性 B.氧化性:MnO>IO C.氧化剂和还原剂的物质的量之比为5∶2 D.若有2 mol Mn2+参加反应,则转移10 mol电子 答案 B 解析 结合图1可知Mn2+为反应物,故图2中的MnO为生成物,因此Mn2+作还原剂,被氧化,故图2中的IO作氧化剂,IO为还原产物,因此该反应的离子方程式为2Mn2++5IO+3H2O===2MnO+5IO+6H+。由此可知A、C正确;同一个反应中,氧化剂的氧化性强于氧化产物的氧化性,故氧化性:IO>MnO,B错误;Mn2+~MnO~5e-,若2 mol Mn2+参加反应,则转移10 mol电子,D正确。 6.(创新题) 图中两圆圈相交的阴影部分表示圆圈内物质相互发生的反应,其中属于氧化还原反应,但水既不作氧化剂也不作还原剂的是( ) A.甲 B.乙 C.丙 D.丁 答案 A 解析 甲中发生的反应为3NO2+H2O===2HNO3+NO,水既不作氧化剂也不作还原剂,A正确;乙中水作氧化剂,不符合题意;丙、丁中发生的反应都不是氧化还原反应,也不符合题意。 7.下列实验中,颜色的变化与氧化还原反应有关的是( ) A.往紫色石蕊试液中加入盐酸,溶液变红 B.饱和FeCl3溶液在沸水中变成红褐色胶体 C.向FeSO4溶液中滴加NaOH溶液,生成的沉淀由白色变成灰绿色,最后变成红褐色 D.SO2使滴有酚酞的NaOH溶液褪色 答案 C 解析 向FeSO4溶液中滴加NaOH溶液,首先得到白色沉淀Fe(OH)2,Fe(OH)2迅速与空气中的O2发生氧化还原反应得到红褐色的Fe(OH)3。 8.下列氧化还原反应中,实际参加反应的氧化剂与还原剂的物质的量之比正确的是( ) ①KClO3+6HCl(浓)===KCl+3Cl2↑+3H2O;1∶6 ②3Cu+8HNO3(稀)===3Cu(NO3)2+2NO↑+4H2O;2∶3 ③SiO2+3CSiC+2CO↑;1∶2 ④3NO2+H2O===2HNO3+NO;2∶1 A.①③ B.②③ C.②④ D.①④ 答案 B 解析 结合氧化还原反应中得失电子守恒原理可知,反应①中氧化剂与还原剂的物质的量之比为1∶5;反应④中氧化剂与还原剂的物质的量之比为1∶2。 9.在下列变化中①工业制盐酸 ②工业制漂粉精 ③实验室制氯气,按氯元素被氧化、被还原、既被氧化又被还原的顺序排列,正确的是( ) A.①②③ B.②①③ C.①③② D.③①② 答案 D 解析 ①H2+Cl22HCl,氯元素被还原;②2Cl2+2Ca(OH)2===CaCl2+Ca(ClO)2+2H2O,氯元素既被氧化又被还原;③4HCl(浓)+MnO2MnCl2+Cl2↑+2H2O,氯元素被氧化。 10.工业生产钠和烧碱的原理如下: ①电解熔融氯化钠制钠:2NaCl(熔融)2Na+Cl2↑ ②电解饱和食盐水制烧碱:2NaCl+2H2O2NaOH+H2↑+Cl2↑ 下列有关说法正确的是( ) A.在反应①和②中,氯化钠均既是氧化剂,又是还原剂 B.在反应①中氯气是还原产物,在反应②中氢气是还原产物 C.若标准状况下生成等体积的气体,则反应①和②中转移电子总数相等 D.若消耗等质量的氯化钠,则反应①和②中转移电子总数相等 答案 D 解析 反应②中氯化钠是还原剂,水是氧化剂,A错误;反应①中氯气是氧化产物,B错误;反应①中,转移2 mol电子,生成1 mol气体,反应②中,转移2 mol电子,生成2 mol 气体,C错误;反应①和②中,消耗1 mol氯化钠均转移1 mol电子,D正确。 11.(2017·肇庆期末)汽车剧烈碰撞时,安全气囊中发生反应:10NaN3+2KNO3===K2O+xNa2O+16N2↑,下列说法错误的是( ) A.x=5 B.每生成16 mol N2转移10 mol电子 C.N2既是氧化产物又是还原产物 D.反应中氧化产物与还原产物的质量之比为1∶15 答案 D 解析 据Na原子守恒可知,2x=10,则有x=5,A正确;该反应中,N元素由+5价、-价变为0价,故每生成16 mol N2转移10 mol电子,B正确;该反应中,N元素既被氧化又被还原,则N2既是氧化产物又是还原产物,C正确;生成16 mol N2时,有15 mol N2是氧化产物,1 mol N2是还原产物,则氧化产物与还原产物的质量之比为15∶1,D错误。 12.黑火药爆炸时可发生反应:4S+16KNO3+16C===3K2SO4+4K2CO3+K2S+12CO2↑+8N2↑,下列有关说法正确的是( ) A.S既作氧化剂又作还原剂 B.消耗12 g C时,反应转移5 mol电子 C.还原产物只有K2S D.KNO3只发生氧化反应 答案 A 解析 S元素由0价变为+6价和-2价,化合价既有升高又有降低,则S既作氧化剂又作还原剂,A正确;C元素由0价变为+4价,S元素由0价变为+6价,消耗16 mol C时,转移16 mol×4+3 mol×6=82 mol电子,故消耗12 g C(即1 mol)时,反应转移5.125 mol电子,B错误;该反应中K2S和N2都是还原产物,C错误;KNO3中N元素化合价降低,发生了还原反应,D错误。 二、非选择题(共16分) 13.(6分)(1)根据反应KClO3+6HCl===3Cl2↑+KCl+3H2O可知,每生成3 mol Cl2转移________ mol e-; (2)2Na2O2+2H2O===4NaOH+O2↑,每产生1 mol氧气转移________ mol e-; (3)已知将过氧化钠加入硫酸亚铁盐溶液中发生反应:4Fe2++4Na2O2+6H2O===4Fe(OH)3↓+O2↑+8Na+,每4 mol Na2O2发生反应转移________ mol e-。 答案 (1)5 (2)2 (3)6 解析 (1) (2)2Na2O2+2H2O===4NaOH+O2↑,Na2O2中O元素为-1价,与水反应时O原子一个变为0价,一个变为-2价,转移1 mol e-,故生成1 mol O2转移2 mol e-。 (3)4Fe2++4Na2O2+6H2O===4Fe(OH)3↓+O2↑+8Na+; Fe +2―→+3↑ 1×4=4; O -1―→0↑ 1×2=2; O -1―→-2↓ 1×6=6。 故每4 mol Na2O2发生反应转移6 mol e-。 14.(10分)(1)氯酸是一种强酸,氯酸的浓度超过40%就会迅速分解,反应的化学方程式为:8HClO3===3O2↑+2Cl2↑+4HClO4+2H2O。根据题意完成下列小题: ①在上述变化过程中,发生还原反应的过程是________→________。(填化学式) ②该反应的氧化产物是____________(填化学式);所得混合气体的平均相对分子质量为________。 (2)已知测定锰的一种方法是:锰离子转化为高锰酸根离子,反应体系中有H+、Mn2+、H2O、IO、MnO、IO。 ①有关反应的离子方程式为____________________________。 ②在锰离子转化为高锰酸根离子的反应中,如果把反应后的溶液稀释到1 L,测得溶液的pH=2,则在反应中转移电子的物质的量为________mol。 答案 (1)①HClO3 Cl2 ②O2和HClO4 47.6 (2)①2Mn2++5IO+3H2O===2MnO+5IO+6H+ ②1/60(或0.0167) 解析 (1)①根据方程式中化合价的升降可以判断出+5价的氯被还原为0价,故还原过程为HClO3→Cl2。②方程式中化合价升高的有两种元素,故氧化产物是O2和HClO4;混合气体(O2和Cl2)的平均相对分子质量计算如下:(3×32+2×71)÷5=47.6。 (2)①根据题意和氧化还原反应书写规律可以得出2Mn2++5IO+3H2O===2MnO+5IO+6H+。②根据离子方程式,每生成6 mol H+,转移电子的物质的量为10 mol,当1 L溶液的pH=2时,生成n(H+)=0.01 mol,则转移电子的物质的量为1/60 mol。查看更多