- 2021-04-28 发布 |
- 37.5 KB |
- 49页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2018届二轮复习电化学课件(49张)(全国通用)
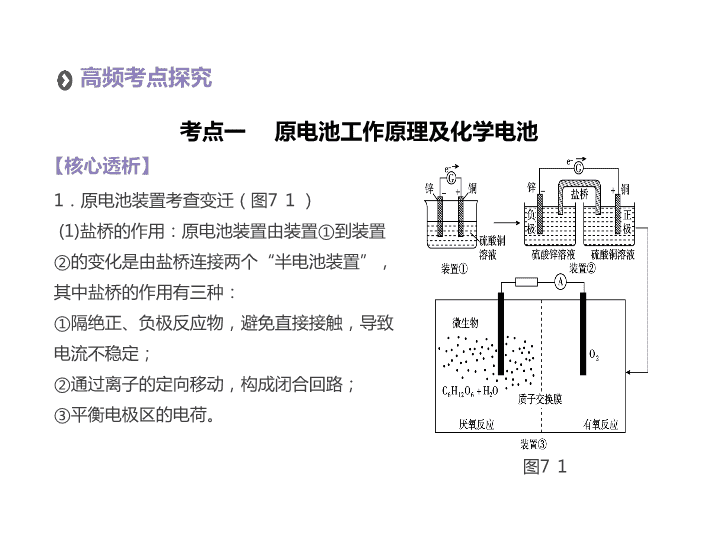
PART 2 第二单元 专题七 电化学 高频考点探究 命题考向追踪 教师备用习题 · · · 考纲展示 1. 了解原电池和电解池的构成、工作原理及应用,能书写电极反应和总反应方程式。了解常见化学电源的种类及其工作原理。 2. 理解金属发生电化学腐蚀的原因、金属腐蚀的危害以及防止金属腐蚀的措施。 高频考点探究 1 .原电池装置考查变迁 ( 图 71 ) (1) 盐桥的作用:原电池装置由装置 ① 到装置 ② 的变化是由盐桥连接两个 “ 半电池装置 ” ,其中盐桥的作用有三种: ① 隔绝正、负极反应物,避免直接接触,导致电流不稳定; ② 通过离子的定向移动,构成闭合回路; ③ 平衡电极区的电荷。 【 核心透析 】 考点一 原电池工作原理及化学电池 图 71 (2) 离子交换膜的作用:由装置②到装置③的变化是“盐桥”变成“质子交换膜”。离子交换膜是一种选择性透过膜,允许相应离子通过,离子迁移方向遵循电池中离子迁移方向。 2 .图解原电池的闭合回路形成原理 图 72 【 典例探究 】 考查角度一 燃料电池 例 1 [2016· 全国卷Ⅲ ] 锌 空气燃料电池可用作电动车动力电源,电池的电解质溶液为 KOH 溶液,反应为 2Zn + O 2 + 4OH - + 2H 2 O=2Zn(OH) 4 2- 。下列说法正确的是 ( ) A .充电时,电解质溶液中 K + 向阳极移动 B .充电时,电解质溶液中 c (OH - ) 逐渐减小 C .放电时,负极反应为 Zn + 4OH - - 2e - =Zn(OH) 4 2- D .放电时,电路中通过 2 mol 电子,消耗氧气 22.4 L( 标准状况 ) 【 答案 】C 【 解析 】 充电时该电池为电解池,电解质溶液中阳离子向阴极移动,故 K + 向阴极移动, A 项错误;充电时的总反应为 2Zn(OH) 4 2- =2Zn + O 2 + 4OH - + 2H 2 O ,因此 c (OH - ) 逐渐增大, B 项错误;放电时负极上 Zn 发生氧化反应,负极反应为 Zn + 4OH - - 2e - =Zn(OH) 4 2- , C 项正确;放电时的正极反应为 O 2 + 4e - + 2H 2 O=4OH - ,电路中通过 2 mol 电子时,消耗 O 2 0.5 mol ,在标准状况下的体积为 11.2 L , D 项错误。 变式 某化学小组拟设计微生物燃料电池将污水中的乙二胺氧化成对环境友好的物质,工作原理如图 73 所示 (a 、 b 均为石墨电极 ) 。下列分析正确的是 ( ) A . a 电极发生反应: H 2 NCH 2 CH 2 NH 2 + 16e - + 4H 2 O=2CO 2 ↑+ N 2 ↑+ 16H + B .质子交换膜处 H + 由右向左移动 C .该电池在微生物作用下将化学能转化为电能 D .开始放电时 b 极附近 pH 不变 图 73 【 答案 】 C 【 解析 】 b 电极通入的是空气,则为 O 2 放电,是电源的正极, a 极为负极,电子从 a 电极经外电路流向 b 极。 A 电极反应为 H 2 NCH 2 CH 2 NH 2 - 16e - + 4H 2 O=2CO 2 ↑+ N 2 ↑+ 16H + , A 项错误;根据原电池的工作原理,阳离子 ( 此电池中的 H + ) 向正极移动, B 项错误;原电池装置是将化学能转化为电能的装置, C 项正确; b 电极反应式为 O 2 + 4H + + 4e - =2H 2 O ,溶液 pH 增大, D 项错误。 34 方法技巧 燃料电池电极反应方程式的书写技巧 燃料电池是一种将存在于燃料与氧化剂中的化学能直接转化为电能的发电装置。由于电池总反应式与燃料燃烧方程式相似而得名,由于条件不同,燃料并非真的燃烧。另外,燃料电池的考查重点在不同条件下的电解质溶液,如酸性、碱性、中性、熔融碳酸盐、熔融氧化物等,其书写关键可以归结为一句话:“什么环境下用什么离子平衡电性。”如正极反应式书写: 考查角度二 典型二次电池 例 2 某种锂离子二次电池的总反应为 FePO 4 (s) + Li(s) LiFePO 4 (s) ,装置如图 74 所示 (a 极材料为金属锂和石墨的复合材料 ) 。下列说法不正确的是 ( ) A .图中 e - 及 Li + 移动方向说明该 电池处于放电状态 B .该电池中 a 极不能接触水溶液 C .充电时 a 极连接外接电源的正极 D .充电时, b 极电极反应式为 LiFePO 4 - e - =Li + + FePO 4 图 74 【 答案 】 C 【 解析 】 由图示知为放电状态, a 是负极, b 是正极, A 项正确; Li 为活泼金属,能够与水反应,故 Li 不能接触水溶液, B 项正确;充电时, a 电极连接电源的负极, b 极连接电源的正极, C 项错误;充电时, b 为阳极,反应方程式为 LiFePO 4 - e - =Li + + FePO 4 , D 项正确。 变式 1 高铁电池是以高铁酸盐 (K 2 FeO 4 ) 和锌为电极材料的电池,具有能量密度大、体积小、重量轻、寿命长、无污染等优点。电池的总反应为 3Zn + 2K 2 FeO 4 + 8H 2 O 3Zn(OH) 2 + 2Fe(OH) 3 + 4KOH 。下列说法正确的是 ( ) A .充电时阳极反应式为 Zn - 2e - + 2OH - =Zn(OH) 2 B . 0.1 mol K 2 FeO 4 发生反应,转移电子数约为 1.806×10 24 C .充电时 K 2 FeO 4 发生氧化反应 D .放电时正极反应为 2FeO 4 2- + 6e - + 8H 2 O=2Fe(OH) 3 + 10OH - 【 答案 】D 【 解析 】 放电时,正极反应为 2FeO 4 2- + 6e - + 8H 2 O=2Fe(OH) 3 + 10OH - ,则充电时阳极反应为 2Fe(OH) 3 + 10OH - - 6e - =2FeO 4 2- + 8H 2 O , A 项错误;根据反应关系 FeO 4 2- ~ 3e - 可知 0.1 mol K 2 FeO 4 发生反应转移电子的物质的量为 0.1 mol×3 = 0.3 mol ,则转移电子数约为 0.3×6.02×10 23 = 1.806×10 23 , B 项错误;放电时,正极 K 2 FeO 4 发生还原反应,充电时, K 2 FeO 4 是氧化产物, C 项错误;放电时,正极上得电子发生还原反应,电极反应式为 2FeO 4 2- + 6e - + 8H 2 O=2Fe(OH) 3 + 10OH - , D 项正确。 变式 2 一种碳纳米管新型二次电池的装置如图 75 所示。下列说法中正确的是 ( ) A .离子交换膜选用阳离子交换膜 ( 只允许阳离子通过 ) B .正极的电极反应为 NiO (OH) + H 2 O + e - =Ni(OH) 2 + OH - C .导线中通过 1 mol 电子时,理论上负极 区溶液质量增加 1 g D .充电时,碳电极 与电源的正极相连 图 75 【 答案 】 B 【 解析 】 根据装置图,碳电极通入氢气,发生氧化反应,电极反应为 H 2 - 2e - + 2OH - =2H 2 O , Ni 电极发生反应 NiO (OH) + H 2 O + e - =Ni(OH) 2 + OH - ,碳电极是负极, Ni 电极是正极。根据上述分析,离子交换膜选用阴离子交换膜 ( 只允许阴离子通过 ) , A 项错误;正极电极反应为 NiO (OH) + H 2 O + e - =Ni(OH) 2 + OH - , B 项正确;导线通过 1 mol 电子时,负极生成 1 mol 水,理论上负极区溶液质量增加 18 g , C 项错误;充电时,负极碳电极与电源负极相连,所以碳电极与电源的负极相连, D 项错误。 方法技巧 突破二次电池的四个角度 考查角度三 电极可变的可逆电池 例 3 控制适合的条件,将反应 2Fe 3 + + 2I - ⇌2Fe 2 + + I 2 设计成如图 76 所示的原电池。下列判断不正确的是 ( ) A .反应开始时,乙中发生氧化反应 B .反应开始时,甲中 Fe 3 + 被还原 C .电流计读数为零时,反 应达到化学平衡状态 D .电流计读数为零后,在 甲中溶入 FeCl 2 固体,乙中 的石墨电极为负极 图 74 【 答案 】D 【 解析 】 因乙中 I - 失去电子放电,元素的化合价升高,则发生氧化反应,故 A 正确;由总反应方程式知, Fe 3 + 被还原成 Fe 2 + ,则发生还原反应,故 B 正确;当电流计读数为零时,说明没有电子发生转移,则反应达到平衡,故 C 正确;当加入 Fe 2 + ,导致平衡逆向移动,则 Fe 2 + 失去电子生成 Fe 3 + ,作负极,而乙中石墨作正极,故 D 错误。 变式 将反应 2Fe 3 + + 2I - ⇌2Fe 2 + + I 2 设计成如图 77 所示的原电池。 下列说法不正确的是 ( ) A .盐桥中的 K + 移向 FeCl 3 溶液 B .反应开始时,乙中石墨 电极上发生氧化反应 C .电流计读数为零时,反 应达到化学平衡状态 D .电流计读数为零后,在甲中溶入 FeCl 2 固体,乙中石墨电极为负极 图 76 【 答案 】D 【 解析 】 甲池中石墨电极为正极,乙池中石墨电极为负极,盐桥中阳离子向正极移动,所以 K + 向 FeCl 3 溶液迁移, A 项正确;反应开始时,乙中 I - 失去电子,发生氧化反应, B 项正确;当电流计读数为零时,说明没有电子发生转移,反应达到平衡, C 项正确;当加入 Fe 2 + ,导致平衡逆向移动,则 Fe 2 + 失去电子生成 Fe 3 + ,作为负极,而乙中石墨成为正极, D 项错误。 规律小结 可逆电池背后都有一个可逆的氧化还原反应,通过化学反应平衡的移动使电池的正、负极发生改变,同时引起电流方向、电流表指针方向发生改变。目前,高中常见的此类电池有 2Fe 3 + + 2I - ⇌2Fe 2 + + I 2 、 AsO 4 3- + 2I - + 2H + ⇌ AsO 3 3- + I 2 + H 2 O 。此类电池中电流表指针归零时说明反应达到平衡了,并非反应停止。 考查角度四 电化学学科交叉计算 例 4 (1)[2015· 全国卷Ⅱ ] 酸性锌锰干电池是一种一次性电池,外壳为金属锌,中间是碳棒,其周围是由碳粉、 MnO 2 、 ZnCl 2 和 NH 4 Cl 等组成的糊状填充物。该电池放电过程产生 MnOOH 。 ①该电池的正极反应式为 ________________ ,电池反应的离子方程式为 _____________ 。 ②维持电流强度为 0.5 A ,电池工作 5 分钟,理论上消耗锌 ____g 。 ( 已知 F = 96 500 C·mol - 1 ) (2) 二甲醚 (CH 3 OCH 3 ) 是无色气体,可作为一种新型能源。二甲醚直接燃料电池具有启动快、效率高等优点,其能量密度高于甲醇直接燃料电池 (5.93 kW·h·kg - 1 ) 。若电解质为酸性,二甲醚直接燃料电池的负极反应为 _________________ , 一个二甲醚分子经过电化学氧化,可以产生 ______ 个电子的电量;该电池的理论输出电压为 1.20 V ,能量密度 E = _________( 列式计算。能量密度=电池输出电能 / 燃料质量, 1 kW · h = 3.6×10 6 J) 。 变式 新型固体燃料电池的电解质是固体氧化锆和氧化钇,高温下允许氧离子 (O 2 - ) 在其间通过。如图 78 所示,其中多孔电极不参与电极反应。 (1) 该电池的负极反应式为 ________________ 。 (2) 如果用该电池作为电解装置,当有 16 g 甲醇发生反应时,则 理论上提供的电 量表达式为 ____ C(1 个电子的电 量为 1.6×10 - 19 C) 。 图 78 【 答案 】 (1)CH 3 OH - 6e - + 3O 2 - =CO 2 ↑+ 2H 2 O (2)0.5 mol×6×1.6×10 - 19 C · mol - 1 × 6.02 × 10 23 或 2.890×10 5 C 【 解析 】 (1) 以固体氧化锆和氧化钇为电解质,这种固体电解质在高温下允许氧离子 (O 2 - ) 在其间通过,分析该电池的工作原理可知负极是甲醇失电子发生氧化反应,结合导电离子和电荷守恒分析书写电极反应为 CH 3 OH - 6e - + 3O 2 - =CO 2 ↑+ 2H 2 O ; (2)16 g 甲醇物质的量= 16 g÷32 g/mol = 0.5 mol ,发生反应时电子转移 0.5 mol × 6 = 3 mol ,则理论上提供的电量最多为 3 mol × 1.6 × 10 - 19 C · mol - 1 × 6.02 × 10 23 = 2.890×10 5 C 。 方法技巧 学科交叉的计算主要公式 化学与物理结合的计算,主要涉及两个公式: ① Q = It = n (e - ) F , F 计算时一般取值 96 500 C/mol 。 ② W = Uit 。 【 核心透析 】 考点二 电解池的工作原理及其应用 1 .电解池工作原理示意图 ( 阳极为惰性电极 ) 2. 电解的放电规律 (1) 阴极放电规律: Ag + >Fe 3 + >Cu 2 + >H + >Pb 2 + >Sn 2 + >Fe 2 + >Zn 2 + >(H + 水 )>Al 3 + >Mg 2 + >Na + >Ca 2 + >K + (2) 阳极放电规律:活性电极 >S 2 - >SO 3 2- >I - >Br - > Cl - >OH - > 含氧酸根离子 >F - 例 5 次磷酸 (H 3 PO 2 ) 是一种精细磷化工产品,具有较强还原性。 H 3 PO 2 可用电渗析法制备,“四室电渗析法 ” 工作原理如图 79 所示 ( 阳膜和阴膜分别只允许阳离子、阴离子通过 ) : (1) 写出阳极的电极反应式: _______________________________________ 。 (2) 分析产品室可得到 H 3 PO 2 的原因: __________________________________ 。 【 典例探究 】 图 7-9 (3) 早期采用 “ 三室电渗析法 ” 制备 H 3 PO 2 :将 “ 四室电渗析法 ” 中阳极室的稀硫酸用 H 3 PO 2 稀溶液代替,并撤去阳极室与产品室之间的阳膜,从而合并了阳极室与产品室。其缺点是产品中混有 ____________ 杂质,该杂质产生的原因是 _________________ 。 【 答案 】 (1)2H 2 O - 4e - =O 2 ↑+ 4H + (2) 阳极室的 H + 穿过阳膜扩散至产品室,原料室的 H 2 PO 2 - 穿过阴膜扩散至产品室,二者反应生成 H 3 PO 2 (3)PO 4 3- H 2 PO 2 - 或 H 3 PO 2 被氧化 【 解析 】 (1) 阳极是水电离出的 OH - 放电,其反应式为 2H 2 O - 4e - =O 2 ↑+ 4H + ; (2) 阳极室中的 H + 穿过阳膜进入产品室,原料室的 H 2 PO 2 - 穿过阴膜扩散至产品室,二者反应生成 H 3 PO 2 ; (3) 阳极室内可能有部分 H 2 PO 2 - 或 H 3 PO 2 失电子发生氧化反应,导致生成物中混有 PO 4 3- 。 变式 双极膜 (BP) 是阴、阳复合膜,在直流电的作用下,阴、阳膜复合层间的 H 2 O 解离成 H + 和 OH - ,作为 H + 和 OH - 离子源。利用双极膜电渗析法电解食盐水可获得淡水、 NaOH 和 HCl ,其工作原理如图 710 所示, M 、 N 为离子交换膜。下列说法错误的是 ( ) A .阴极室发生的反应为 2H + + 2e - =H 2 ↑ B . M 为阳离子交换膜, N 为阴离子交换膜 C .若去掉双极膜 (BP) ,阳极室会有 Cl 2 生成 D .电路中每转移 1 mol 电子,两极共得到 0.5 mol 气体 图 710 【 答案 】 D 【 解析 】 阴极室发生还原反应 2H + + 2e - =H 2 ↑, A 项正确;电解后浓盐水变为淡水,则 Na + 、 Cl - 通过 M 、 N 膜除去,则 Na + 移向左侧生成 NaOH , Cl - 移向右侧生成 HCl , B 项正确;若去掉双极膜,迁移至阳极的 Cl - 放电产生氯气, C 项正确;阴、阳极产生的气体分别是氢气和氧气,当电路中每转移 1 mol 电子,阴极生成 0.5 mol 氢气、 0.25 mol 氧气, D 项错误。 例 6 [2017· 全国卷Ⅱ ] 用电解氧化法可以在铝制品表面形成致密、耐腐蚀的氧化膜,电解质溶液一般为 H 2 SO 4 H 2 C 2 O 4 混合溶液。下列叙述错误的是 ( ) A .待加工铝质工件为阳极 B .可选用不锈钢网作为阴极 C .阴极的电极反应式为 Al 3 + + 3e - =Al D .硫酸根离子在电解过程中向阳极移动 【 答案 】C 【 解析 】 Al 制品表面要形成氧化膜,铝被氧化失电子,因此电解时铝为阳极, A 项正确;根据电解原理可知,不锈钢网接触面积大,电解效率高, B 项正确;阴极反应为 2H + + 2e - =H 2 ↑, C 项错误;电解时,电解质溶液中的阴离子向阳极移动, D 项正确。 变式 人工肾脏可用间接电化学方法除去代谢产物中的尿素 [CO(NH 2 ) 2 ] ,原理如图 711 。下列有关说法正确的是 ( ) A . a 为电源的负极 B .电解结束后,阴极室溶液的 pH 与电解前相比将升高 C .阳极室中发生的电极反应为 2H + + 2e - =H 2 ↑ D .若两极共收集到气体 13.44 L( 标准状况 ) ,则除去的尿素为 7.2 g( 忽略气体的溶解 ) 图 711 【 答案 】 D 【 解析 】 由图可知,右室电解产物为 H 2 ,发生还原反应,故 b 为电源的负极, A 项错误;阴极反应为 6H 2 O + 6e - =6OH - + 3H 2 ↑ ( 或 6H + + 6e - =3H 2 ↑ ) ,阳极反应为 6Cl - - 6e - =3Cl 2 ↑, CO(NH 2 ) 2 + 3Cl 2 + H 2 O=N 2 + CO 2 + 6HCl ,根据上述反应式可以看出在阴、阳极上产生的 OH - 、 H + 的数目相等,阳极室中反应产生的 H + 通过质子交换膜进入阴极室与 OH - 恰好反应生成水,所以阴极室中电解前后溶液的 pH 不变, B 项错误;由图可知,阳极室首先是氯离子放电生成氯气,氯气再氧化尿素生成氮气、二氧化碳,同时会生成 HCl ,阳极室中发生的反应依次为 2Cl - - 2e - =Cl 2 ↑, CO(NH 2 ) 2 + 3Cl 2 + H 2 O=N 2 + CO 2 + 6HCl , C 项错误;电解收集到的 13.44 L 气体,物质的量为 0.6 mol ,由反应 2HCl H 2 ↑+ Cl 2 ↑、 CO(NH 2 ) 2 + 3Cl 2 + H 2 O=N 2 + CO 2 + 6HCl 可知 n (N 2 ) = n (CO 2 ) = 0.6 mol×1/5 = 0.12 mol ,可知生成 0.12 mol N 2 所消耗的 CO(NH 2 ) 2 的物质的量也为 0.12 mol ,其质量为 m [CO(NH 2 ) 2 ] = 0.12 mol×60 g · mol - 1 = 7.2 g , D 项正确。 电解时电极反应方程式的书写步骤 方法技巧 【 核心透析 】 考点三 金属腐蚀及其防护 1 .影响金属腐蚀的两个因素 (1) 对于金属本性来说,金属越活泼,就越容易失去电子而被腐蚀。 (2) 电解质溶液对金属的腐蚀的影响也很大,如果金属在潮湿的空气中,接触腐蚀性气体或电解质溶液,都容易被腐蚀。 2 .金属腐蚀快慢的三个规律 (1) 金属腐蚀类型的差异 电解原理引起的腐蚀>原电池原理引起的腐蚀>化学腐蚀>有防护腐蚀措施的腐蚀。 (2) 电解质溶液的影响 ①对同一金属来说,腐蚀的快慢 ( 浓度相同 ) :强电解质溶液>弱电解质溶液>非电解质溶液。 ②对同一种电解质溶液来说,一般电解质溶液浓度越大,腐蚀越快。 (3) 活泼性不同的两金属与电解质溶液构成原电池时,一般活泼性差别越大,负极腐蚀越快。 3 .两种腐蚀与三种保护 (1) 两种腐蚀:析氢腐蚀、吸氧腐蚀 ( 关键在于电解液的 pH) (2) 三种保护:电镀保护、牺牲阳极的阴极保护法、外加电流的阴极保护法 例 7 [2017· 全国卷Ⅰ ] 支撑海港码头基础的钢管桩,常用外加电流的阴极保护法进行防腐,工作原理如图 712 所示,其中高硅铸铁为惰性辅助阳极。下列有关表述不正确的是 ( ) A .通入保护电流使钢管桩表面腐蚀电流接近于零 B .通电后外电路电子被强制从高硅铸铁流向钢管桩 C .高硅铸铁的作用是作为损耗阳极材料和传递电流 D .通入的保护电流应该根据环境条件变化进行调整 【 典例探究 】 图 7-12 【 答案 】C 【 解析 】 由图示知,该装置为通过 “ 外加电流的阴极保护法 ” 进行防腐的装置,因此需外加强大的电流抑制金属电化学腐蚀产生电流,即通入保护电流使钢管桩表面腐蚀电流接近于零, A 项正确;通电后,被保护的钢管桩作阴极,高硅铸铁作阳极,因此通电后外电路电子被强制从高硅铸铁流向钢管桩, B 项正确;高硅铸铁为惰性辅助阳极,所以高硅铸铁不损耗, C 项错误;外加电流的目的是抑制金属电化学腐蚀产生电流,因此通入的保护电流应该根据环境条件变化进行调整, D 项正确。 变式 一定条件下,某含碳钢腐蚀情况与溶液 pH 的关系如下表,下列说法正确的是 ( ) 【 答案 】B 【 解析 】 表中显示 pH 在 2 ~ 4 、 13.5 ~ 14 时,该碳钢腐蚀速率较快,而 pH 在 6 ~ 8 时,腐蚀速率较慢, A 项错误;铁在酸性较强的溶液中发生析氢腐蚀, B 项正确;铁在碱性环境发生吸氧腐蚀,故电极反应中不可能生成 H + , C 项错误;钢铁在碱性环境中发生吸氧腐蚀,若煮沸除去氧气则不宜发生腐蚀, D 项错误。 pH 2 4 6 6.5 8 13.5 14 腐蚀快慢 较快 慢 较快 主要产物 Fe 2 + Fe 3 O 4 Fe 2 O 3 FeO 2 - A .随 pH 的升高,碳钢腐蚀速率逐渐加快 B .当 pH<4 时,发生析氢腐蚀 C . pH 为 14 ,其负极反应为 2H 2 O + Fe - 3e - =FeO 2 - + 4H + D .在煮沸除氧气后的碱性溶液中,碳钢腐蚀的速率会加快 规律小结 命题考向追踪 【 历年动态 】 【 答案 】 B 【 解析 】 该电池中还原性较强的 Mg 为负极,失去 2 个电子发生氧化反应, A 项正确;氧化性较强的 AgCl 为正极,发生还原反应, AgCl (s) ⇌ Ag + ( aq ) + Cl - ( aq ) 、 Ag + + e - =Ag , AgCl 是难溶盐,则正极反应式为 AgCl + e - =Ag + Cl - , B 项错误;由于 Mg 失去电子成为 Mg 2 + ,使负极区域带正电, AgCl 得到电子生成 Ag 和 Cl - ,使正极区域带负电,因此 Cl - 由正极向负极迁移,使电解质溶液保持电中性, C 项正确;氧化还原反应为放热反应,镁与热水能发生置换反应生成 Mg(OH) 2 和 H 2 , D 项正确。 1 . [2016· 全国卷Ⅱ ] MgAgCl 电池是一种以海水为电解质溶液的水激活电池。下列叙述错误的是 ( ) A .负极反应式为 Mg - 2e - =Mg 2 + B .正极反应式为 Ag + + e - =Ag C .电池放电时 Cl - 由正极向负极迁移 D .负极会发生副反应 Mg + 2H 2 O=Mg(OH) 2 + H 2 ↑ 实验一 实验二 装置 现象 a 、 d 处试纸变蓝; b 处变红,局部褪色; c 处无明显变化 两个石墨电极附近有气泡产生; n 处有气泡产生; …… 2 . [2016· 北京卷 ] 用石墨电极完成下列电解实验。 下列对实验现象的解释或推测不合理的是 ( ) A . a 、 d 处: 2H 2 O + 2e - =H 2 ↑+ 2OH - B . b 处: 2Cl - - 2e - =Cl 2 ↑ C . c 处发生了反应: Fe - 2e - =Fe 2 + D .根据实验一的原理,实验二中 m 处能析出铜 【 答案 】 B 【 解析 】 a 、 d 处试纸变蓝,说明溶液显碱性,是溶液中的氢离子得到电子生成氢气,氢氧根离子剩余造成的,故 A 项正确; b 处变红,局部褪色,说明是溶液中的氢氧根离子和氯离子同时放电,故 B 项错误; c 处为阳极,铁失去电子生成亚铁离子,故 C 项正确;实验一中 ac 形成电解池, db 形成电解池,所以实验二中也相当于形成三个电解池 ( 一个球两面为不同的两极 ) , m 为电解池的阴极,另一球朝 m 的一面为阳极 (n 的背面 ) ,故相当于电镀,即 m 上有铜析出,故 D 项正确。 3 . [2016· 天津卷 ] 氢能是发展中的新能源,它的利用包括氢的制备、储存和应用三个环节。回答下列问题: (1) 与汽油相比,氢气作为燃料的优点是 ___________( 至少答出两点 ) 。但是氢气直接燃烧的能量转换率远低于燃料电池,写出碱性氢氧燃料电池的负极反应式: _____________________________________ 。 (2) 化工生产的副产氢是氢气的一种来源。电解法制取有广泛用 途的 Na 2 FeO 4 ,同时获得氢气: Fe + 2H 2 O + 2OH - FeO 4 2- + 3H 2 ↑,工作原理如图 713(a) 所示。装置通电后,铁电极附近 生成紫红色 FeO 4 2- ,镍电极有气泡产生。若氢氧化钠溶液浓度过 高,铁电极区会产生红褐色物质。已知: Na 2 FeO 4 只在强碱性条 件下稳定,易被 H 2 还原。 图 713 ①电解一段时间后, c (OH - ) 降低的区域在 ________( 填 “ 阴极室 ” 或 “ 阳极室 ”) 。 ②电解过程中,须将阴极产生的气体及时排出,其原因为 __________ 。 ③ c (Na 2 FeO 4 ) 随初始 c ( NaOH ) 的变化如图 (b) ,任选 M 、 N 两点中的一点,分析 c (Na 2 FeO 4 ) 低于最高值的原因: ________ 。 图 713 【 答案 】 (1) 污染小;可再生;来源广;资源丰富;燃烧热值高 ( 任写其中 2 个 ) H 2 + 2OH - - 2e - =2H 2 O (2)① 阳极室 ②防止 Na 2 FeO 4 与 H 2 反应使产率降低 ③ M 点: c (OH - ) 低, Na 2 FeO 4 稳定性差,且反应慢 N 点: c (OH - ) 过高,铁电极上有 Fe(OH) 3 ( 或 Fe 2 O 3 ) 生成,使 Na 2 FeO 4 产率降低 【 解析 】 (1) 氢气相对于汽油等化石能源,其优点有污染小、可再生、来源广、资源丰富、燃烧热值高等。 (2) 依据装置及电解原理,其阳极的电极反应式为 Fe - 6e - + 8OH - =FeO 4 2- + 4H 2 O ,阴极的电极反应式为 6H 2 O + 6e - =6OH - + 3H 2 ↑,故 c (OH - ) 在阳极区减小,在阴极区增大;由已知条件可知,若不及时排出 H 2 , H 2 会还原 FeO 使其浓度减小,产率降低。 4 . (1)[2015· 山东卷 ] 利用 LiOH 和钴氧化物可制备锂离子电池正极材料。 LiOH 可由电解法制备,钴氧化物可通过处理钴渣获得。 利用如图 714 装置电解制备 LiOH ,两电极区电解液分别为 LiOH 和 LiCl 溶液。 B 极区电解液为 ________( 填化学式 ) 溶液,阳极电极反应式为 _________ ,电解过程中 Li + 向 ________( 填 “A” 或 “B”) 电极迁移。 (2)[2015· 重庆卷 ] 如图 715 为青铜器在潮湿环境中发生电化学腐蚀的原理示意图。 ①腐蚀过程中,负极是 ______( 填图中字母 “a” 或 “b” 或 “c”) ; ②环境中的 Cl - 扩散到孔口,并与正极反应产物和负极反应产物作用生成多孔粉状锈 Cu 2 (OH) 3 Cl ,其离子方程式为 ____________ ; ③若生成 4.29 g Cu 2 (OH) 3 Cl ,则理论上耗氧体积为 _____L( 标准状况 ) 。 图 714 图 715 5 . 一种钌 ( Ru ) 配合物光敏太阳能电池工作原理及电池中发生的反应如图 716 所示: 下列说法正确的是 ( ) A .电极 X 为电池的正极 B .电池工作时,电能转变为光能 C .电池工作时,电极 Y 上发生还原反应 D .电池的电解质溶液中 I - 和 I 3 - 的浓度不断减少 【2018 预测 】 ① Ru Ⅱ Ru Ⅱ * ( 激发态 ) ② Ru Ⅱ * ―→ Ru Ⅲ + e - ③ Ru Ⅲ + 3/2I - ―→ Ru Ⅱ + 1/2I 3 - ④1/2I 3 - + e - ―→ 3/2I - 图 716 6. 氢碘酸 (HI) 可用 “ 四室式电渗析法 ” 制备,其工作原理如图 717 所示 ( 阳膜和阴膜分别只允许阳离子、阴离子通过 ) 。下列叙述错误的是 ( ) A .通电后,阴极室溶液 pH 增大 B .阳极电极反应式是 2H 2 O - 4e - =4H + + O 2 ↑ C .得到 1 mol 产品 HI ,阳极室溶液质量减少 8 g D .通电过程中, NaI 的浓度逐渐减小 图 717 【 答案 】C 【 解析 】 通电后,阴极室上是氢氧化钠溶液中水电离出的 H + 放电,则溶液 pH 增大, A 项正确;阳极上是硫酸溶液中水电离出的 OH - 失电子发生氧化反应,电极反应式是 2H 2 O - 4e - =4H + + O 2 ↑, B 项正确;得到 1 mol 产品 HI ,则转移 1 mol 电子,又阳极电极反应式是 2H 2 O - 4e - =4H + + O 2 ↑,所以消耗 0.5 mol 水即 9 g 水, C 项错误;通电过程中,在阴极上是氢氧化钠溶液中水电离出的 H + 放电,导致溶液带负电性,吸引原料室中的 Na + 移向阴极,则 I - 移向产品室,所以 NaI 的浓度逐渐减小, D 项正确。 1 . 一种微生物燃料电池如图所示,下列关于该电池说法正确的是 ( ) A . a 电极为正极 B . H + 由右室通过质 子交换膜进入左室 C . a 电极反应式为 C 6 H 5 OH - 28e - + 11H 2 O=6CO 2 ↑+ 28H + D .当 b 电极上产生 1 mol N 2 时,溶液中将有 10 mol e - 通过 教师备用习题 【 答案 】C 【 解析 】 从图中 b 电极 NO 3 - 得电子变成 N 2 知, b 是正极, a 是负极, A 项错误; H + 由左室通过质子交换膜进入右室, B 项错误;在酸性条件下,苯酚失电子, a 电极反应式为 C 6 H 5 OH - 28e - + 11H 2 O=6CO 2 ↑+ 28H + , C 项正确;电子从外电路导线中通过,不从溶液中通过, D 项错误。 2 . 用惰性电极电解 FeSO 4 溶液制备高纯铁的原理如下图所示。下列说法错误的是 ( ) A .阳极主要发生反应: Fe 2 + - e - =Fe 3 + B .可用高纯铁电极作阴极 C .电解液中的 SO 4 2- 由右向左通过 阴离子交换膜 D .电解法制备高纯铁总反应: 3Fe 2 + Fe + 2Fe 3 + 【 答案 】 C 【 解析 】 电解时 Fe 2 + 被氧化为 Fe 3 + , A 项正确;高纯铁可以作为阴极, B 项正确; SO 4 2- 为阴离子,在电解过程中应向阳极移动,即从左侧经阴离子交换膜进入右侧, C 项错误;电解时阳极 Fe 2 + 生成 Fe 3 + ,阴极 Fe 2 + 变为 Fe ,故总反应: 3Fe 2 + Fe + 2Fe 3 + , D 项正确。查看更多