- 2021-04-28 发布 |
- 37.5 KB |
- 16页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
【化学】内蒙古北京八中乌兰察布分校2019-2020学年高一上学期第二次调研考试试题(解析版)
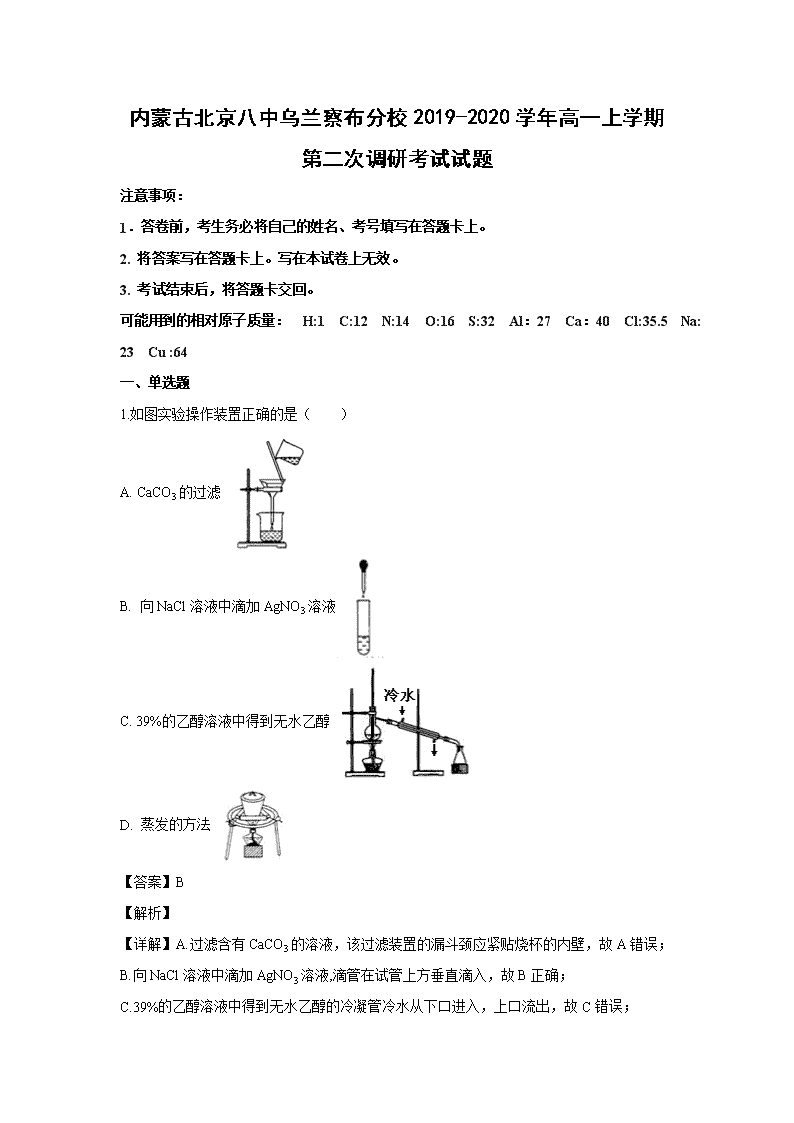
内蒙古北京八中乌兰察布分校2019-2020学年高一上学期第二次调研考试试题 注意事项: 1.答卷前,考生务必将自己的姓名、考号填写在答题卡上。 2. 将答案写在答题卡上。写在本试卷上无效。 3. 考试结束后,将答题卡交回。 可能用到的相对原子质量: H:1 C:12 N:14 O:16 S:32 Al:27 Ca:40 Cl:35.5 Na: 23 Cu :64 一、单选题 1.如图实验操作装置正确的是( ) A. CaCO3的过滤 B. 向NaCl溶液中滴加AgNO3溶液 C. 39%的乙醇溶液中得到无水乙醇 D. 蒸发的方法 【答案】B 【解析】 【详解】A.过滤含有CaCO3的溶液,该过滤装置的漏斗颈应紧贴烧杯的内壁,故A错误; B.向NaCl溶液中滴加AgNO3溶液,滴管在试管上方垂直滴入,故B正确; C.39%的乙醇溶液中得到无水乙醇的冷凝管冷水从下口进入,上口流出,故C错误; D.蒸发时用的是蒸发皿,故D错误; 所以本题答案:B。 2.下列溶液中,跟100mL0.5mol/LNaCl溶液所含的Cl-物质的量浓度相同的是( ) A. 100mL0.5mol/LMgCl2溶液 B. 25ml0.5mol/LHCl溶液 C. 50ml1mol/LNaCl溶液 D. 50mL0.5mol/LCaCl2溶液 【答案】B 【解析】 【分析】0.5mol/LNaCl溶液所含Cl-的物质的量浓度为0.5mol/L,结合化学式计算选项中氯离子的浓度,进行判断.注意离子浓度与溶液的体积无关。 【详解】0.5mol/LNaCl溶液所含Cl-的物质的量浓度为0.5mol/L. A.0.5mol/LMgCl2溶液中氯离子的浓度为0.5mol/L×2=1mol/L,选项A错误; B.0.5mol/LHCl溶液中所含Cl-的物质的量浓度为0.5mol/L,选项B正确; C.1mol/LNaCl溶液中氯离子的浓度为1mol/L,选项C错误; D.0.5mol/LCaCl2溶液中氯离子的浓度为0.5mol/L×2=1mol/L,选项D错误。 答案选B。 3.对下列各组物质:①NaNO3和NaCl;②CaCl2和CaCO3;③MnO2和KCl;④BaSO4和AgCl。可按照溶解、过滤、蒸发的实验操作顺序,将它们相互分离的是( ) A. 只有① B. ③④ C. ②③ D. ②④ 【答案】C 【解析】 【分析】按照溶解、过滤、蒸发的步骤进行分离的物质,需要满足:一种物质不溶于水,另一种物质能溶于水。 【详解】①NaNO3和NaCl均能溶于水,不能按溶解、过滤、蒸发的操作顺序分离,故①错误; ②CaCl2能溶于水,而CaCO3不溶于水,能按溶解、过滤、蒸发的操作顺序分离,故②正确; ③KCl能溶于水,而MnO2不溶于水,能按溶解、过滤、蒸发的操作顺序分离,故③正确; ④BaSO4和AgCl均不能溶于水,不能按溶解、过滤、蒸发的操作顺序分离,故④错误; 答案选C。 4.已知气体的密度与它的摩尔质量成正比。一只气球若放在空气(空气的平均摩尔质量是29 g·mol-1)中可静止不动,那么在相同条件下该气球在下列气体中会下沉的是( ) A. O2 B. Cl2 C. CO2 D. CH4 【答案】D 【解析】 【分析】一只气球若放在空气中可静止不动,在相同条件下该气球放在密度比空气小的气体中就会下沉,放在密度比空气大的气体中就会上升。 【详解】A.结合上述分析可知:氧气的摩尔质量为32g/mol,比空气的大,则密度比空气大,该气球放在氧气中上升,故A错误; B. 结合上述分析可知:氯气的摩尔质量为71g/mol ,大于空气,则密度比空气大,该气球放在氧气中上升,故B错误; C. 结合上述分析可知:二氧化碳的摩尔质量为44g/mol ,大于空气,则密度比空气大,该气球放在氧气中上升,故C错误; D. 结合上述分析可知:甲烷的摩尔质量为16g/mol ,小于空气,则密度比空气小,该气球放在氧气中下沉,故D正确。 所以D选项是正确的。 5.下列叙述正确的是( ) A. 浓盐酸和浓硝酸均应保存在棕色试剂瓶中 B. 稀释浓硫酸时一定将水沿器壁缓缓注入浓硫酸中并不断搅拌 C. 滴瓶中的滴管用后不用清洗,直接放到滴瓶中 D. 温度计摔坏导致水银散落到地面上,应立即用水冲洗水银 【答案】C 【解析】 【详解】A. 浓硝酸光照容易分解应保存在棕色试剂瓶中,浓盐酸只需保存在无色试剂瓶中,故A错误; B. 稀释浓硫酸时一定将浓硫酸沿器壁缓缓注入水中并不断搅拌,故B错误; C. 滴瓶中的滴管是配套的,所以用后不用清洗,直接放到滴瓶中,故C正确; D. 温度计摔坏导致水银散落到地面上,应撒上硫粉,防止水银挥发,故D错误; 故选C。 6.下列实验设计及其对应的离子方程式均正确的是( ) A. 把铁片插入CuSO4溶液中,验证古代湿法冶铜:2Fe+3Cu2+=2Fe3++3Cu B. 某气体使澄清石灰水先变浑浊后变澄清,验证该气体是CO2:Ca2++2OH- +CO2=CaCO3↓+H2O、CaCO3+CO2+H2O=Ca2++2HCO3- C. 在小苏打溶液中加入醋酸,验证醋酸比碳酸的酸性强:HCO3-+H+=CO2↑+H2O D. 若要求用两种单质和一种溶液来测定Zn、Cu、Ag三种金属的活动性顺序,可用Zn、Cu和AgNO3溶液:Zn+2Ag+=Zn2++2Ag 【答案】B 【解析】 【详解】A.Fe与硫酸铜发生置换反应,生成硫酸亚铁和Cu,离子反应为Fe+Cu2+═Fe2++Cu,A项错误; B.先变浑浊后变澄清,可知先生成碳酸钙沉淀, 后生成碳酸氢钙,离子反应为CO2:Ca2++2OH-+CO2=CaCO3↓+H2O、CaCO3+CO2+H2O=Ca2++2HCO3-,B项正确; C.小苏打溶液中加入醋酸,发生强酸制取弱酸的反应,醋酸是弱酸,不能拆成离子形式,离子反应为HCO3-+H3COOH═CH3COO-+CO2↑+H2O,C项错误; D.Zn、Cu均与AgNO3发生置换反应生成Ag,则不能比较Zn、Cu的金属性,D项错误; 答案选B。 7. 下列说法正确的是( ) A. 1 L水中溶解1 mol NaCl所形成溶液的物质的量浓度为1 mol·L-1 B. 标准状况下,22.4 L HCl溶于1 L水中形成的溶液体积为1 L C. 标准状况下,将33.6 L HCl溶于水形成1 L溶液,其物质的量浓度是1.5 mol·L-1 D. 1 mol CaCl2溶于水形成1 L溶液,所得溶液中c(Cl-)等于1 mol·L-1 【答案】C 【解析】 【详解】A.1 L水中溶解1 mol NaCl所形成溶液的体积不一定是1L,所以其物质的量浓度也不一定是1mol/L,A错误; B.物质溶于水中形成溶液一般体积不等于溶剂的体积,要发生变化,所以标准状况下,22.4 L HCl溶于1 L水中形成的溶液体积不一定为1 L,B错误; C.标准状况下,33.6 L HCl的物质的量为1.5mol,溶于水形成1L溶液,得到的溶液的物质的量浓度为1.5 mol·L-1,C正确; D.1 mol CaCl2溶于水形成1 L溶液,所得溶液的物质的量浓度为1mol/L,所以溶液中c(Cl-)等于2mol·L-1,D错误,答案选C。 8.为除去某物质中所含的杂质,所选用的除杂试剂或操作方法正确的是( ) 序号 物质 杂质 除杂试剂或操作方法 ① NaCl Na2CO3 溶解,加入过量盐酸,蒸发 ② FeSO4溶液 CuSO4 加入过量铁粉并过滤 ③ H2 CO2 依次通过盛有NaOH溶液和浓硫酸的洗气瓶 ④ NaNO3 CaCO3 加稀盐酸、过滤、蒸发结晶 A. ①②③ B. ②③④ C. ①②④ D. ①②③④ 【答案】A 【解析】 【详解】①氯化钠中含有碳酸钠杂质,加入过量盐酸,氯化钠与盐酸不反应,碳酸钠与盐酸反应生成氯化钠和二氧化碳,通过加热蒸发,利用盐酸的挥发性,将过量盐酸除尽,最后得到氯化钠,故①正确; ②硫酸亚铁溶液中混有硫酸铜杂质,加入过量铁粉,硫酸铜与铁粉反应生成硫酸亚铁和铜单质,再进行过滤将固体杂质除去,故②正确; ③CO2与NaOH反应,而氢气不能,则依次通过盛有NaOH溶液和浓硫酸的洗气瓶可分离,故④正确; ④CaCO3不溶于水,NaNO3溶于水,则利用水溶性、过滤可分离,与盐酸反应引入新杂质氯化钙无法除去,故④错误; 答案选A。 9.进行化学实验,必须注意安全,下列关于实验安全问题说法正确的是( ) A. H2还原CuO实验中,应该先加热CuO,再通H2 B. 制备有毒气体时可以在通风橱中进行 C. 蒸馏时需要加沸石,是为了防止倒吸 D. 打碎的水银温度计应该扔至垃圾桶,并将洒落的水银扫至废液缸 【答案】B 【解析】 【分析】A.H2与空气混合气体易发生爆炸; B. 制备有毒气体时可以在通风橱中进行,防止中毒; C. 蒸馏时需要加沸石,是为了防止暴沸; D. 打碎的水银温度计应该扔至垃圾桶,并将洒落的水银上洒上硫磺; 【详解】A.H2还原CuO时要先通H2,排净系统内的空气,若先加热再通H2会引起爆炸,故A错误; B. 制备有毒气体时可以在通风橱中进行,防止中毒,故B正确; C. 蒸馏时需要加沸石,是为了防止暴沸,防止液体剧烈沸腾,冲出容器,故C错误; D. 水银蒸汽有毒,打碎的水银温度计应该扔至垃圾桶,并将洒落的水银上洒上硫磺,故D错误; 故选B。 10.实验室用NaOH固体配制1.00 mol·L-1的NaOH溶液100 mL,造成所配溶液浓度偏低的原因是( ) A. 暴露在空气中称量NaOH的时间太长 B. 向容量瓶转移液体时,容量瓶内含有蒸馏水 C. 定容时俯视刻度线 D. 溶解后未冷却至室温就转移至容量瓶 【答案】A 【解析】 【详解】A. NaOH潮解吸水,浓度偏低,故A正确;B.容量瓶中含有蒸馏水对结果没有影响,故B错误;C.定容时俯视刻度线导致溶液的体积偏小,溶液的浓度偏大,故C错误;D.未冷却至室温就转移会导致溶液的体积偏小,溶液的浓度偏大,故D错误;答案选A。 11.用NA表示阿伏加德罗常数,下列叙述正确的是( ) A. 标准状况下,22.4LH2O含有的分子数为1 NA B. 常温常压下,1.06g Na2CO3含有Na+离子数为0.02 NA C. 通常状况下, NA 个CO2分子占有的体积为22.4L D. 1 L 1 mol/L的 NaOH溶液中含有的氧原子数为NA 【答案】B 【解析】 【详解】A项、标准状况水不是气体,22.4LH2O物质的量不是1mol,故A错误; B项、1.06g Na2CO3的物质的量为0.01mol,含有的Na+离子数为0.02 NA,故B正确; C项、NA 个CO2分子的物质的量为1mol,标准状况下,1molCO2 分子占有的体积为22.4L,故C错误; D项、氢氧化钠和水中均含有氧原子,无法计算1 L 1 mol/L的 NaOH溶液中水的物质的量,不能计算溶液中含有的氧原子数,故D错误; 故选B。 12.将5 mol·L-1的Mg(NO3)2溶液a mL稀释至b mL,稀释后溶液中NO3—的物质的量浓度为( ) A. mol·L-1 B. mol·L-1 C. mol·L-1 D. mol·L-1 【答案】B 【解析】 【详解】5mol/L的Mg(NO3)2溶液中硝酸根离子的物质的量浓度为10 mol/L,由释前后溶质的物质的量不变可知,当a mL稀释至b mL时,硝酸根的物质的量不变,则稀释后溶液中硝酸根的物质的量浓度为=mol·L-1,故选B。 13.分类是科学研究的重要方法,下列物质分类正确的是( ) A. 非电解质:乙醇、氯气 B. 酸性氧化物:NO、 C. 胶体:豆浆、葡萄糖溶液 D. 离子化合物:NaH、 【答案】D 【解析】 【分析】A、在水溶液里和熔融状态下都不导电的化合物是非电解质; B、酸性氧化物是与碱反应生成盐和水的氧化物; C、分散质粒子直径在1nm—100nm之间的分散系; D、活泼金属失去电子形成带正电荷的阳离子(如Na+、K+、Ca2+、Mg2+等),活泼非金属得到电子形成带负电荷的阴离子(如F-、Cl-、O2-、S2-等),阳离子和阴离子靠静电作用形成了离子化合物。 【详解】A、氯气是单质不是电解质也不是非电解质,故A错误; B、NO不是酸性氧化物,是不成盐氧化物,故B错误; C、葡萄糖是小分子,其溶液不是胶体,故C错误; D、NaH是离子化合物,其中阳离子为,阴离子为,铵盐是离子化合物,故D正确。 故选D。 14.下列叙述正确的是( ) ①硝酸钾溶液能导电,所以硝酸钾溶液是电解质 ②固态氯化钾不导电,但氯化钾是电解质 ③氯化氢溶液能导电,所以氯化氢是电解质 ④SO2溶于水能导电,所以SO2电解质 ⑤铁导电,所以铁是电解质 ⑥H2不导电,所以H2是非电解质. A. ①④ B. ②③ C. ①②③④ D. ④⑤⑥ 【答案】B 【解析】 【详解】①硝酸钾溶液是混合物,不是化合物,不属于电解质,①错误; ②固态氯化钾不导电,但氯化钾在水溶液或熔融状态下能电离产生自由移动的K+、Cl-,因而能导电,所以KCl属于电解质,②正确; ③氯化氢是在水溶液中能导电的化合物,属于电解质,③正确; ④SO2溶于水生成亚硫酸,亚硫酸电离出阴、阳离子而使其溶液导电,能电离出阴、阳离子的物质是亚硫酸,而不是SO2,所以SO2是非电解质,④错误; ⑤铁是单质,既不是电解质,也不是非电解质,⑤错误; ⑥H2是单质,既不是电解质,也不是非电解质,⑥错误; 所以正确的是②③, 故合理选项是B。 15.下列说法正确的是( ) A. 溶液呈电中性,胶体带电荷。 B. 配制0.1 mol·L-1CuSO4溶液100 mL,称取1.6g硫酸铜晶体 C. 向饱和Ca(OH)2溶液中加入少量无水CaO固体,恢复原温度,溶液中Ca(OH)2的物质的量浓度不变 D. 制备Fe(OH)3胶体,可向沸水中滴加FeCl3饱和溶液并长时间煮沸 【答案】C 【解析】 【详解】A.胶体不带电,胶粒带电荷,故A错误; B. 配制0.1 mol·L-1CuSO4溶液100 mL,称取硫酸铜晶体的质量2.5g,故B错误; C. 向饱和Ca(OH)2溶液中加入少量无水CaO固体,恢复原温度,还是饱和溶液,所以溶液中Ca(OH)2的物质的量浓度不变,故C正确; D. 制备氢氧化铁胶体时,当液体变为红褐色时应立即停止加热,如长时间煮沸会导致胶体聚沉,故D错误。答案选C。 16.在含有的无色溶液中,能大量共存的离子组是( ) A. 、 、 、 B. 、、、 C. 、、、 D. 、、 、 【答案】C 【解析】 【分析】含有的无色溶液,溶液显碱性,根据离子之间不能结合生成沉淀、气体、水等,则离子大量共存,并结合离子的颜色来解答。 【详解】A.MnO4-的水溶液显紫色,与题干的无色溶液不符合,A错误; B.、结合生成沉淀,不能大量共存,B错误; C.离子之间不反应,可大量共存,C正确; D.、结合生成沉淀,不能大量共存,D错误; 故合理选项是C。 17.关于胶体的性质与应用,相关说法错误的是( ) A. 静电除尘器除去空气中的飘尘是利用胶体粒子的带电性而加以除去 B. 医学上的血液透析原理同胶体的渗析类似,透析膜同半透膜类似 C. 从颜色上无法区别FeCl3溶液和Fe(OH)3胶体 D. 由于胶粒之间的排斥作用,胶粒不易聚集成大的颗粒,所以胶体比较稳定 【答案】C 【解析】 【详解】A.中和胶体粒子的电性能够使胶体发生电泳,如用净电除尘器吸附带电的飘尘,而使之电泳除去,故A正确; B.血液是一种胶体,利用渗析的原理可以除去血液中的毒性小分子物质,而血液中的必要成分不能通过透析膜,故B正确; C.Fe(OH)3胶体呈红褐色,FeCl3溶液呈棕黄色,因此可以从颜色上区分,故C错误; D.由于同种电荷的静电排斥作用,胶体相对比较稳定,故D正确; 故答案为C。 18.下列各组物质在溶液中的反应,可用同一离子方程式表示的是 ( ) A. Cu(OH)2与盐酸,Cu(OH)2与醋酸 B. BaCl2溶液与Na2SO4溶液,Ba(OH)2溶液与H2SO4溶液 C. NaHCO3溶液与盐酸,Na2CO3溶液与盐酸 D. 石灰石与硝酸反应,石灰石与盐酸 【答案】D 【解析】 【分析】A.盐酸为强酸,醋酸为弱酸,醋酸在离子反应方程式中保留化学式; B.Ba(OH)2溶液与H2SO4溶液反应生成水和硫酸钡; C.HCO3-在离子反应方程式中不拆开; D.碳酸钙保留化学式,硝酸、盐酸均为一元强酸. 【详解】A.盐酸为强酸,醋酸为弱酸,醋酸在离子反应方程式中保留化学式,离子反应不能用同一离子方程式表示,故A不选; B.Ba(OH)2溶液与H2SO4溶液反应生成水和硫酸钡,水应保留化学式,则离子反应不能用同一离子方程式表示,故B不选; C.HCO3-在离子反应方程式中不拆开,与碳酸根离子不同,则离子反应不能用同一离子方程式表示,故C不选; D.碳酸钙保留化学式,硝酸、盐酸均为一元强酸,离子反应均为CaCO3+2H+=H2O+CO2↑+Ca2+,故D选; 故选:D。 19.只能表示一个化学反应的离子方程式是( ) A. H++OH-= H2O B. 2H++CO32-= H2O+CO2↑ C. Zn(OH)2+2H+= Zn2++2H2O D. Cu2++2OH-+Ba2++SO42-= BaSO4↓+Cu(OH)2↓ 【答案】D 【解析】 【详解】A项、H++OH-=H2O代表强酸和强碱反应生成可溶于水的盐和水的反应,如盐酸和氢氧化钠、盐酸和氢氧化钡、硝酸和氢氧化钾等,故A错误; B项、CO32-+2H+=CO2↑+H2O代表可溶性的碳酸盐和强酸之间的反应,如碳酸钠和盐酸、碳酸钠和硝酸等,故B错误; C项、Zn(OH)2+2H+=Zn2++2H2O代表氢氧化锌和强酸之间的反应,如:氢氧化锌和盐酸、氢氧化锌和硝酸、硫酸等,故C错误; D项、Ba2++2OH-+Cu2++SO42-=BaSO4↓+Cu(OH)2↓只能表示氢氧化钡和硫酸铜之间的反应,故D正确; 故选D。 20.下表所列各组物质,物质之间按箭头方向不能通过一步反应实现如图所示转化的是( ) A. A B. B C. C D. D 【答案】C 【解析】 【详解】A. 该组物质均可以一步反应:甲→乙:,乙→丙:CO2+2NaOH=Na2CO3+H2O,甲→丙:,A错误; B. 该组物质均可以一步反应:甲→乙:,乙→丙:,甲→丙:,B错误; C. 该组物质中,仅CaCO3→Ca(OH)2不能一步反应得到,甲→乙: ,乙→丙:CaO+H2O=Ca(OH)2,C正确; D. 该组物质均可以一步反应:甲→乙:H2SO4+2NaOH=Na2SO4+H2O,乙→丙:,甲→丙:H2SO4+Zn=ZnSO4+H2↑,D错误; 故合理选项为C。 二、填空题 21.有下列物质: ①硫酸 ②盐酸 ③氯气 ④硫酸钡 ⑤酒精 ⑥铜 ⑦醋酸 ⑧氯化氢 ⑨蔗糖 ⑩氨气 ⑪CO2 ⑫NaHCO3 ⑬A l(OH)3 ⑭NaOH (1)属于非电解质的为____(填序号,下同),属于弱电解质的为___,能导电的是___。 (2)写出下列反应的离子方程式 A.碳酸钙与盐酸反应:______________________________ B.稀硫酸与氢氧化铜反应:_________________________________ C.氧化铁与盐酸反应:____________________________________ 【答案】(1). ⑤⑨⑩⑪ (2). ⑦⑬ (3). ②⑥ (4). CaCO3 +2H+=Ca2++CO2↑+H2O (5). 2H++Cu(OH)2=Cu2++2H2O (6). Fe2O3+6H+=2Fe3++3H2O 【解析】 【分析】能导电的物质是要含有自由移动的电子或离子,例如金属,电解质的溶液,熔融的电解质,电解质是在水溶液或熔融状态下能导电的化合物,非电解质是在水溶液和熔融状态下都不能导电的化合物,电解质或非电解质都是化合物,电解质不一定导电,能导电的不一定是电解质。 【详解】电解质和非电解质都是化合物,酸碱盐和活泼金属氧化物,水都是电解质,电解质有强弱之分,能在水溶液或熔融状态下能全部电离的化合物是强电解质,例如,强酸,强碱,绝大多数的盐,活泼金属氧化物,弱酸,弱碱,水都属于弱电解质。有机物,非金属氧化物,部分非金属氢化物属于非电解质。 ①硫酸属于强酸,在水溶液中是完全电离的,是强电解质,硫酸属于共价化合物,没有自由移动的离子,不能导电; ②盐酸是混合物,既不是电解质也不是非电解质,溶液中含有自由移动的离子,可以导电; ③氯气是单质,既不是电解质,也不是非电解质,也不能导电, ④硫酸钡属于盐,在水溶液或熔融状态下是完全电离的,是强电解质; ⑤酒精属于有机物,在溶液中或熔融状态下都不能导电,是非电解质; ⑥铜是单质,既不是电解质,也不是非电解质,但是可以导电; ⑦醋酸属于弱酸,是弱电解质,醋酸不能导电; ⑧氯化氢溶于水形成强酸,属于电解质,强电解质,自身不能导电; ⑨蔗糖属于有机物,在溶液中或熔融状态下都不能导电,属于非电解质; ⑩氨气属于非金属氢化物,自身不能导电,溶于水形成氨水可以导电,不是它自身电离,属于非电解质; ⑪ CO2 属于非金属氧化物,自身不能导电,溶于水形成碳酸可以导电,不是它自身电离,属于非电解质; ⑫ NaHCO3 属于盐,在水溶液或熔融状态下能全部电离,属于强电解质; ⑬ A l(OH)3 属于弱碱,自身不能电离,在水溶液或熔融状态下部分电离,属于弱电解质; ⑭ NaOH属于强碱,自身不能导电,在水溶液或熔融状态下能全部电离,属于强电解质; (1)属于非电解质的为⑤酒精⑨蔗糖⑩氨气⑪CO2;属于弱电解质的为⑦醋酸⑬A l(OH)3 ;能导电的②盐酸,⑥铜 ,故答案:⑤⑨⑩⑪;⑦⑬ ;②⑥ ; (2)A.碳酸钙与盐酸反应属于盐和酸发生的复分解反应,生成氯化钙,水和二氧化碳,则化学方程式为CaCO3 +2HCl=CaCl2+CO2↑+H2O,碳酸钙是固体,不能拆成离子形式,盐酸是强酸,可以拆,生成的水和二氧化碳不能拆,故离子方程式为CaCO3 +2H+=Ca2++CO2↑+H2O,故答案为:CaCO3 +2H+=Ca2++CO2↑+H2O ; B.稀硫酸与氢氧化铜反应生成硫酸铜和水,氢氧化铜是沉淀,不能拆成离子形式,化学方程式为H2SO4+Cu(OH)2=CuSO4+2H2O 离子方程式为2H++Cu(OH)2=Cu2++2H2O, 故答案为:2H++Cu(OH)2=Cu2++2H2O; C.氧化铁与盐酸反应生成氯化铁和水,化学方程式Fe2O3+6HCl=2FeCl3+3H2O,离子方程式为Fe2O3+6H+=2Fe3++3H2O,故答案为:Fe2O3+6H+=2Fe3++3H2O; 22.在标准状况下,有物质①44.8LH2,②24gCH4,③1molH2O,④3.01×1023个O2,含分子数最多的是______(填序号,下同),含电子数最多的是______,质量最大的是______,体积最小的是______;密度由小到大的顺序为______。 【答案】(1). ① (2). ② (3). ② (4). ③ (5). ①<②<④<③ 【解析】 【分析】根据n= = = ,ρ= 进行计算。 【详解】①在标准状况下, 44.8LH2的物质的量为n==2mol,所含分子数为2NA,一个氢气分子有2个电子,则2mol氢气含有电子数为2 mol×2×NA =4NA,H2体积为44.8L,2mol氢气的质量=nM=2×2g/mol=4g,密度ρ=0.089g/L; ② 24gCH4的物质的量为n==1.5mol,分子数为1.5mol ×NA =1.5NA,一个CH4分子含有10个电子,则24g CH4中含电子数为1.5NA×10=15NA, V=nVm=1.5mol×22.4L/mol=33.6L,ρ=0.714g/L; ③1molH2O的物质的量为1mol,所含电子数为NA,一个水分子中含有10个电子,1molH2O中电子数为1 mol×10 ×NA =10NA;质量m=nM=1mol×18g/mol =18g;标况下水是固液混合物,其余都是气体,固体的体积最小,密度是103g/L; ④3.01×1023个O2的物质的量为=0.5mol,则氧气分子数为0.5NA,一个氧气分子中含有16个电子,则0.5NA个氧气分子中电子数为0.5×16×NA=8NA;质量为m=nM=0.5 mol×32g/mol=16g;体积为V=nVm=0.5mol×22.4L/mol=11.2L,ρ=1.429g/L; 故含分子数最多的是①;含电子数最多的是②;质量最大的是②;体积最小的是③;密度由小到大的顺序为 ①<②<④<③;故答案为:①;②;②;③; ①<②<④<③。 三、实验题 23.用98%的浓硫酸()配制100mL浓度为1 mol⋅L−1的稀硫酸,其操作步骤可分解为以下几步: a.用量筒量取___________mL的浓硫酸,缓缓注入装有约50mL蒸馏水的烧杯里,并用玻璃棒搅拌. b.用约30mL蒸馏水,分成三次洗涤烧杯和玻璃棒,将每次洗涤液都倒入M里. c.将稀释后的硫酸小心地用玻璃棒引流入M. d.检查M是否发生滴漏. e.将蒸馏水直接加入M,至液面接近刻度线2cm至3cm处. f.盖紧瓶塞,反复倾倒振荡,摇匀溶液. g.用________________向M里逐滴滴入蒸馏水,至液面最低点恰好与环形刻度线相切.据此填写: (1)正确的操作顺序是______. (2)进行A步操作时,应量取______mL浓硫酸,选用量筒的规格是(填序号) _________ . a. 10mL b. 50mL c. 1000mL d. 1000mL (3)配置上述溶液时,多次提到的实验仪器M是______________。步骤G中横线处是_________。 (4)进行A步骤操作时,必须_____后,才能进行后面的操作. (5)实验操作中,下列操作会对所配溶液的浓度有何影响(填“偏高”“偏低”或“无影响”) a.洗涤烧杯和玻璃棒的溶液未转入M中__________________ b.定容时,眼睛俯视溶液____________________ c.容量瓶中原残留少量蒸馏水__________________ d.定容后M中液面低于刻度线,又加水定容到刻度线.____________________ e量取浓硫酸时仰视量筒读数____________________ 【答案】(1). DACBEGF (2). 5.4 (3). A (4). 100mL容量瓶 (5). 胶头滴管 (6). 冷却至室温 (7). 偏低 (8). 偏高 (9). 无影响 (10). 偏低 (11). 偏高 【解析】 【分析】(1)根据用浓溶液配置稀溶液的一般操作步骤分析; (2)量筒的选择规格遵循“大而近”的原则; (3)量筒仰视读数,量取的液体体积偏大,溶质的质量偏多; (4)转移溶液时应将溶液的温度恢复至室温; (5)根据c=nV计算不当操作对n或V的影响,如果n偏大或V偏小,则所配制溶液浓度偏高; 【详解】(1)配制顺序:计算→量取→稀释、冷却→移液→定容→摇匀→装瓶→贴签;故答案为:DACBEGF; (2)量取5.4ml溶液应选择10ml的量筒;故选:A; (3)因量筒仰视读数,量取的液体体积偏大,溶质的质量偏多,浓度偏大;故答案:偏高; (4)因转移溶液时应将溶液的温度恢复至室温;故答案为:冷却到室温; (5)a.洗涤烧杯和玻璃棒的溶液未转入容量瓶,溶质的物质的量偏小,溶液的浓度偏低; b. 定容时,眼睛俯视溶液将凹液面最低点与容量瓶刻度线相切,溶液的体积偏小,溶液的浓度偏高; c. 容量瓶中原残留少量蒸馏水,对溶质的物质的量和溶液的体积都不会产生影响,溶液的浓度无影响; d. 定容后容量瓶液面低于刻度线,又加水定容到刻度线,导致溶液的体积偏大,溶液的浓度偏低; e.量取浓硫酸时仰视量筒读数,液面在刻度线以上,导致溶液的浓度偏高。查看更多