- 2021-04-28 发布 |
- 37.5 KB |
- 14页
申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2019届二轮复习电化学作业(全国通用)(4)
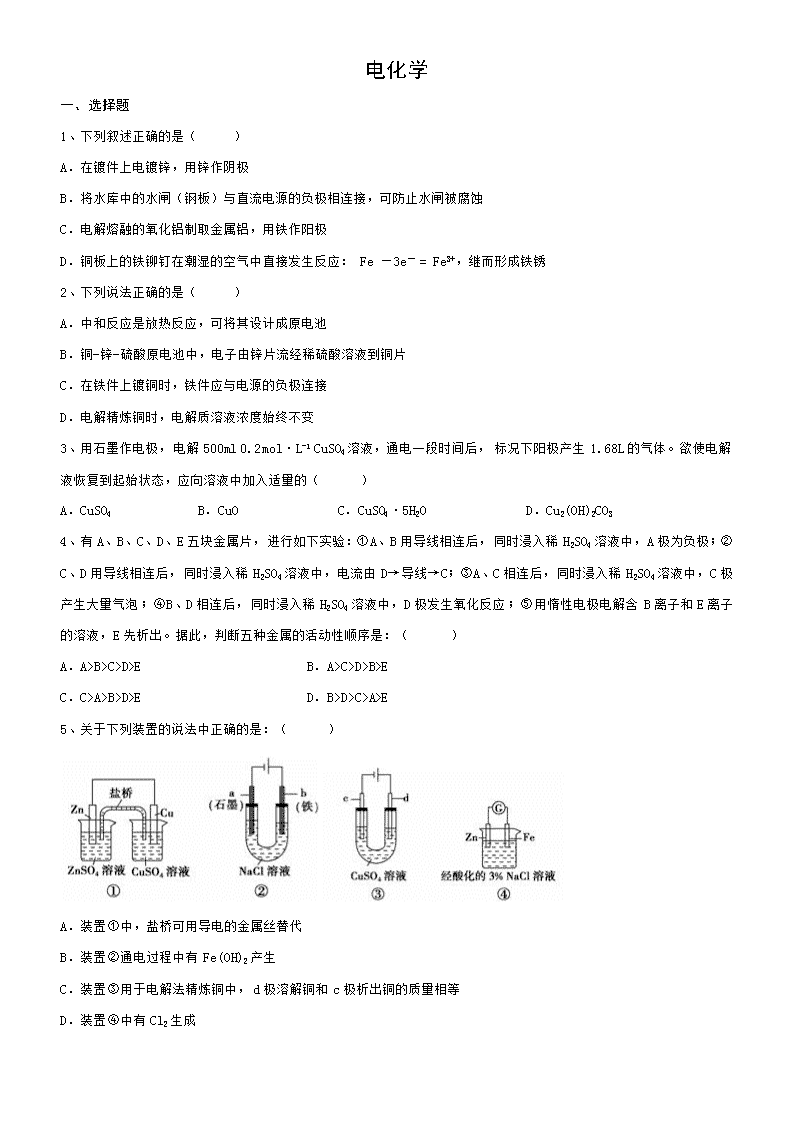
电化学 一、选择题 1、下列叙述正确的是( ) A.在镀件上电镀锌,用锌作阴极 B.将水库中的水闸(钢板)与直流电源的负极相连接,可防止水闸被腐蚀 C.电解熔融的氧化铝制取金属铝,用铁作阳极 D.铜板上的铁铆钉在潮湿的空气中直接发生反应:Fe —3e- = Fe3+,继而形成铁锈 2、下列说法正确的是( ) A.中和反应是放热反应,可将其设计成原电池 B.铜-锌-硫酸原电池中,电子由锌片流经稀硫酸溶液到铜片 C.在铁件上镀铜时,铁件应与电源的负极连接 D.电解精炼铜时,电解质溶液浓度始终不变 3、用石墨作电极,电解500ml 0.2 mol·L-1 CuSO4溶液,通电一段时间后,标况下阳极产生1.68L的气体。欲使电解液恢复到起始状态,应向溶液中加入适量的( ) A.CuSO4 B.CuO C.CuSO4·5H2O D.Cu2(OH)2CO3 4、有A、B、C、D、E五块金属片,进行如下实验:①A、B用导线相连后,同时浸入稀H2SO4溶液中,A极为负极;②C、D用导线相连后,同时浸入稀H2SO4溶液中,电流由D→导线→C;③A、C相连后,同时浸入稀H2SO4溶液中,C极产生大量气泡;④B、D相连后,同时浸入稀H2SO4溶液中,D极发生氧化反应;⑤用惰性电极电解含B离子和E离子的溶液,E先析出。据此,判断五种金属的活动性顺序是:( ) A.A>B>C>D>E B.A>C>D>B>E C.C>A>B>D>E D.B>D>C>A>E 5、关于下列装置的说法中正确的是:( ) A.装置①中,盐桥可用导电的金属丝替代 B.装置②通电过程中有Fe(OH)2产生 C.装置③用于电解法精炼铜中,d极溶解铜和c极析出铜的质量相等 D.装置④中有Cl2生成 6、固体氧化物燃料电池是由美国西屋(Westinghouse)公司研制开发的。它以固体氧化锆 氧化钇为电解质,这种固体电解质在高温下允许氧离子(O2-)在其间通过。该电池的工作原理如图所示,其中多孔电极a、b均不参与电极反应。下列判断正确的是:( ) A.有O2放电的a极为电池的负极 B.有H2放电的b极为电池的正极 C.a极对应的电极反应式为O2+2H2O+4e-===4OH- D.该电池的总反应方程式为2H2+O2===2H2O 7、某污水处理厂用微生物电池将镀铬废水中的Cr2O72-催化还原,其工作原理如下图所示。下列说法错误的是( ) A.电池工作过程中电子由a极流向b极 B.b极反应式:Cr2O72-+6e-+14H+=2Cr3++7H2O C.电池工作过程中a极区附近溶液的pH增大 D.每处理1mol Cr2O72-,可生成33.6L(标况)CO2 8、某新型水系钠离子电池工作原理如图所示。TiO2光电极能使电池在太阳光照下充电,充电时Na2S4还原为Na2S。下列说法正确的是( ) A.M是阴离子交换膜 B.充电时,生成78g的Na2S,消耗1.5mol I- C.放电时,b极区总离子浓度减小 D.充电时,阳极的电极反应式为3I- - 2e- = I3- 9、深埋在潮湿土壤中的铁管道,在硫酸盐还原菌作用下,能被硫酸根腐蚀,其电化学腐蚀原理如图,下列有关说法错误的是( ) A.正极反应为:SO42- + 5H2O + 8e- = HS- + 9OH- B.这种情况下,Fe腐蚀的最终产物为Fe2O3·xH2O C.将管道与电源负极相连,称为阴极电保护法 D.管道上刷富锌油漆可以延缓管道的腐蚀 10、某同学做了如下实验,下列说法中正确的是( ) A.“电流计指针未发生偏转”,说明铁片I、II一定未被腐蚀 B.铁片I、Ⅲ的腐蚀速率相等 C.铁片Ⅲ、IV装置电流计指针发生偏转的主要原因是两烧杯中溶液浓度不同 D.若加热铁片I所在烧杯,电流表指针仍未发生偏转 11、如图所示的电化学装置,电极I为Al,其他电极均为Cu,则下列说法正确的是( ) A.电子方向:电极IV→电流计A→电极I B.电极I的电极反应:Al - 3e- = Al3+ C.电极Ⅱ发生氧化反应 D.右池中的Cu2+向电极Ⅲ移动 12、关于下图装置的叙述错误的是( ) A.该装置为原电池 B.Ag电极质量增加,铜逐渐溶解 C.反应一段时间后左池中NO3-浓度变大 D.总反应为:Cu(s)+2Ag+(aq)=Cu2+ (aq)+ 2Ag (s) 13、下图是电解BaCl2和NaI混合溶液的装置,下列叙述正确的是( ) A.Fe电极为阳极,逐渐溶解 B.向U型管左端滴入淀粉溶液,电极周围变蓝 C.U型管右端溶液的碱性减弱 D.若Pt电极上收集到0.1mol气体,则反应中转移0.2mol的电子 14、用惰性电极电解下列三组电解质溶液,在电解前后,溶液的pH变化的顺序依次为降低、不变、升高的是( ) 电解质 选项 ① ② ③ A AgNO3 K2SO4 NaOH B NaCl Na2SO4 CuSO4 C CuSO4 CuCl2 NaNO3 D HCl KCl K2SO4 15、探究电场作用下阴阳离子的迁移。a、b、c、d 均为石墨电极,电极间距4cm。将pH试纸用不同浓度Na2SO4溶液充分润湿,进行如下实验,下列说法不正确的是( ) 实验现象: 时间 试纸I 试纸II lmin a极附近试纸变红,b极附近试纸变蓝 c极附近试纸变红,d极附近试纸变蓝 10min 红色区和蓝色区不断向中间扩展,相遇时红色区约2.7cm,蓝色区约1.3cm 两极颜色范围扩大不明显,试纸大部分仍为黄色 A.Na2SO4溶液中SO42-向a极和c极移动 B.a极附近试纸变红的原因是:2H2O+2e-= H2↑+2OH- C.试纸I的现象说明,此环境中H+的迁移速率比OH-快 D.对比试纸I和试纸II的现象,说明电解质浓度环境影响H+和OH-的迁移 16、某学习小组构想将汽车尾气(NO、NO2)转化为重要的化工原料HNO3,其原理如图所示,其中A、B为多孔导电材料。下列说法正确的是( ) A.该电池工作时,电子的流向为:外电路由B到A,内电路由A到B形成闭合回路 B.电极B附近的HNO3浓度增大 C.A电极的反应为:NO2-e-+H2O=NO3-+2H+ ;NO-3e-+2H2O=NO3-+4H+ D.该电池工作时,每消耗11.2LO2(标准状况下),可以除去含1molNO和1molNO2的混合尾气 17、下列关于化学能转化为电能的四种装置的说法正确的是( ) A.电池Ⅰ工作时,电子由锌经过电解质溶液流向铜 B.电池Ⅱ是一次电池 C.电池Ⅲ工作时,氢气发生还原反应 D.电池Ⅳ工作一段时间后,锌筒变软 18、利用如图所示装置,当X、Y选用不同材料时,可将电解原理广泛应用于工业生产。下列说法中正确的是:( ) A.氯碱工业中,X、Y均为石墨,Y附近能得到氢氧化钠 B.铜的精炼中,X是纯铜,Y是粗铜,Z是CuSO4 C.电镀工业中,X是待镀金属,Y是镀层金属 D.外加电流的阴极保护法中,X是待保护金属 19、铜锌原电池(如图)工作时,下列叙述正确的是:( ) A.正极反应为:Zn-2e-=Zn2+ B.盐桥中的K+移向ZnSO4溶液 C.电池反应为:Zn+Cu2+=Zn2++Cu D.在外电路中,电子从负极流向正极;在电池内部,电子从正极流向负极 二、填空题 20、CuSO4溶液是一种较重要的铜盐试剂,在电镀、印染、颜料、农药等方面有广泛应用。某同学利用CuSO4溶液进行以下实验探究。 (1)图一是根据反应Zn+CuSO4===Cu+ZnSO4设计成的锌铜原电池 ①该原电池的正极为 ,其外电路中的电子是从 极(填“Zn”或“Cu”)流出 ②电解质溶液乙是 (填“ZnSO4”或“CuSO4”)溶液, Zn极的电极反应式是 ③如果盐桥中的成分是K2SO4溶液,则盐桥中向左侧烧杯中移动的离子主要是 (2)图二中,Ⅰ是甲烷燃料电池(电解质溶液为KOH溶液)的结构示意图 ①该同学想在Ⅱ中实现铁上镀铜,电解前CuSO4溶液的浓度为1mol/L,当线路中有0.1 mol电子通过时,则此时电解液CuSO4溶液的浓度为 ,阴极增重 g ②b处通入的是 (填“CH4”或“O2”), a处电极上发生的电极反应式是 21、某学习小组探究金属与不同酸反应的差异,以及影响反应速率的因素。 实验药品:1.0moL/L盐酸、2.0mol/L盐酸、1.0mol/L硫酸、2.0mol/L硫酸,相同大小的铝片和铝粉(金属表面氧化膜都已除去);每次实验各种酸的用量均为25.0mL,金属用量均为6.0g。 (1)帮助该组同学完成以上实验设计表。 实验目的 实验 编号 温度 金属铝 形态 酸及浓度 1.实验①和②探究盐酸浓度对该反应速率的影响 2.实验②和③探究 3.实验②和④探究金属规格(铝片,铝粉)对该反应速率的影响; 4.①和⑤实验探究铝与稀盐酸和稀硫酸反应的差异 ① 铝片 ② 30˚C 铝片 1.0mol/L盐酸 ③ 40˚C 铝片 1.0mol/L盐酸 ④ 铝粉 ⑤ 30˚C 铝片 1.0mol/L硫酸 (2)该小组同学在对比①和⑤实验时发现①的反应速率明显比⑤快,你能对问题原因作出哪些假设或猜想(列出一种即可)? 22、电解原理在化学工业中有广泛应用。(1)氯碱厂电解饱和食盐水制取烧碱,若利用下图装置制备NaOH,两电极区电解液分别为NaOH和NaCl溶液。 ①B极区电解液为 溶液(填化学式),A极要连接电源的_ (填“正”或“负”)极 ②阳极电极反应式为 ,电解过程中Na+向 电极迁移(填“A”或“B”) ③电解总反应的离子方程式是 (2)利用下图装置,可以模拟铁的电化学防护 ①若X为碳电极,为减缓铁的腐蚀,开关K应置于 处(填“A”、“B”或“C”) ②若X为锌电极,开关K置于A处,该电化学防护法称为 23、由甲醇(CH3OH)、氧气和NaOH溶液构成的新型手机电池,可使手机连续使用一个月才充一次电,用该电池作为电源,石墨作电极,分别电解甲、乙两个电解池。 电解池(溶液体积为200ml) 甲 乙 溶质 AgNO3 HCl c /(mol•L﹣1) 0.2 0.1 (1)该甲醇电池负极电极反应式为 。 (2)电解池甲池总反应化学方程式为 ;乙池阴极产生的气体为 。 (3)实验过程中,随着通电时间加长,测定出不同时刻甲、乙两池两电极各产生的气体体积(标况),做出上图曲线Ⅰ、Ⅱ。 ①曲线Ⅱ表示 (填“甲”或“乙”)池的 (填“阴极”或“阳极”)产生气体的体积变化与时间关系;写出0—t 1、t 1—t 3两时段发生反应的电极反应式分别是 、 。 ②在电解0—t 3时段,甲池中共生成 L气体(标准状况下),经过导线的电子数目为 。 24、 钴、镍与铁是同族元素,它们的单质及化合物的性质有很多相似之处。 (1) 为了比较Fe、Co、Cu三种金属的活动性,某实验小组设计如下甲、乙、丙三个实验装置。丙装置中X、Y均为石墨电极。反应一段时间后,可观察到甲装置中Co电极附近产生气泡,丙装置中X极附近溶液变红。 ①甲池Fe电极反应式为 。由现象可知三种金属的活动性由强到弱的顺序是__________(填元素符号) 。 ②写出丙装置中反应的离子方程式 。 ③请在下图框内设计实现“2Ag+Co(NO3)2 = Co+2AgNO ”反应的装置。(在框内标注电源或者电流表、电极材料、电解质溶液。) (2)Na2FeO4具有广泛用途,可通过电解法制取得到,工作原理如图丁所示。通电后,铁电极附近生成紫红色的FeO42−,镍电极有气泡产生。已知: Na2FeO4只在强碱性条件下稳定,易被H2还原。 ①Fe电极反应式为 。电解一段时间后,溶液的PH (填“增大”或“减小”或“不变”)。 ②电解过程中,须将阴极产生的气体及时排出,其原因是_______________。 ③当阴极产生112mL(标准状况)的气体时,通过阴离子交换膜的离子有 mol。 25、如图是铁链图案,图中相连的两物质可归属于同一类别,相交部分A、B、C、D为其相应的分类依据代号。 (1)请将分类代号填入相应的空格内。 两种物质都是电解质的代号是 ;两种物质之间能发生反应的代号是 。 (2)将图中1 mol·L-1 FeCl3溶液,滴入沸水中,可得到Fe(OH)3胶体,证明该混合物是Fe(OH)3胶体的实验操作是 。 (3)下图中化合物A是上述图中的一种物质,是常见的一种调味品,下图是该物质在化工生产中的一系列反应。 ①化合物A为 (填名称);化合物D溶于水可得盐酸,则单质C为 (填化学式)。 ②单质A与Ca(OH)2反应的化学方程式是 ; 单质B与水反应的离子方程式为 。 26、能源、环境与生产生活和社会发展密切相关。 (1)工业上利用CO和H2在催化剂作用下合成甲醇:CO(g)+2H2(g) CH3OH(g) ,已知反应中有关物质的化学键键能数据如下表所示: 化学键 H—H C—O C≡O H—O C—H E/(kJ/mol) 436 343 1076 465 413 则 CO(g)+2H2(g) CH3OH(g) △H=__________kJ•mol-1 (2)以甲醇为燃料的新型电池,其成本大大低于以氢气为燃料的传统燃料电池。如图是目前研究较多的一类固体氧化物燃料电池工作原理示意图。 B极为电池______极,B极的电极反应式为_________________________________。 (3)参考合成反应CO(g)+2H2(g) CH3OH(g)的平衡常数,回答下列问题: 温度/℃ 0 50 100 200 300 400 平衡常数 667 100 13 1.9×10-2 2.4×10-4 1×10-5 ①该反应正反应是 (填“放热”或“吸热”)反应; ②在T℃时,1L密闭容器中,投入0.1molCO和0.2molH2,达到平衡时,CO转化率为50%,则T= ℃。 (4)CH3OH也可由CO2和H2合成。在体积为1L的密闭容器中,充入lmolCO2和3molH2,一定条件下反应:CO2(g)+3H2(g)CH3OH(g)+H2O(g) ΔH= — 49.0kJ/mol,测得CO2和CH3OH(g)浓度随时间变化如图所示。 ①该反应的平衡常数表达式为K=_____________________; 从反应开始到10min,v(H2)=______________________mol/(L·min); ②下列情况能说明该反应一定达到平衡状态的是___________(填字母) A.v(CO2)消耗 = v(CH3OH)生成 B.气体的密度不再随时间改变 C.CO2和CH3OH的浓度之比不再随时间改变 D.气体的平均相对分子质量不再随时间改变 ③为了加快化学反应速率且使体系中气体的物质的量增大,只改变下列某一条件,可采取的措施有___________ (填字母) A.升高温度 B.缩小容器体积 C.再充入CO2气体 D.使用合适的催化剂 ④相同温度下,在另一个容积为1 L的密闭容器中充入2mol CH3OH(g)和2molH2O(g),达到平衡时CO2的浓度____________(填“>”、“ <”或“=”)0.25mol/L。 27、如图所示3套实验装置,分别回答下列问题。 (1)装置1为铁的吸氧腐蚀实验。向插入碳棒的玻璃筒内滴入酚酞溶液,可观察到碳棒附近的溶液变红,该电极反应式为 。 (2)装置2中左池为氯化铁溶液,右池为硫酸铜溶液,一段时间后右池溶液中c(Cu2+) (填“增大”、“减小”或“不变”),若该装置的盐桥中盛装的是NH4NO3的琼脂溶液,则盐桥中的 离子(填“NH4+”或“NO3-”)向氯化铁溶液迁移。 (3)装置3中甲烧杯盛放100mL 0.2mol/L的NaCl溶液,乙烧杯盛放100mL 0.5mol/L的CuSO4溶液。反应一段时间后,观察到乙烧杯的石墨电极上有气泡生成。 ①电源的M端为 极;甲烧杯中铁电极的电极反应式为 。 ②乙烧杯中电解反应的离子方程式为 。 ③停止电解,取出Cu电极,洗涤、干燥、称量,电极增重0.32g,甲烧杯中产生的气体标准状况下体积为 mL;电解后乙烧杯溶液的pH为 (假设电解前后溶液的体积不变)。 ④若要将乙池设计成电解精炼铜的装置,则乙池的石墨应改成 (填“粗铜”或“精铜”)。 参考答案 一、选择题 1、B 2、C 3、D 4、B 5、B 6、D 7、C 8、D 9、B 10、C 11、B 12、C 13、B 14、A 15、B 16、C 17、D 18、A 19、C 二、填空题 20、(1) ①Cu Zn ② CuSO4 Zn-2e-=== Zn2+ ③SO42- (2) ①1mol/L 3.2 ② O2 CH4-8e-+10OH-===CO32-+7H2O 21、(1) 实验目的 实验 编号 温度 金属铝 形态 酸及浓度 1. ① 30˚C 2.0mol/L盐酸 2.实验②和③探究温度对该反应速率的影响 3. 4. ② ③ ④ 30˚C 1.0mol/L盐酸 ⑤ (2)Cl-能够促进金属铝与H+反应,或SO42-对金属铝与H+的反应起阻碍作用等。 22、(1)①NaOH (1分) ②2Cl‾—2e‾=Cl2 B ③ 2Cl-+2H2O Cl2↑+H2↑+2OH- (2)①C ② 牺牲阳极的阴极保护法 23、(1)CH3OH+8OH- -6e- = CO32-+6H2O (2)4AgNO3+2H2O4Ag+O2↑+4HNO3 H2 (3)①乙 阳极2Cl﹣﹣2e﹣=Cl2↑ 4OH- -4e- = O2↑+2H2O ② 1.232 0.1NA 24、(1)①Fe-2e-=Fe2+ Fe>Co>Cu ②2Cl-+2H2O2OH-+H2↑+Cl2↑ ③如图 (2)①Fe - 6e- + 8OH− = FeO42− + 4H2O 减小 ②阴极产生H2,防止Na2FeO4与H2反应使产率降低 ③0.01 25、(1)CD B (2)用一束光照射烧杯中的液体,若能产生丁达尔现象,则证明是胶体。 (3)①氯化钠 H2 ②2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O 2Na+2H2O=2Na++2OH-+H2↑ 26、(1)-99 (2)负, CH3OH + 3 O2—-6e—= CO2 + 2H2O (3)①放热; ②50 (4)①;0.225 ②CD ③AC ④> 27、(1)O2+4e-+2H2O═4OH- (2)增大, NH4+ (3)①正, Fe-2e-═Fe2+ ② 2Cu2++2H2O2Cu+O2↑+4H+ ③ 112, 1 ④粗铜查看更多