- 2021-04-28 发布 |
- 37.5 KB |
- 8页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2017-2018学年内蒙古赤峰二中高一上学期期末考试化学卷
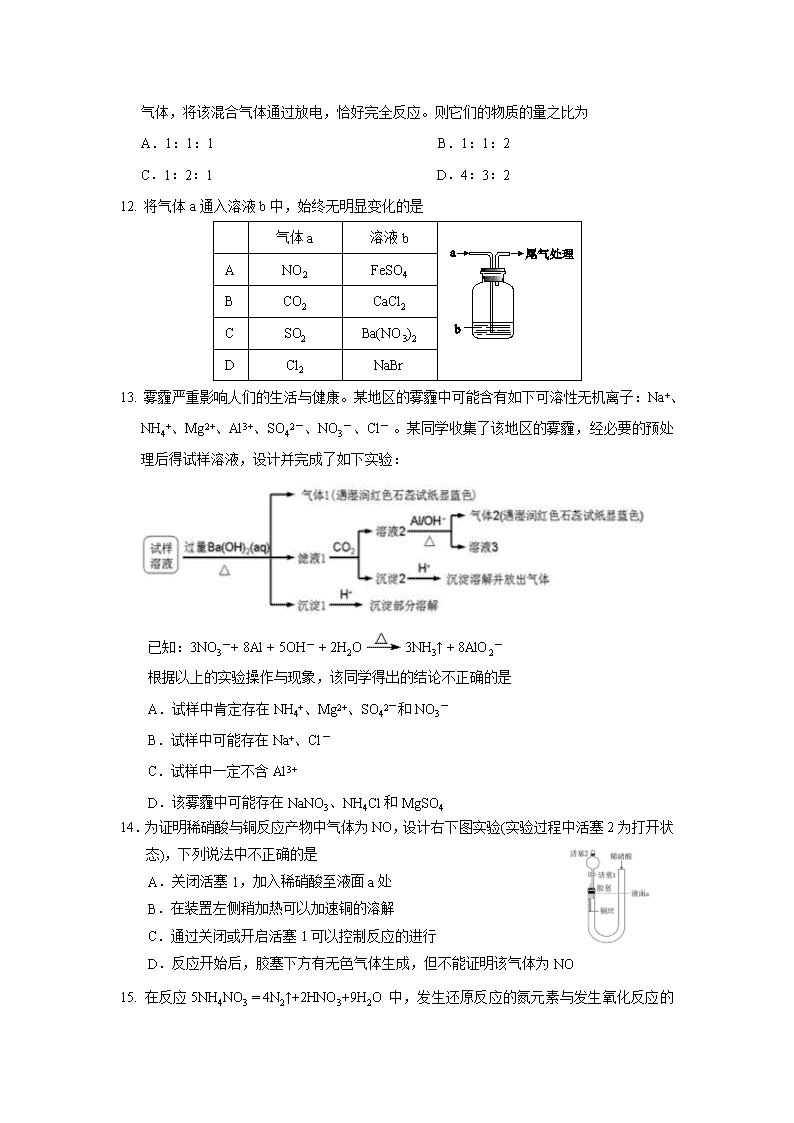
2017-2018 学年内蒙古赤峰二中高一上学期期末考试化学卷 本试卷共 20道题,满分 100分。考试时间 90分钟 (答案填写在答题卡上) 2018年 1月 可能用到的相对原子质量:H-1 C-12 N-14 O-16 Na-23 Mg-24 Al-27 S-32 Cl-35.5 Mn-55 Fe-56 Cu-64 Ag-108 Ba-137 第Ⅰ卷(共 48分) 一、选择题(本题共 16小题,每小题 3分,共 48分。每小题只有一个正确选项) 1. 食品干燥剂应无毒、无味、无腐蚀性及环境友好。下列说法错误的是 A.硅胶可用作食品干燥剂 B.六水合氯化钙可用作食品干燥剂 C.P2O5不可用作食品干燥剂 D.加工后具有吸水性的植物纤维可用作食品干燥剂 2. 下列表述不正确..的是 A.人造刚玉熔点很高,可用作高级耐火材料,主要成分是 Al2O3 B.在医疗上碳酸氢钠可用于治疗胃酸过多 C.用于现代通讯的光导纤维的主要成分是高纯度的硅 D.分散系中分散质粒子的直径:Fe(OH)3悬浊液>Fe(OH)3胶体>FeCl3溶液 3. 下图分别表示四种操作,其中至少有两处错误的是 4. 设 NA为阿伏加德罗常数的值,下列说法正确的是 A.100 g质量分数为 46%的乙醇(C2H6O)水溶液中含有的氧原子数为 4NA B.2 mol Cu与 100mL 浓度为 18.4 mol·L-1 的浓硫酸在加热条件下充分反应,生成 SO2 分子的个数为 0.92 NA C.0.1mol Fe 在 0.lmol Cl2中充分燃烧,转移的电子数为 0.3NA D.0.1mol/L的 Ba(OH)2溶液中,OH- 的个数为 0.2NA个 5. 某无色溶液含有下列离子中的若干种:H+、NH4+、Fe3+、Ba2+、Al3+、Cl﹣、OH﹣、 CO32 ﹣、NO3 ﹣。向该溶液中加入铝粉,只放出 H2,则溶液中能大量存在的离子最多有 A. 3种 B. 4种 C. 5种 D. 6种 6. 氧化还原反应中,水的作用可以是氧化剂、还原剂、既是氧化剂又是还原剂、既非氧化 剂又非还原剂等。下列反应与 Br2+SO2+2H2O=H2SO4+2HBr相比较,水的作用不相同的是 ①2Na2O2+2H2O=4NaOH+O2↑ ②2F2+2H2O=4HF+O2 ③4NO2+O2+2H2O=4HNO3 ④2Na+2H2O=2NaOH +H2↑ A. ①③ B. ②③ C. ③④ D. ②④ 7. 下列离子方程式书写正确的是 A. 用 FeCl3溶液腐蚀铜线路板:Cu + Fe3+ = Cu2+ + Fe2+ B. 向氯化铝溶液中加入过量的氨水:Al3+ + 4NH3·H2O = AlO2- + 4NH4+ + 2H2O C. Na2O2固体与 H2O反应产生 O2 :2Na2O2 + 2H2O = 4Na+ + 4OH- + O2↑ D. 向酸性 KMnO4溶液中通入 SO2:3SO2+2MnO- 4+4OH-== 2MnO2↓+3SO2-4 +2H2O 8. 下列物质分类的正确组合是 分类 组合 纯净物 酸 盐 碱性氧化物 酸性氧化物 A 碱石灰 高氯酸 纯碱 氧化铝 二氧化碳 B 盐酸 醋酸 小苏打 氧化镁 二氧化氮 C H2O2 碳酸 苏打 过氧化钠 二氧化硫 D 五水硫酸铜 硝酸 碱式碳酸铜 氧化钠 三氧化硫 9. 下列各组物质的稀溶液相互反应,无论是前者滴入后者,还是后者滴入前者,反应现象 都相同的是 A.NaHSO4和 Ba(OH)2 B.AlCl3和 NaOH C.Na2CO3和 H2SO4 D.NaAlO2和 H2SO4 10. 相同状况下,在容积相同的三个烧瓶内分别充满干燥的 HCl、NO2、NH3气体,做喷泉 实验,所得三种溶液的物质的量浓度比为 A.3:3:2 B.1:1:1 C.2:2:3 D.无法比较 11. 将 2.17g Na、Na2O、Na2O2 的混合物与足量的水反应,在标准状况下得到 336mL 混合 气体,将该混合气体通过放电,恰好完全反应。则它们的物质的量之比为 A.1:1:1 B.1:1:2 C.1:2:1 D.4:3:2 12. 将气体 a通入溶液 b中,始终无明显变化的是 气体 a 溶液 b A NO2 FeSO4 B CO2 CaCl2 C SO2 Ba(NO3)2 D Cl2 NaBr 13. 雾霾严重影响人们的生活与健康。某地区的雾霾中可能含有如下可溶性无机离子:Na+、 NH4+、Mg2+、Al3+、SO42 -、NO3 -、Cl- 。某同学收集了该地区的雾霾,经必要的预处理 后得试样溶液,设计并完成了如下实验: 已知:3NO3 -+ 8Al + 5OH- + 2H2O 3NH3↑ + 8AlO2 - 根据以上的实验操作与现象,该同学得出的结论不正确的是 A.试样中肯定存在 NH4+、Mg2+、SO42 -和 NO3 - B.试样中可能存在 Na+、Cl- C.试样中一定不含 Al3+ D.该雾霾中可能存在 NaNO3、NH4Cl和MgSO4 14.为证明稀硝酸与铜反应产物中气体为 NO,设计右下图实验(实验过程中活塞 2为打开状 态),下列说法中不正确的是 A.关闭活塞 1,加入稀硝酸至液面 a处 B.在装置左侧稍加热可以加速铜的溶解 C.通过关闭或开启活塞 1可以控制反应的进行 D.反应开始后,胶塞下方有无色气体生成,但不能证明该气体为 NO 15. 在反应 5NH4NO3 = 4N2↑+2HNO3+9H2O 中,发生还原反应的氮元素与发生氧化反应的氮 元素的物质的量之比为 A.5:3 B.3:5 C.5:4 D.4:5 16. 某稀硫酸和稀硝酸的混合溶液 200 mL,平均分成两等份。向其中一份中逐渐加入铜粉, 最多能溶解 19.2 g(已知硝酸只被还原为 NO气体)。向另一份中逐渐加入铁粉,产生气 体的量随铁粉质量增加的变化如下图所示。下列分析或结果错误的是 A.OA 段产生的是 NO,AB 段的反应为 Fe+2Fe3+===3Fe2+, BC 段产生氢气 B.原混合酸中 NO - 3物质的量为 0.4 mol C.第二份溶液中最终溶质为 FeSO4 D.取 20 mL原混合酸加水稀释至 1 L后溶液的 H+浓度为 0.1 mol·L-1 第Ⅱ卷(共 52分) 二、非选择题(本题共 4小题) 17.(12分)已知某溶液中可能含有 NO3-、Cl-、SO42-、CO32-、NH4+、Fe3+、Al3+和 K+中的 几种,且所含阴离子的物质的量相等。为确定该溶 液的 成分,某学习小组做了如下实验: ①取该溶液 100mL,加入过量 NaOH溶液,加热, 得到 0.02mol气体,同时产生红 褐色沉淀; ②将沉淀过滤、洗涤、灼烧,得到 1.6 g固体; ③向上述②的滤液中加入足量 BaCl2溶液,得到 4.66 g不溶于盐酸的沉淀。 请回答下列问题: (1)结合题干和实验①②,判断原溶液中肯定含有的离子是 ,可以排除的 离子是 。 (2)由③推知原溶液中一定有 离子,其物质的量为 mol。 (3)综合(1)、(2)及题干信息,结合溶液中电荷守恒知识,还可以排除的离子是 。 最终得出结论:该溶液由 种阳离子(填数字,下同)和 种阴离子组成。 18.(10分)已知 A是一种红棕色金属氧化物,B、D是金属单质,J是一种难溶于水的白 色化合物,受热后容易发生分解。 (1)写出下列物质的名称或化学式: A(名称): E(名称): J(化学式): G(化学式): ; (2)按要求写方程式: D转化为 E的离子方程式: ; F在空气中转化为 G的化学方程式: ; 电解 C可以得到单质 B,试写出 B生成 I的离子方程式: 。 19.(22分)一氧化氮、二氧化氮等氮氧化物是常见的大气污染物,然而它们在工业上有着 广泛的用途。 已知:①室温下,2NO+Na2O2===2NaNO2; ②酸性条件下,NO或 NO - 2都能与MnO - 4反应生成 NO - 3和Mn2+, 如 5NO- 2+2MnO- 4+6H+===5NO- 3+2Mn2++3H2O。 Ⅰ.以木炭、浓硝酸、水和铜为原料生成的一氧化氮与过氧化钠反应制备亚硝酸钠的装置 如下图所示: (1)A中观察到的现象是_________________________________。 I H HCl 溶液 A B 高温 C D E 氨水 溶液 F 空气中 G △ A 红褐色白色 HCl 溶液 沉淀 沉淀 NaOH 溶液 J △ C (2)B中反应的离子方程式是____________________,_______________________。 (3)装置 C的作用是___________________,装置 F的作用是__________________。 (4)若无装置 D,则 E中产物除亚硝酸钠外,还有副产物________(填化学式)。 Ⅱ.某研究性学习小组对 NO2与 Na2O2能否发生反应进行探究。 【提出假设】 假设一:NO2与 Na2O2不反应; 假设二:NO2能被 Na2O2氧化; 假设三:______________________________________________。 【设计实验】 (1)实验时,将 NO2气体通入盛有 Na2O2的玻璃管中,淡黄色粉末完全变成白色,说明 假设________不成立。 (2)若假设二成立,则反应的化学方程式是_______________________。 (3)为验证假设二是否成立,该小组同学进行如下定性实验研究,请完成下表内容。 实验步骤(不要求写具体操作过程, 试剂、仪器任选) 预期的实验现象及结论 取适量的白色固体置于试管中,加蒸馏水 溶解, ____________________________________ ____________________________________ ________________________________ ________________________________ ________________________________ 20.(8分)计算题。 (1) 如下图实验装置,当有 16.8g铁粉参加反应时,生成的气体在标准状况下的体积 是 L。 (2) 向 Cu和 CuO组成的混合物中,加入 100mL 6.0mol·L1稀硝酸溶液,恰好使混合物完 全溶解,同时收集到标准状况下 NO 2.24 L。请回答以下问题: ①原混合物中 Cu和 CuO的物质的量之比为 ; ②假设反应后溶液的体积保持不变,所得溶液溶质的物质的量浓度 mol·L1; ③若将生成的 NO气体完全溶解,需要标准状况下的氧气的物质的量为 。 赤峰二中 2017级高一上学期期末考试 化学试题参考答案 一.选择题 1~5BCBAC 6~10DCDAB 11~15DBCAB 16D 二.填空题 17. (共 12分,前五个空各 2分,后两个空各 1分) (1) NH4+、Fe3+ CO32- (2) SO42- 0.02 (3) Al3+和 K+ 2(1分) 3(1分) 18. (10分) (1)氧化铁 氯化亚铁 Al(OH)3 Fe(OH)3 (各 1分) (2)Fe + 2H+= Fe2+ + H2↑ 4Fe(OH)2 + O2 + 2H2O = 4Fe(OH)3 2Al + 2OH- + 2H2O = 2AlO2-+3H2↑ (各 2分) 19.(211=22) Ⅰ. (1)有红棕色气体生成 (2)3NO2+H2O===2H++2NO- 3+NO↑ 3Cu+8H++2NO- 3===3Cu2++2NO↑+4H2O (3)防止倒吸 吸收未反应的 NO (4) Na2CO3、NaOH Ⅱ.【提出假设】 NO2能被 Na2O2还原 【设计实验】 (1)一 (2)2NO2+Na2O2===2NaNO3 (3) 实验步骤(不要求写具体操作过程,试 剂、仪器任选) 预期的实验现象及结论 取适量的白色固体置于试管中,加蒸馏 水溶解,再滴加稀硫酸酸化,最后滴加 高锰酸钾溶液 若高锰酸钾溶液不褪色,则假设二成立; 若高锰酸钾溶液褪色,则假设二不成立 (其他合理答案也可) 20. (8分) (1) 8.96 (2) ①3:2 ②2.5 ③0.075mol查看更多