- 2021-04-28 发布 |
- 37.5 KB |
- 7页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2020高考化学二轮复习层级题组快练3含解析
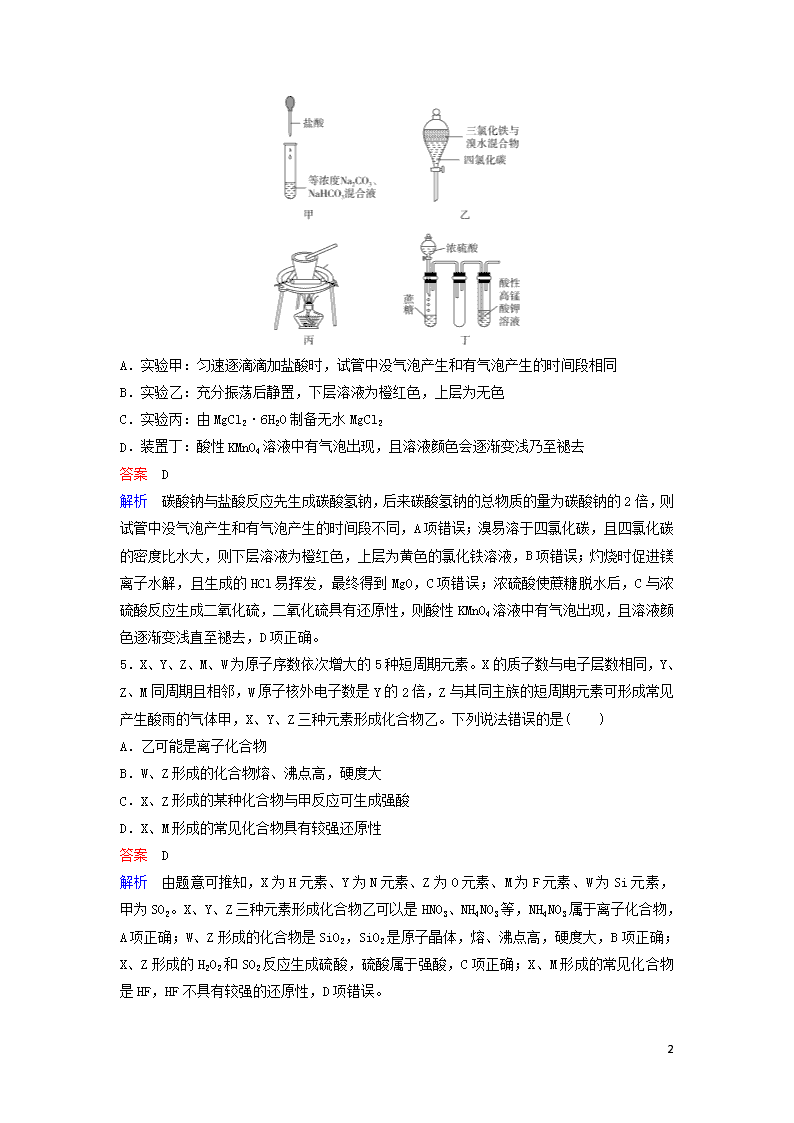
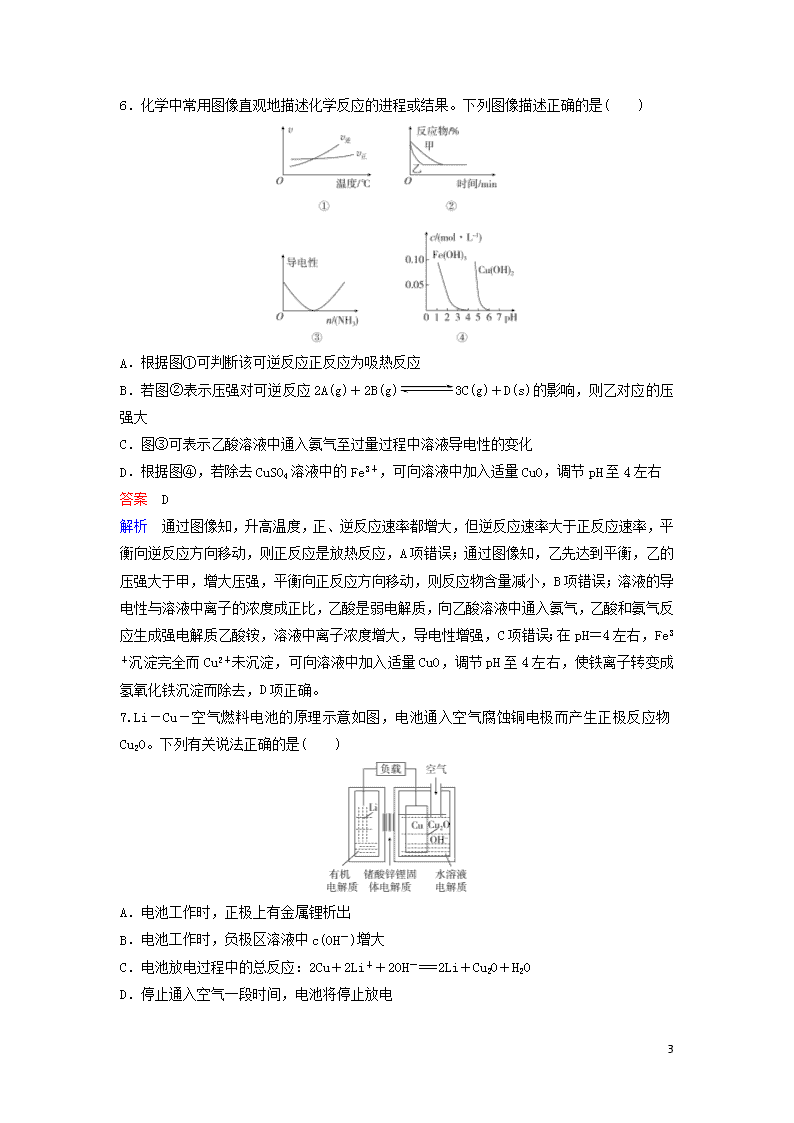
1 层级题组快练 8+2(3) 1.2018 平昌冬奥会闭幕式上,北京八分钟表演中两只滑冰熊猫木偶让人印象深刻。下列是 熊猫木偶在选材上先后尝试的材料,其中属于合成高分子材料的是( ) A.天然白藤 B.镁铝合金丝 C.PVC 仿真藤条 C.碳纤维条 答案 C 2.下列有关物质性质和用途的说法正确的是( ) A.明矾、聚合氯化铝铁等净水剂的净水原理都是胶体的吸附性 B.我国预计 2020 年发射首颗火星探测器太阳能电池帆板的材料是二氧化硅 C.中国高铁走向世界,其车厢采用铝合金主要因为铝密度小、常温下不与氧气反应 D.CO、SO2、NO、NO2 在空气中都能较长时间的存在,易造成大气污染 答案 A 解析 硅属于半导体材料,广泛应用于太阳能电池,B 项错误;铝单质密度小,但性质活泼, 常温下可以与氧气反应生成氧化铝,但生成的致密的氧化铝保护膜能够阻碍铝的进一步腐 蚀,C 项错误;NO 很容易被空气中的 O2 氧化成 NO2,D 项错误。 3.设 NA 为阿伏加德罗常数的数值。下列说法正确的是( ) A.25 ℃时,pH=12 的氨水中所含 OH-的数目为 0.01NA B.36 g 由 35Cl 和 37Cl 组成的氯气中所含质子数一定为 17NA C.7.8 g Na2O2 与足量酸性 KMnO4 溶液反应,转移的电子数为 0.2NA D.30 g 由甲醛(HCHO)与乙酸混合的溶液中所含 C—H 键的数目为 2NA 答案 C 解析 体积未知,无法计算氢氧根离子的数目,A 项错误;由 35Cl 和 37Cl 组成的氯气的相对 分子质量不确定,无法计算 36 g 由 35Cl 和 37Cl 组成的氯气的物质的量,B 项错误;7.8 g Na2O2(即 0.1 mol)与足量酸性 KMnO4 溶液反应,氧由-1 价变为 0 价,故转移的电子数为 0.2NA, C 项正确;30 g 甲醛中所含 C—H 键的数目为 2 mol,30 g 乙酸中所含 C—H 键的数目为 1.5 mol,不知道两者的比例关系,故无法计算 30 g 由甲醛(HCHO)与乙酸混合的溶液中所含 C—H 键的数目,D 项错误。 4.对于下图所示实验,下列实验现象预测或操作正确的是( ) 2 A.实验甲:匀速逐滴滴加盐酸时,试管中没气泡产生和有气泡产生的时间段相同 B.实验乙:充分振荡后静置,下层溶液为橙红色,上层为无色 C.实验丙:由 MgCl2·6H2O 制备无水 MgCl2 D.装置丁:酸性 KMnO4 溶液中有气泡出现,且溶液颜色会逐渐变浅乃至褪去 答案 D 解析 碳酸钠与盐酸反应先生成碳酸氢钠,后来碳酸氢钠的总物质的量为碳酸钠的 2 倍,则 试管中没气泡产生和有气泡产生的时间段不同,A 项错误;溴易溶于四氯化碳,且四氯化碳 的密度比水大,则下层溶液为橙红色,上层为黄色的氯化铁溶液,B 项错误;灼烧时促进镁 离子水解,且生成的 HCl 易挥发,最终得到 MgO,C 项错误;浓硫酸使蔗糖脱水后,C 与浓 硫酸反应生成二氧化硫,二氧化硫具有还原性,则酸性 KMnO4 溶液中有气泡出现,且溶液颜 色逐渐变浅直至褪去,D 项正确。 5.X、Y、Z、M、W 为原子序数依次增大的 5 种短周期元素。X 的质子数与电子层数相同,Y、 Z、M 同周期且相邻,W 原子核外电子数是 Y 的 2 倍,Z 与其同主族的短周期元素可形成常见 产生酸雨的气体甲,X、Y、Z 三种元素形成化合物乙。下列说法错误的是( ) A.乙可能是离子化合物 B.W、Z 形成的化合物熔、沸点高,硬度大 C.X、Z 形成的某种化合物与甲反应可生成强酸 D.X、M 形成的常见化合物具有较强还原性 答案 D 解析 由题意可推知,X 为 H 元素、Y 为 N 元素、Z 为 O 元素、M 为 F 元素、W 为 Si 元素, 甲为 SO2。X、Y、Z 三种元素形成化合物乙可以是 HNO3、NH4NO3 等,NH4NO3 属于离子化合物,A 项正确;W、Z 形成的化合物是 SiO2,SiO2 是原子晶体,熔、沸点高,硬度大,B 项正确;X、 Z 形成的 H2O2 和 SO2 反应生成硫酸,硫酸属于强酸,C 项正确;X、M 形成的常见化合物是 HF, HF 不具有较强的还原性,D 项错误。 3 6.化学中常用图像直观地描述化学反应的进程或结果。下列图像描述正确的是( ) A.根据图①可判断该可逆反应正反应为吸热反应 B.若图②表示压强对可逆反应 2A(g)+2B(g) 3C(g)+D(s)的影响,则乙对应的压 强大 C.图③可表示乙酸溶液中通入氨气至过量过程中溶液导电性的变化 D.根据图④,若除去 CuSO4 溶液中的 Fe3+,可向溶液中加入适量 CuO,调节 pH 至 4 左右 答案 D 解析 通过图像知,升高温度,正、逆反应速率都增大,但逆反应速率大于正反应速率,平 衡向逆反应方向移动,则正反应是放热反应,A 项错误;通过图像知,乙先达到平衡,乙的 压强大于甲,增大压强,平衡向正反应方向移动,则反应物含量减小,B 项错误;溶液的导 电性与溶液中离子的浓度成正比,乙酸是弱电解质,向乙酸溶液中通入氨气,乙酸和氨气反 应生成强电解质乙酸铵,溶液中离子浓度增大,导电性增强,C 项错误;在 pH=4 左右,Fe3 +沉淀完全而 Cu2+未沉淀,可向溶液中加入适量 CuO,调节 pH 至 4 左右,使铁离子转变成氢 氧化铁沉淀而除去,D 项正确。 7.Li-Cu-空气燃料电池的原理示意如图,电池通入空气腐蚀铜电极而产生正极反应物 Cu2O。下列有关说法正确的是( ) A.电池工作时,正极上有金属锂析出 B.电池工作时,负极区溶液中 c(OH-)增大 C.电池放电过程中的总反应:2Cu+2Li++2OH-===2Li+Cu2O+H2O D.停止通入空气一段时间,电池将停止放电 4 答案 D 解析 电池工作时,正极发生反应为 Cu2O+H2O+2e-===2OH-+2Cu,没有金属锂析出,A 项 错误;负极为锂失电子生成 Li+,负极区无水溶液,B 项错误;电池放电过程中的总反应为 2Li+Cu2O+H2O===2Cu+2Li++2OH-,C 项错误;停止通入空气一段时间,铜电极不再被氧 化生成 Cu2O,当正极的 Cu2O 全部转化为 Cu 后,电池将停止放电,D 项正确。 8.某温度时,向氨水中通入 CO2,各种离子的变化趋势如下图所示。下列说法正确的是( ) A.随着 CO2 的通入, c(OH-) c(NH3·H2O) 不断增大 B.在 pH=9.0 时,c(NH4 +)>c(CO3 2-)>c(HCO3 -)>c(NH2COO-) C.溶液中:c(NH4 +)+c(NH3)=2c(CO3 2-)+c(HCO3 -)+c(NH2COO-)+c(OH-) D.在溶液 pH 不断降低的过程中,有含 NH2COO-的中间产物生成 答案 D 解析 已知 Kb=c(NH4 +)·c(OH-) c(NH3·H2O) ,温度一定时,K b 为常数,随着 CO2 的通入,c(NH4 +) 逐渐增大,则 c(OH-) c(NH3·H2O) 不断减小,A 项错误;pH=9.0 时,图像中各种离子浓度的大小 关系为 c(NH4 +)>c(HCO3 -)>c(NH2COO-)>c(CO3 2-),B 项错误;溶液中存在电荷守恒:c(NH4 +) +c(H+)=2c(CO3 2-)+c(HCO3 -)+c(NH2COO-)+c(OH-),C 项错误;由图像可知,开始没有 NH2COO-,后来也不存在 NH2COO-,所以 NH2COO-为中间产物,D 项正确。 9.金属锰主要用在航空、冶金及化工等行业。采用“两矿一步法”浸出高硫高铁碳酸锰矿(主 要含有 FeS2、FeCO3、SiO2、CuO 等杂质)制备金属锰的工艺流程如下: 已知:Ⅰ.福美钠的化学式为(CH3)2CNS2Na,采用福美钠对 MnSO4 溶液中重金属进行净化去除 效果良好。 Ⅱ.部分金属离子形成氢氧化物沉淀的 pH 如下表所示。 离子 Fe2+ Cu2+ Fe3+ Mn2+ pH(开始沉淀) 7.5 5.2 1.7 7.2 5 pH(完全沉淀) 9.7 7.8 3.2 10.4 (1)FeS2 中 S 元素的化合价为________价。 (2)浸出时,软锰矿中的主要成分 MnO2 与 FeS2 发生氧化还原反应,写出该反应的化学方程式: ________________________________________________________________________ ________________________________________________________________________。 (3)向浸出液中吹入空气的目的是_______________________________________________ ________________________________________________________________________(用离子 方程式表示)。 (4)调节 pH 的最佳范围是________,沉淀的成分是________________(填化学式)。 (5)(CH3)2CNS2H 可由(CH3)2NH 与 CS2 通过加成反应得到,1 mol (CH3)2NH 中,共价键的数目为 ________NA。 (6)工业上采用如图所示的方法获得金属 Mn,B 极为________极,若没有阴离子交换膜,Mn2 +将在 D 极发生反应生成 MnO2,则电极反应式为_______________________________ ________________________________________________________________________。 答案 (1)-1 (2)15MnO2+2FeS2+14H2SO4===15MnSO4+Fe2(SO4)3+14H2O (3)4Fe2++O2+4H+===4Fe3++2H2O (4)3.2≤pH<7.2 Fe(OH)3、SiO2、Cu(OH)2 (5)9 (6)正 Mn2++2H2O-2e-===MnO2+4H+ 解析 高硫高铁碳酸锰矿(主要含有 FeS2、FeCO3、SiO2、CuO 等杂质)用硫酸溶解,SiO2 不反 应,FeCO3、CuO 与硫酸反应得到 Fe2+、Cu2+,MnO2 将 FeS2 氧化为 Fe3+、SO4 2-,MnO2 被还原为 Mn2+;浸出液中金属离子主要有 Fe3+、Fe2+、Cu2+、Mn2+,吹入空气将 Fe2+完全氧化,再加入 氨水调节 pH 使 Fe3+、Cu2+沉淀而 Mn2+不沉淀,由表格中数据可知调节 3.2≤pH<7.2 时 Cu2+ 未完全沉淀,加入福美钠除去 MnSO4 溶液中残留的 Cu2+,最后电解 MnSO4 溶液得到金属锰。 6 (5)(CH3)2NH 结构式为 ,1 个(CH3)2NH 分子中共价键数目为 9。 (6)由溶液中 SO4 2-迁移方向可知 D 极为阳极,则 B 极为正极;Mn2+在阳极上失电子生成 MnO2。 10.研究碳、氮及其化合物的转化对于环境的改善有重大意义。 (1)氧化还原法消除 NOx 的转化如下: NO――→O3 反应ⅠNO2 ――→CO(NH2)2 反应Ⅱ N2 已知:NO(g)+O3(g)===NO2(g)+O2(g) ΔH=-200.9 kJ·mol-1 2NO(g)+O2(g)===2NO2(g) ΔH=-116.2 kJ·mol-1 则 NO 与 O3 只生成 NO2 的热化学方程式为_________________________________________ ________________________________________________________________________。 (2)有人设想将 CO 按下列反应除去:2CO(g)===2C(s)+O2(g) ΔH>0,请你分析该反应能否 自发进行?________(填“是”或“否”),依据是_________________________________ ________________________________________________________________________。 (3)活性炭也可用于处理汽车尾气中的 NO。在 2 L 恒容密闭容器中加入 0.100 0 mol NO 和 2.030 mol 固体活性炭,生成 A、B 两种气体,在不同温度下测得平衡体系中各物质的物质 的量如下表: 温度 固体活性炭/mol NO/mol A/mol B/mol 200 ℃ 2.000 0.040 0 0.030 0 0.030 0 335 ℃ 2.005 0.050 0 0.025 0 0.025 0 ① 结 合 上 表 的 数 据 , 写 出 NO 与 活 性 炭 反 应 的 化 学 方 程 式 : ________________________________________________________________________, 该反应的正反应为________(填“吸热”或“放热”)反应。 ②200 ℃时,平衡后向恒容容器中再充入 0.100 0 mol NO,再次平衡后,NO 的体积分数将 ________(填“增大”“减小”或“不变”)。 (4)用亚硫酸钠溶液吸收二氧化硫得到亚硫酸氢钠溶液,然后电解该溶液可制得硫酸,电解 原理示意图如下图所示。请写出开始时阳极的电极反应式:___________________________ ________________________________________________________________________。 7 (5)常温下,Ksp(BaCO3)=2.5×10-9,Ksp(BaSO4)=1.0×10-10,控制条件可实现如下沉淀转化: BaSO4(s)+CO3 2 - (aq) BaCO3(s)+SO4 2 - (aq),该反应平衡常数 K 的表达式为 K= ________,欲用 1 L Na2CO3 溶液将 0.01 mol BaSO4 转化为 BaCO3,则 Na2CO3 溶液的初始浓度 应不低于________。 答案 (1)3NO(g)+O3(g)===3NO2(g)ΔH=-317.1 kJ·mol-1 (2)否 该反应是焓增、熵减的反应,根据ΔG=ΔH-TΔS,ΔG>0 (3)①2NO+C CO2+N2 放热 ②不变 (4)HSO3 -+H2O-2e-===SO4 2-+3H+ (5)c(SO4 2-) c(CO3 2-) 0.26 mol·L-1 解析 (1)将已知的两个热化学方程式编号为①②,根据盖斯定律,①+②得到 3NO(g)+ O3(g)===3NO2(g) ΔH=-317.1 kJ·mol-1。 (3)①从表中读出,NO、C、A、B 物质的量变化之比为 2∶1∶1∶1,则 NO 与活性炭反应的化 学方程式为 2NO+C CO2+N2;温度升高平衡逆向移动,所以正反应是放热反应。② 反应前后气体的化学计量数之和相等,向恒 容容器中再充入 0.100 0 mol NO,相当于增大压强,平衡转化率不变,所以 NO 的体积分数 不变。 (5)K=c(SO4 2-) c(CO3 2-) =Ksp(BaSO4) Ksp(BaCO3) =1.0×10-10 2.5×10-9 =0.04,c(SO4 2-)=0.01 mol·L-1, 0.01 c(CO3 2-) = 0.04,c(Na2CO3)≥(0.25+0.01)mol·L-1=0.26 mol·L-1。查看更多