2018届高考一轮复习人教版物质结构元素周期律元素周期表元素周期律学案(3)
第二讲 元素周期表 元素周期律
[2017高考导航]
考纲要求
真题统计
命题趋势
1.掌握元素周期律的实质。了解元素周期表(长式)的结构(周期、族)及其应用。
2.以第三周期为例,掌握同一周期内元素性质的递变规律与原子结构的关系。
3.以ⅠA和ⅦA族为例,掌握同一主族内元素性质递变规律与原子结构的关系。
4.了解金属、非金属在元素周期表中的位置及其性质递变的规律。
2015,卷Ⅰ 12T;
2015,卷Ⅱ 9T;
2014,卷Ⅰ 10T;
2014,卷Ⅱ 27T(1);
2013,卷Ⅰ 9T
预计2017年高考主要考查元素性质的周期性变化,以元素周期表为依托考查各微粒间关系,用物质结构理论来解释现象、定位推断、归纳总结、定量计算。题型会稳中有变。复习备考时,重点掌握同周期、同主族元素性质的递变规律,注意某些物质的特征;理清元素的“位—构—性”的关系,用好元素周期表这一工具。
考点一 元素周期表[学生用书P120]
1.原子序数
原子序数=核电荷数=核外电子数=质子数。
2.编排原则
周期(横行):元素原子的电子层数相同,左―→右:原子序数递增;
族(纵行):元素原子的最外层电子数相同,上―→下:电子层数递增。
3.结构
(1)周期(7个横行,7个周期)
短周期
长周期
周期序数
一
二
三
四
五
六
七
元素种数
2
8
8
18
18
32
32
0族元素
原子序数
2
10
18
36
54
86
118
(2)族(18个纵行,16个族)
主族
列序
1
2
13
14
15
16
17
族序
ⅠA
ⅡA
ⅢA
ⅣA
ⅤA
ⅥA
ⅦA
副族
列序
3
4
5
6
7
11
12
族序
ⅢB
ⅣB
ⅤB
ⅥB
ⅦB
ⅠB
ⅡB
Ⅷ族
第8、9、10共3个纵行
0族
第18纵行
(3)分区
①分界线:沿着元素周期表中铝、锗、锑、钋与硼、硅、砷、碲、砹的交界处画一条虚线,即为金属元素区和非金属元素区的分界线。
②各区位置:分界线左下方为金属元素区,分界线右上方为非金属元素区。
③分界线附近元素的性质:既表现金属元素的性质,又表现非金属元素的性质。
1.请在下表中画出元素周期表的轮廓,并在表中按要求完成下列问题:
(1)标出族序数。
(2)画出金属与非金属的分界线;画出过渡元素。
(3)标出镧系、锕系的位置。
(4)写出各周期元素的种数。
(5)写出稀有气体元素的原子序数。
(6)标出113~118号元素的位置。
答案:
2.(教材改编)判断正误(正确的打“√”,错误的打“×”)
(1)最外层电子数为2的元素一定在第ⅡA族。( )
(2)元素周期表各族中第Ⅷ族元素种类最多。( )
(3)第三、四周期同主族相邻元素的原子序数之差都是18。( )
(4)同周期的 ⅡA族元素与 ⅢA族元素的原子序数之差都相同。( )
(5)115号元素位于第七周期第ⅤA族。( )
(6)原子序数之差为2的两种元素不可能位于同一主族。( )
(7)位于同一主族的甲、乙两种元素,甲的原子序数为x,则乙的原子序数可能为x+4。( )
(8)位于同一周期的甲、乙两种元素,甲位于ⅠA族,原子序数为x,乙位于ⅢA族,则乙原子序数可能为x+19。( )
答案:(1)× (2)× (3)× (4)× (5)√ (6)×
(7)× (8)×
3.(1)甲、乙是元素周期表中同一主族相邻周期的两种元素(其中甲在上一周期),若甲的原子序数为x,则乙的原子序数可能是______________________。
(2)若甲、乙分别是同一周期的ⅡA族和ⅦA族元素,原子序数分别为m和n,则m和n的关系为________________________________________________________________________。
解析:(1)因前六周期中元素的数目分别为2、8、8、18、18、32;同一主族中乙的原子序数可以是x+2、x+8、x+18、x+32。
(2)对于第一、二、三周期,同一周期的ⅡA族和ⅦA族元素的原子序数只相差5,而对于第四、五周期来说,由于存在过渡元素,同一周期的ⅡA族和ⅦA族元素的原子序数则相差15;而对于第六、七周期来说,由于存在镧系和锕系元素,同一周期的ⅡA族和ⅦA族元素的原子序数则相差29。
答案:(1)x+2、x+8、x+18、x+32
(2)n=m+5、n=m+15、n=m+29
名师点拨
(1)周期表18个纵行是16个族,第8、9、10纵行为一族。
(2)在描述元素在Ⅷ族时,不要写成ⅧB。
(3)元素周期表中,族序数Ⅱ、Ⅲ是主族和副族的分界线,第一次分界时主族(ⅡA)在副族(ⅢB)之前,第二次分界时副族(ⅡB)在主族(ⅢA)之前。
(4)同周期第ⅡA族和第ⅢA族原子序数的差值可能为1、11、25。
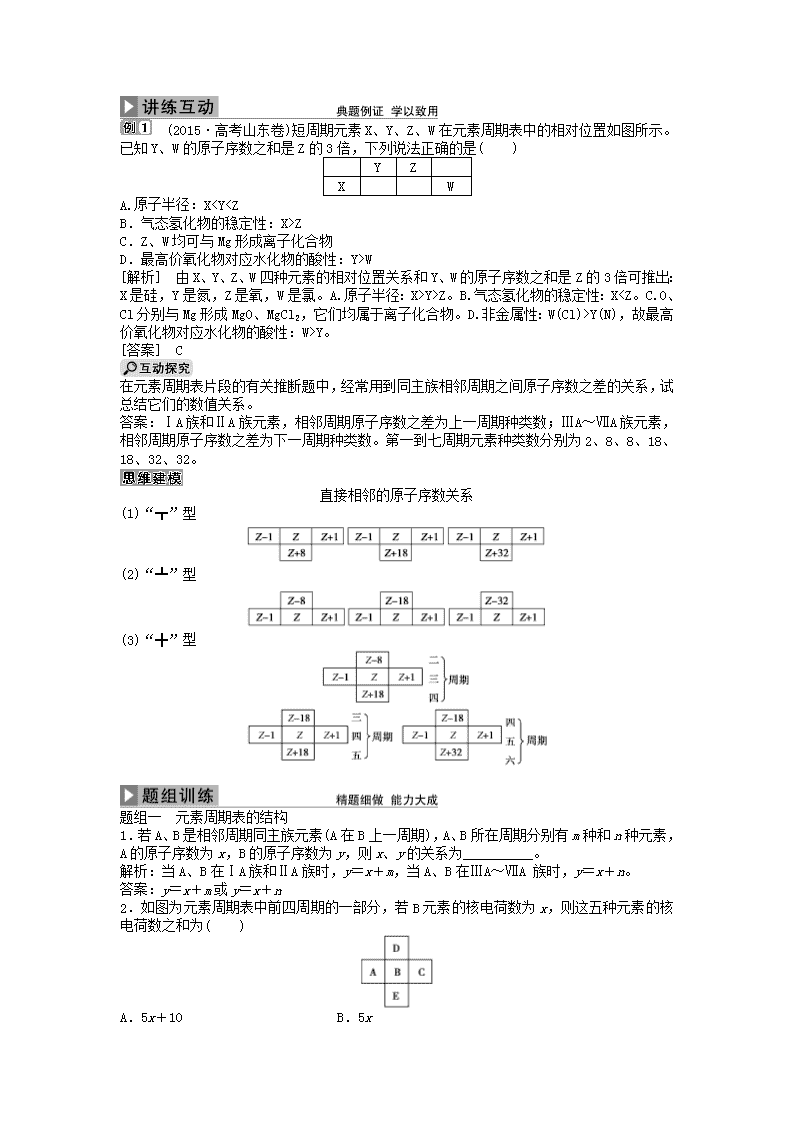
(2015·高考山东卷)短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示。已知Y、W的原子序数之和是Z的3倍,下列说法正确的是( )
Y
Z
X
W
A.原子半径:X
Z
C.Z、W均可与Mg形成离子化合物
D.最高价氧化物对应水化物的酸性:Y>W
[解析] 由X、Y、Z、W四种元素的相对位置关系和Y、W的原子序数之和是Z的3倍可推出:X是硅,Y是氮,Z是氧,W是氯。A.原子半径:X>Y>Z。B.气态氢化物的稳定性:XY(N),故最高价氧化物对应水化物的酸性:W>Y。
[答案] C
在元素周期表片段的有关推断题中,经常用到同主族相邻周期之间原子序数之差的关系,试总结它们的数值关系。
答案:ⅠA族和ⅡA族元素,相邻周期原子序数之差为上一周期种类数;ⅢA~ⅦA族元素,相邻周期原子序数之差为下一周期种类数。第一到七周期元素种类数分别为2、8、8、18、18、32、32。
直接相邻的原子序数关系
(1)“┳”型
(2)“┻”型
(3)“╋”型
题组一 元素周期表的结构
1.若A、B是相邻周期同主族元素(A在B上一周期),A、B所在周期分别有m种和n种元素,A的原子序数为x,B的原子序数为y,则x、y的关系为__________。
解析:当A、B在ⅠA族和ⅡA族时,y=x+m,当A、B在ⅢA~ⅦA 族时,y=x+n。
答案:y=x+m或y=x+n
2.如图为元素周期表中前四周期的一部分,若B元素的核电荷数为x,则这五种元素的核电荷数之和为( )
A.5x+10 B.5x
C.5x+14 D.5x+16
解析:选A。分析如下:
题组二 元素周期表的应用
3.(2015·高考全国卷Ⅰ,12,6分)W、X、Y、Z均为短周期主族元素,原子序数依次增加,且原子核外L电子层的电子数分别为0、5、8、8,它们的最外层电子数之和为18。下列说法正确的是( )
A.单质的沸点:W >X
B.阴离子的还原性:W >Z
C.氧化物的水化物的酸性:YH2,A不正确。
B.Cl元素的非金属性强于H元素,元素得电子能力越强,其对应阴离子越不容易失去电子,故对应阴离子的还原性:Cl-弱于H-,B正确。
C.P元素的非金属性弱于Cl元素的非金属性,元素非金属性越弱,其最高价氧化物对应水化物的酸性越弱,故酸性:H3PO4 Z > Y > X
B.最高价氧化物对应水化物的酸性:X > W > Z
C.最简单气态氢化物的热稳定性:Y > X > W > Z
D.元素X、Z、W的最高化合价分别与其主族序数相等
解析:选A。从元素周期表的局部图可知短周期元素X、Y、Z、W为二、三周期元素,W位于第三周期,W原子的质子数是其最外层电子数的三倍,故W是P元素,据此推出X、Y、Z分别是氮、氧、硅。根据四种元素在周期表中的位置关系可知,原子半径:Z > W > X > Y,A项错误;非金属性:O > N > P > Si,最高价氧化物对应水化物的酸性:HNO3 > H3PO4 > H2SiO3,即X > W > Z,氢化物的热稳定性:H2O > NH3 > PH3 > SiH4,即Y > X > W > Z,B、C项正确;主族元素除O、F外,其他元素最高化合价都等于其主族序数,D项正确。
周期表结构巧记口诀
横行叫周期,现有一至七,四长三个短。
纵行称为族,共有十六族,一八依次现①,一零再一遍②。
一纵一个族,Ⅷ族搞特殊,三纵算一族,占去8、9、10。
镧系与锕系,蜗居不如意,十五挤着住,都属ⅢB族。
说明:①指ⅠA、ⅡA、ⅢB、ⅣB、ⅤB、ⅥB、ⅦB、Ⅷ;
②指ⅠB、ⅡB、ⅢA、ⅣA、ⅤA、ⅥA、ⅦA、0。
考点二 元素周期律及其应用[学生用书P122]
一、定义及实质
元素的性质随原子序数的递增而呈周期性变化的规律。元素原子核外电子排布呈周期性变化的结果。
二、具体表现形式
项目
同周期(左→右)
同主族(上→下)
原子结构
核电荷数
逐渐增大
逐渐增大
电子层数
相同
逐渐增多
原子半径
逐渐减小(稀有气体元素除外)
逐渐增大
离子半径
阳离子半径逐渐减小,阴离子半径逐渐减小;r(阴离子)>r(阳离子)
逐渐增大
性质
化合价
最高正化合价由+1→+7(O、F除外),最低负化合价=-(8-主族序数)
相同,最高正化合价=主族序数(O、F除外)
续 表
项目
同周期(左→右)
同主族(上→下)
性质
元素的金
属性和非金属性
金属性逐渐减弱,非金属性逐渐增强
金属性逐渐增强,非金属性逐渐减弱
离子的氧
化性、还原性
阳离子氧化性逐渐增强,阴离子还原性逐渐减弱
阳离子氧化性逐渐减弱,阴离子还原性逐渐增强
气态氢化物稳定性
逐渐增强
逐渐减弱
最高价氧
化物对应
水化物的
酸碱性
碱性逐渐减弱酸性逐渐增强
碱性逐渐增强酸性逐渐减弱
三、元素金属性强弱的比较
1.结构比较法:最外层电子数越少,电子层数越多,元素金属性越强。
2.
3.
四、元素非金属性强弱的比较
1.结构比较法:最外层电子数越多,电子层数越少,非金属性越强。
2.
3.
1.判断正误(正确的打“√”,错误的打“×”)
(1)同周期元素,从左到右,原子半径逐渐减小,离子半径也逐渐减小。( )
(2)电子层数越多,半径越大。( )
(3)在主族元素中,最高正化合价均等于主族序数。( )
(4)元素的氧化物对应的水化物酸性越强,非金属性越强;碱性越强,金属性越强。( )
(5)元素的气态氢化物越稳定,非金属性越强,其水溶液的酸性越强,还原性越弱。( )
答案:(1)× (2)× (3)× (4)× (5)×
2.若A、B、C三种元素位于元素周期表中如图所示位置,则有关的各种性质均可排出顺序(D不能参与排列)。
(1)原子半径:__________________。
(2)金属性:__________________。
(3)非金属性:__________________。
答案:(1)C>A>B (2)C>A>B (3)B>A>C
名师点拨
(1)对于主族元素而言,元素的最高正化合价和主族序数相同,但是氟没有正价,氧无最高正价,一般为零价或负价。
(2)判断元素非金属性或金属性的强弱,可依据元素原子在化学反应中得失电子的难易而不是得失电子的多少。
(3)根据元素氧化物对应水化物的酸碱性的强弱判断元素非金属性或金属性的强弱时,必须是其最高价氧化物。
(2015·高考北京卷)下列有关性质的比较,不能用元素周期律解释的是( )
A.酸性:H2SO4>H3PO4
B.非金属性:Cl>Br
C.碱性:NaOH>Mg(OH)2
D.热稳定性:Na2CO3>NaHCO3
[解析] A.S、P位于同一周期,且S位于P的右侧。同周期元素从左向右非金属性逐渐增强,故非金属性S>P,所以H2SO4的酸性大于H3PO4。B.Cl、Br位于同一主族,Cl位于Br的上方,同主族元素由上到下非金属性逐渐减弱,故非金属性Cl>Br。C.Na、Mg是同周期元素,Na位于Mg的左侧,故Na的金属性比Mg的强,则NaOH的碱性比Mg(OH)2的强。D.NaHCO3的热稳定性差,是由于HCO3受热易分解。
[答案] D
向Na2CO3溶液中通入SO2,产生的气体通过足量的KMnO4溶液后,再通入澄清石灰水中,石灰水变浑浊,能否证明硫元素的非金属性强于碳元素?
答案:不能,应用两种元素的最高价氧化物的水化物的酸性强弱判断,SO2通入Na2CO3溶液虽然生成了CO2,但SO2不是S的最高价氧化物。
题组一 元素性质比较
1.已知33As、35Br位于同一周期。下列关系正确的是( )
A.原子半径:As>Cl>P
B.热稳定性:HCl>AsH3>HBr
C.还原性:As3->S2->Cl-
D.酸性:H3AsO4>H2SO4>H3PO4
解析:选C。解答本题主要从元素周期表、元素周期律的角度分析,要了解同一主族、同一周期元素性质的递变规律。同一周期原子半径从左到右依次减小,A选项中P的原子半径大于Cl,A错;非金属性越强,其气态氢化物越稳定,其最高价氧化物对应的水化物酸性越强,故B选项中热稳定性:HCl>HBr>AsH3,D选项中酸性:H2SO4>H3PO4>H3AsO4,B、D均错;S和Cl处于同一周期,故还原性:S2->Cl-,而As和Se处于同一周期,还原性:As3->Se2-,而S和Se又处于同一主族,还原性:Se2->S2-,故C正确。
X
Y
Z
W
T
2.(2015·高考浙江卷)右表为元素周期表的一部分,其中X、Y、Z、W为短周期元素,W元素原子的核电荷数为X元素的2倍。下列说法正确的是( )
A.X、W、Z元素的原子半径及它们的气态氢化物的热稳定性均依次递增
B.Y、Z、W元素在自然界中均不能以游离态存在,它们的最高价氧化物的水化物的酸性依次递增
C.YX2晶体熔化、液态WX3气化均需克服分子间作用力
D.根据元素周期律,可以推测T元素的单质具有半导体特性,T2X3具有氧化性和还原性
解析:选D。根据题意,X与W属于同族元素,且W的原子序数为X的2倍,可以得出在短周期元素中,X为氧元素,W为硫元素,由此可以推出Z为磷元素,Y为硅元素,T为砷元素。A项,X、W、Z元素的原子半径依次递增,但气态氢化物的热稳定性为X>W>Z,A项错误。B项,Y、Z元素在自然界中不能以游离态存在,但W元素(即硫)能以单质形式存在,B项错误。C项,WX3(SO3)是分子晶体,气化时需克服分子间作用力,YX2(SiO2)是原子晶体,熔化时需要破坏共价键,C项错误。D项,As位于元素周期表中第四周期第ⅤA 族,也是金属元素区与非金属元素区的交界处。根据同周期、同主族元素的金属性、非金属性递变规律,As的单质具有半导体特性。根据同周期元素最高、最低化合价递变规律,As的最高化合价是+5,最低化合价是-3,As2O3中As的化合价是+3,则As2O3具有氧化性和还原性,D项正确。
题组二 粒子半径大小比较
3.下列粒子半径大小的比较正确的是( )
A.Na+<Mg2+<Al3+
B.S2->Cl->Na+>Al3+
C.Na<Mg<Al<S
D.Cs<Rb<K<Na
解析:选B。A项中的离子具有相同的核外电子排布,则核电荷数越大,离子半径越小,故A项错误;B项中S2-和Cl-的电子层比Na+和Al3+多,再根据核外电子排布相同的离子半径比较规律可知B项正确;对于同周期的元素原子,核电荷数越大,半径越小,故C项错误;D项是同主族元素原子,核电荷数越大,半径越大,故D项错误。
4.已知aAn+、bB(n+1)+、cCn-、dD(n+1)-是具有相同的电子层结构的离子,关于A、B、C、D四种元素的叙述正确的是( )
A.离子半径:A>B>C>D
B.原子序数:b>a>c>d
C.原子半径:D>C>B>A
D.四种元素一定属于短周期元素
解析:选B。由于四种离子具有相同的电子层结构,可以推知四种元素在周期表中的位置关系如图:
……
D
C
A
B
……
原子序数b>a>c>d;具有相同电子层结构的离子,核电荷数越大,离子半径越小;原子半径A>B>D>C;四种元素也可以为长周期元素。
题组三 元素金属性(或非金属性)强弱比较
5.下列事实能说明氯元素原子得电子能力比硫元素原子得电子能力强的是________________。
①HCl的溶解度比H2S大
②HCl的酸性比H2S强
③HCl的稳定性比H2S大
④HCl的还原性比H2S弱
⑤HClO4的酸性比H2SO4强
⑥Cl2与铁反应生成FeCl3,而S与铁反应生成FeS
⑦Cl2能与H2S反应生成S
⑧在周期表中Cl处于S同周期的右侧
⑨还原性:Cl-r(Mg)>r(Al)>r(Si)>r(P)>r(S)>r(Cl)。
(2)同一主族元素原子,电子层数越多,原子半径越大。例如:r(I)>r(Br)>r(Cl)>r(F)。
(3)不同周期、不同主族元素的原子
原子半径可根据同主族与同周期原子半径的比较规律解决。
例如:比较r(K)与r(Mg),可利用同主族r(K)>r(Na),然后利用同周期r(Na)>r(Mg)可得出r(K)>r(Mg)。
2.离子半径的比较
(1)同种元素的粒子,电子数越多,半径越大。
例如:r(Cl-)>r(Cl);r(Fe)>r(Fe2+)>r(Fe3+)。
(2)电子层结构相同的离子,核电荷数越大,半径越小。
例如:r(O2-)>r(F-)>r(Na+)>r(Mg2+)>r(Al3+)。
(3)同主族元素的离子,电子层数越多,半径越大。
例如:r(K+)>r(Na+)>r(Li+);r(S2-)>r(O2-)。
(4)所带电荷、电子层数都不相同的离子,可选一种离子参照比较。
例如:比较r(K+)与r(Mg2+)的大小,可选 r(Na+)作参照:r(K+)>r(Na+),r(Na+)>r(Mg2+),故r(K+)>r(Mg2+)。
考点三 元素“位—构—性”的关系及其应用[学生用书P124]
一、元素“位—构—性”的关系
1.性质与位置的互推
(1)根据元素的性质可以推知元素在周期表中的位置,如同周期主族元素A、B、C的金属性逐渐增强,则可知A、B、C在同周期中按C、B、A的顺序从左向右排列。
(2)根据元素在周期表中的位置关系可以推断元素的性质,如A、B、C三元素在同一主族中从上往下排列,则A、B、C的单质氧化性依次减弱或还原性依次增强。
2.结构与性质的互推
(1)若某主族元素的最外层电子数小于4,则该元素容易失电子;若该元素的最外层电子数大于4,则该元素容易得电子。
(2)若某主族元素容易得电子,则可推知该元素的最外层电子数大于4;若该元素容易失电子,则可推知该元素的最外层电子数小于4。
3.结构与位置的互推
由原子序数确定主族元素位置方法:只要记住了稀有气体元素的原子序数(He—2、Ne—10、Ar—18、Kr—36、Xe—54、Rn—86),就可确定主族元素的位置。
(1)若比相应的稀有气体元素多1或2,则应处在下周期的第ⅠA族或第ⅡA族,如88号元素:88-86=2,则应在第七周期第ⅡA族;
(2)若比相应的稀有气体元素少1~5时,则应处在同周期的ⅢA族~ⅦA族,如84号元素应在第六周期第ⅥA族。
二、元素“位—构—性”的应用
1.寻找新材料
2.预测元素的性质
(1)比较不同周期、不同主族元素的性质,如金属性Mg>Al、Ca>Mg,则由碱性:Mg(OH)2>Al(OH)3、Ca(OH)2>Mg(OH)2,得碱性:Ca(OH)2>Al(OH)3。
(2)推测未知元素的某些性质
①已知Ca(OH)2微溶,Mg(OH)2难溶,可推知 Be(OH)2难溶。
②根据卤族元素的性质递变规律,可推知不常见元素砹(At)应为黑色固体,与氢难化合,HAt不稳定,水溶液呈酸性,AgAt难溶于水。
1.判断正误(正确的打“√”,错误的打“×”)
(1)元素所在的主族序数与最外层电子数相等的元素都是金属元素。( )
(2)俄罗斯专家首次合成了一个X原子,该元素位于元素周期表中第七周期ⅥA族。( )
(3)○ +30 位于第四周期第ⅡB族。( )
(4)原子及离子的核外电子层数等于该元素所在的周期数。( )
(5)原子最外层电子数大于3(小于8)的元素一定是非金属元素。( )
(6)某元素的离子的最外层与次外层电子数相同,该元素一定位于第三周期。( )
(7)根据主族元素最高正化合价与族序数的关系,推出卤族元素最高正化合价都是+7价。( )
答案:(1)× (2)√ (3)√ (4)× (5)× (6)× (7)×
2.几种短周期元素的原子半径及主要化合价如表所示:
元素代号
X
Y
Z
R
T
原子半径(nm)
0.160
0.080
0.102
0.143
0.074
主要化合价
+2
+2
-2,+4,+6
+3
-2
根据表中信息,判断以下说法正确的是( )
A.单质与稀硫酸反应的速率快慢:R>Y >X
B.离子半径:T2->X2+
C.元素最高价氧化物对应水化物的碱性:Y >R >X
D.单质与氢气化合的难易程度:Z >T
解析:选B。由主要化合价数据知Z为S,T为O,R为Al,再根据原子半径数据,X和Y位于同主族,Y为Be,X为Mg。镁、铍、铝与稀硫酸反应(接触面积相同)时,镁的反应速率最快,A选项错误;O2-与Mg2+都是10电子粒子,O2-的半径较大,B选项正确;碱性:Mg(OH)2>Be(OH)2,Mg(OH)2>Al(OH)3,氢氧化镁的碱性最强,C选项错误;氧的非金属性比硫的强,O2与H2化合比S与H2化合容易,D选项错误。
名师点拨
“序、层”“序、价”规律
(1)“序、层”规律
①若一种阳离子与一种阴离子电子层数相同,则“阴前阳后”,即阴离子在前一周期,阳离子在后一周期,阳离子的原子序数大。
②同周期元素的简单阳离子与阴离子相比,阴离子原子序数大。
(2)“序、价”规律
在短周期元素中,元素的原子序数与其主要化合价的数值在奇偶性上一般一致,“价奇序奇,价偶序偶”。
(2015·高考天津卷)随原子序数递增,八种短周期元素(用字母x等表示)原子半径的相对大小、最高正价或最低负价的变化如下图所示。
根据判断出的元素回答问题:
(1)f在周期表中的位置是________________________________________________________________________。
(2)比较d、e常见离子的半径大小(用化学式表示,下同):________>________;比较g、h的最高价氧化物对应水化物的酸性强弱:____________________。
(3)任选上述元素组成一种四原子共价化合物,写出其电子式:____________。
(4)已知1 mol e的单质在足量d2中燃烧,恢复至室温,放出255.5 kJ热量,写出该反应的热化学方程式:________________________________________________________________________
________________________________________________________________________。
(5)上述元素可组成盐R:zx4f(gd4)2。向盛有10 mL 1 mol·L-1 R 溶液的烧杯中滴加1 mol·L
-1 NaOH溶液,沉淀物质的量随NaOH溶液体积的变化示意图如下:
①R溶液中,离子浓度由大到小的顺序是________________________________________________________________________。
②写出m点反应的离子方程式:________________________________________________________________________。
③若在R溶液中改加20 mL 1.2 mol·L-1 Ba(OH)2溶液,充分反应后,溶液中产生沉淀的物质的量为________mol。
[解析] 根据图中八种短周期元素原子半径的相对大小及最高正价或最低负价的变化,判断出x是H,y是C,z是N,d是O,e是Na,f是Al,g是S,h是Cl。
(1)f是Al,在元素周期表中位于第三周期ⅢA族。
(2)O2-和Na+的核外电子排布相同,核电荷数越大,半径越小,故r(O2-)>r(Na+);元素的非金属性越强,最高价氧化物对应水化物的酸性越强,非金属性:Cl>S,故酸性:HClO4>H2SO4。
(3)八种短周期元素组成的四原子共价化合物有NH3、H2O2、C2H2 等,它们的电子式分别为H∶ ∶H、H∶ ∶ ∶H、H∶C⋮⋮C∶H等。
(4)1 mol Na在O2中完全燃烧生成Na2O2放出热量为255.5 kJ,则该反应的热化学方程式为2Na(s)+O2(g)===Na2O2(s) ΔH=-511 kJ·mol-1。
(5)盐R的化学式为NH4Al(SO4)2。①因为Al(OH)3的碱性比NH3·H2O的碱性弱,故Al3+的水解程度大于NH4的水解程度,溶液呈酸性,离子浓度大小顺序为 c(SO4)>c(NH4)>c(Al3+)>c(H+)>c(OH-)。②向NH4Al(SO4)2 溶液中加入NaOH溶液,由图像分析,先发生Al3++3OH-===Al(OH)3↓,之后是NH4+OH-===NH3·H2O,最后是沉淀的溶解:Al(OH)3+OH-===AlO2+2H2O,故m点的离子反应为NH4+OH-===NH3·H2O。③因NH4Al(SO4)2的物质的量为0.01 L×1 mol·L-1=0.01 mol,Ba(OH)2的物质的量为0.02 L×1.2 mol·L-1=0.024 mol,产生沉淀的反应有两类,一是SO4+Ba2+===BaSO4↓,n(SO4)=0.01 mol×2=0.02 mol,0.02 mol<0.024 mol,故 n(BaSO4)=0.02 mol;二是OH-参与的反应,
Al3+ + 3OH- === Al(OH)3↓
0.01 mol 0.03 mol 0.01 mol
OH-剩余0.024 mol×2-0.03 mol=0.018 mol,之后发生反应:NH4+OH-===NH3·H2O,n(NH4)=0.01 mol,再消耗OH-0.01 mol,则剩余OH-为0.018 mol-0.01 mol=0.008 mol,最后发生沉淀的溶解:Al(OH)3+OH-===AlO2+2H2O,OH-为0.008 mol,溶解Al(OH)3为0.008 mol,则剩余Al(OH)3为0.01 mol-0.008 mol=0.002 mol。溶液中产生沉淀的物质的量为0.02 mol+0.002 mol=0.022 mol。
[答案] (1)第三周期ⅢA族 (2)r(O2-) r(Na+) HClO4>H2SO4
(3)H H(或H H、H∶C⋮⋮C∶H等其他合理答案均可)
(4)2Na(s)+O2(g)===Na2O2(s) ΔH=-511 kJ·mol-1
(5)①c(SO4)>c(NH4)>c(Al3+)>c(H+)>c(OH-)
②NH4+OH-===NH3·H2O
③0.022
若例3图中x元素化合价不变,但半径大于y,则x是哪种元素?此时任选上述元素组成三原子共价化合物可能的化学式有哪些?
答案:x为锂元素;上述元素组成的三原子共价化合物可能有CO2、CS2、SO2、NO2、N2O、Cl2
O等。
元素“位-构-性”之间的关系
题组 元素“位—构—性”的综合应用
1.元素的原子结构决定其性质和在周期表中的位置。下列说法正确的是( )
A.元素原子的最外层电子数等于元素的最高化合价
B.多电子原子中,在离核较近的区域内运动的电子能量较高
C.P、S、Cl得电子能力和最高价氧化物对应水化物的酸性均依次增强
D.元素周期表中位于金属和非金属分界线附近的元素属于过渡元素
解析:选C。A项,对于主族元素来说,元素原子的最外层电子数等于元素的最高化合价(O、F除外),故A错误;B项,在离核较近的区域内运动的电子能量较低,故B错误;C项,非金属性:P乙>丙
D.甲与乙形成的化合物均有强氧化性
解析:选D。由题意可得,甲为O,乙为Na,丙为Al,丁为S。铝单质可以用来冶炼金属,比如铝热反应,A正确;SO3为非极性分子,B正确;简单离子半径:S2->Na+>Al3+,C正确;Na2O没有强氧化性,D错误。
1.牢记1~6周期的元素种类数:2、8、8、18、18、32。
2.熟记周期表中各族的排列顺序:ⅠA、ⅡA、ⅢB、ⅣB、ⅤB、ⅥB、ⅦB、Ⅷ、ⅠB、ⅡB、ⅢA、ⅣA、ⅤA、ⅥA、ⅦA、0。
3.掌握原子的4个关系式
(1)质子数=原子序数;
(2)电子层数=周期序数;
(3)最外层电子数=主族序数;
(4)最低负价=主族序数-8。
4.理解元素性质的2个递变规律
一、选择题
1.(2015·高考海南卷)下列离子中半径最大的是( )
A.Na+ B.Mg2+
C.O2- D.F-
解析:选C。这些离子核外电子排布都是2、8的电子层结构。对于电子层结构相同的离子来说,核电荷数越大,离子半径就越小,所以四个选项中离子半径最大的是O2-。
2.元素周期表有许多有趣的编排方式,有同学将短周期元素按照原子序数递增的顺序进行排列得到如图所示的“蜗牛”元素周期表。图中每个“·”代表一种元素(图中字母不表示元素符号)。下列说法正确的是( )
A.L、M、X三元素位于同一主族
B.K、Z两元素的氢化物的水溶液都显酸性
C.Y元素的得电子能力较K元素弱
D.K、L、X、Z四种元素离子半径大小顺序是Z->L+>X3+>K3-
解析:选C。L、M、X分别为Na、Mg、Al,位于同一周期,而不是同一主族,A项错误;K、Z分别为N、Cl,N的氢化物为NH3,其水溶液显碱性,B项错误;Y为P,N元素的得电子能力较P元素强,C项正确;N、Na、Al、Cl元素形成的简单离子半径大小顺序为Cl->N3->Na+>Al3+,D项错误。
3.(2016·潍坊模拟)下列根据元素周期表和元素周期律得出的推断中正确的是( )
A.金属元素原子最外层电子数越少,该金属失电子能力越强
B.若存在简单阴离子R2-,则R一定位于ⅥA族
C.aA2+、bB+、cC3-三种离子具有相同的电子层结构,则原子序数c>a>b
D.铅位于周期表中金属和非金属的交界处,可作半导体材料
解析:选B。A选项,由Na与Ca的活泼性强弱可知错误;C选项,原子序数a>b>c,错误;D选项,铅是金属,属于导体,错误。
4.
A、B、C均为短周期元素,它们在周期表中的位置如图所示。已知:B、C两元素原子最外层电子数之和等于A元素原子最外层电子数的2倍;B、C两元素的核电荷数之和是A元素原子序数的4倍。则A、B、C分别是( )
A.O、P、Cl B.N、Si、S
C.C、Al、P D.F、S、Ar
解析:选A。设A、B、C三元素原子序数分别为a、b、c,由三元素相对位置可知a+8-1=b,a+8+1=c且b-10+c-10=(a-2)×2;又知b+c=4a,所以a=8,b=15,c
=17,即A、B、C分别是O、P、Cl。
5.(2016·赤峰一中模拟)下列说法正确的是( )
A.SiH4比CH4稳定
B.O2-半径比F-小
C.Na和Cs属于第ⅠA族元素,Cs失电子能力比Na强
D.P和As属于第ⅤA族元素,H3PO4酸性比H3AsO4弱
解析:选C。非金属性越强,其气态氢化物越稳定,最高价氧化物对应水化物的酸性越强,C的非金属性强于Si,P的非金属性强于As,因此CH4的稳定性大于SiH4,H3PO4的酸性强于H3AsO4,故A、D项均错误。O2-和F-的电子层结构相同,由于O原子比F原子核电荷数少,故半径:O2->F-,B项错误。同主族元素从上到下,原子失电子能力增强,C项正确。
6.X、Y、Z是周期表中相邻的三种短周期元素,X和Y同周期,Y和Z同主族,三种元素原子的最外层电子数之和为17,核内质子数之和为31,则X、Y、Z是( )
A.Mg、Al、Si B.Li、Be、Mg
C.N、O、S D.P、S、O
解析:选C。A项中Mg、Al同周期,但Al、Si不同主族,故错误。B中三者最外层电子数之和为5,不等于17,故错误。D项三者质子数之和为15+16+8=39,不等于31,故错误。
7.(2016·洛阳质检)应用元素周期律分析下列正确的组合是( )
①铊(Tl)与铝同主族,其单质既能与盐酸反应,又能与氢氧化钠溶液反应 ②气态氢化物的稳定性HF大于HCl ③硒(Se)位于元素周期表第ⅥA族,其最高价氧化物对应水化物的酸性比硫酸弱 ④第二周期非金属元素的气态氢化物溶于水后,水溶液均为酸性
A.①③ B.②④
C.①④ D.②③
解析:选D。在元素周期表中,铊位于铝的下面,其金属性比铝的金属性强,不与碱反应,①错误;由NH3溶于水显碱性可知④错误。
8.根据表中有关短周期元素性质的数据,判断下列说法中正确的是( )
元素代号
①
②
③
④
⑤
⑥
⑦
⑧
原子半径
0.74
1.60
1.52
1.10
0.99
1.86
0.75
0.82
最高或最
低化合价
+2
+1
+5
+7
+1
+5
+3
-2
-3
-1
-3
A.元素②与元素③处于同一周期
B.元素④的原子序数小于元素⑦的原子序数
C.元素⑧的还原性比元素⑥的强
D.元素⑤的最高价氧化物对应水化物的酸性最强
解析:选D。①只有-2价,故其为O。由⑤的最高正价为+7 价知其为Cl。④⑦的最高正价都为+5价,且④的原子半径大于⑦的,故知④为P,⑦为N;同理可知③⑥分别为Li、Na。②的原子半径比③的大,比⑥的小,可知其为Mg。⑧的原子半径比⑦的大,比④的小,可知其为B。然后根据元素性质递变规律可知答案。
二、非选择题
9.元素周期表中前七周期的元素种类数如下表所示:
周期序数
一
二
三
四
五
六
七
元素种类数
2
8
8
18
18
32
32
(1)第六、七周期比第四、五周期多了14种元素,其原因是__________________________________________________。
(2)周期表中________族所含元素种类最多。
(3)请分析周期序数与元素种类数的关系,然后预言第八周期最多可能含有的元素种类数为________(填字母,下同)。
A.18 B.32
C.50 D.64
(4)据国外有关资料报道,在独居石(一种共生矿,化学成分为Ce、La、Nb……的碳酸盐)中,查明有尚未命名的116、124、126号元素。试推断其中116号元素应位于元素周期表中的________。
A.第六周期ⅣA族 B.第七周期ⅥA族
C.第七周期Ⅷ族 D.第八周期ⅥA族
解析:(3)根据题意可通过分析已知数据归纳出潜在的规律:
周期
序数
一
二
三
四
五
六
七
元素
种类数
2
2×12
8
2×22
8
2×22
18
2×32
18
2×32
32
2×42
32
2×42
可见,规律是2n2(n=1、2、3……),由此预测第八周期元素种类数应为2×52=50种,答案为C。
(4)116-86-14=16,则为第七周期ⅥA 族。
答案:(1)第六、七周期在ⅢB族出现了镧系、锕系
(2)ⅢB (3)C (4)B
10.下列曲线分别表示元素的某种性质与核电荷数的关系(Z为核电荷数,Y为元素的有关性质)。把与下面元素有关的性质相符的曲线标号填入相应的空格中:
(1)第ⅡA族元素的最外层电子数________。
(2)第三周期元素的最高化合价________。
(3)F-、Na+、Mg2+、Al3+的离子半径大小顺序________。
解析:根据同主族元素最外层电子数相等,同周期元素最高化合价从左向右逐渐增大,核外电子排布相同的简单离子,核电荷数越大,半径越小,结合具体的图像就可以解答。
答案:(1)b (2)c (3)a
11.(2016·安徽师大附中模拟)X~W是元素周期表中的短周期元素,其性质或结构信息如下表:
元素
性质或结构信息
X
单质为有色气体,有毒,可用于自来水消毒
Y
日常生活中常见金属,熔化时并不滴落,好像有一层膜兜着
Z
其单质的体积在空气中约占4/5左右
V
单质为淡黄色晶体,质脆,不溶于水,微溶于酒精
W
位于第 ⅣA族,是形成化合物最多的元素之一
回答下列问题:
(1)X在元素周期表中的位置是________________________________________________________________________,
V2-的离子结构示意图为__________________。
(2)Z的单质特别稳定,原因在于________________________________________________________________________
________________________________________________________________________;
X、Y和V三元素中原子半径最小的是________(填元素符号)。
(3)X的氢化物和Z的氢化物反应生成的化合物溶于水,水溶液呈酸性的原因是________________________________________________________________________
(用离子方程式说明)。
(4)WV2常温下呈液态,是一种常见的溶剂。已知WV2在氧气中完全燃烧,生成VO2和WO2,若0.1 mol WV2在1 mol O2中完全燃烧,则所得气体混合物在标准状况下的体积为________L。
解析:短周期的元素X的单质为有色气体,可用于自来水消毒,则X为Cl;铝箔加热至熔化并不滴落,原因是表面形成高熔点的氧化膜兜着,Y为Al;单质Z在空气中体积约占4/5左右,则Z为N;V的单质为淡黄色晶体,不溶于水,微溶于酒精,V为S;W位于第ⅣA族,是形成化合物最多的元素之一,W为C。
答案:(1)第三周期第ⅦA族
(2)氮气分子中氮氮键为氮氮三键,难断裂 Cl
(3)NH+H2ONH3·H2O+H+
(4)22.4
12.某同学为探究元素周期表中元素性质的递变规律,设计了如下实验:
(1)将钠、钾、镁、铝各1 mol分别投入足量的同浓度的盐酸中,试预测实验结果:________与盐酸反应最剧烈,________________________________________________________________________
与盐酸反应最缓慢;________与盐酸反应产生的气体最多。
(2)向Na2S溶液中通入氯气出现黄色浑浊,可证明Cl的非金属性比S强,反应的离子方程式为___________________________________________________。
(3)利用下图装置可验证同主族元素非金属性的变化规律。
①若要证明非金属性:Cl>I,则A中加浓盐酸,B中加KMnO4,C中加淀粉碘化钾混合溶液,观察到C中溶液的现象为__________________,即可证明。从环境保护的角度考虑,此装置缺少尾气处理装置,可用__________溶液吸收尾气。
②若要证明非金属性:C>Si,则在A中加盐酸,B中加 CaCO3,C中加Na2SiO3溶液,观察到C中的现象为 ______________________,即可证明。但有的同学认为盐酸具有挥发性,可进入C中干扰实验,应在两装置间添加装有______________溶液的洗气瓶。
解析:(1)钠、钾同主族,钾的金属性强;钠、镁、铝同周期,金属性依次减弱。金属性由强到弱的顺序为钾>钠>镁>铝,故钾与盐酸反应最剧烈,铝与盐酸反应最缓慢。根据电子得失守恒,失去的电子数越多,与盐酸反应生成的氢气越多。(2)氯气和Na2S溶液反应生成NaCl和单质硫。(3)①本实验利用KMnO4与浓盐酸反应制备氯气,然后使氯气与淀粉碘化钾混合溶液反应,根据溶液颜色的变化来比较氯和碘非金属性的强弱。过量的氯气会逸散到空气中,污染环境,应用碱液(如NaOH)吸收。②利用强酸制弱酸的原理比较硅和碳的非金属性强弱,制得的二氧化碳中若有杂质氯化氢存在,则不能说明是二氧化碳与Na2SiO3溶液反应生成白色沉淀,故应先用饱和NaHCO3溶液除去氯化氢。
答案:(1)钾 铝 铝
(2)Cl2+S2-===S↓+2Cl-
(3)①由无色变蓝 NaOH ②有白色沉淀生成 饱和NaHCO3