- 2021-04-28 发布 |
- 37.5 KB |
- 7页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2020届高考化学二轮复习化学反应中的热量变化学案
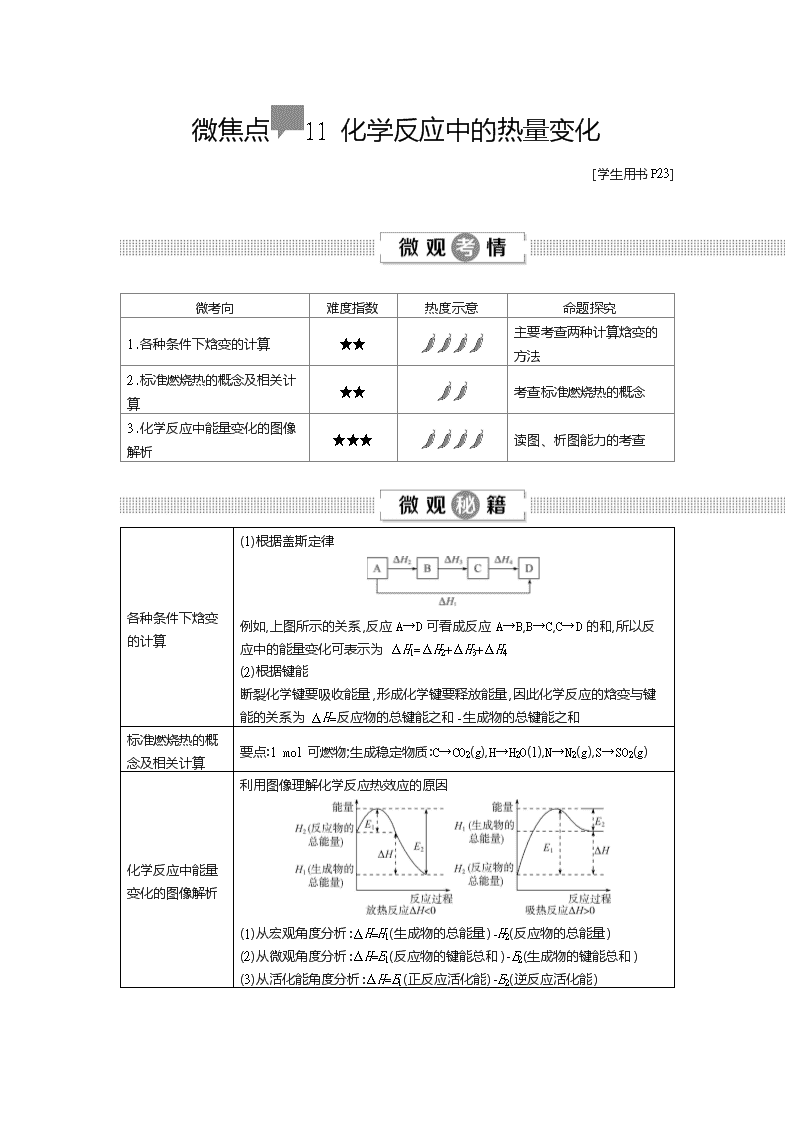
微焦点11 化学反应中的热量变化 [学生用书P23] 微考向 难度指数 热度示意 命题探究 1.各种条件下焓变的计算 ★★ 主要考查两种计算焓变的方法 2.标准燃烧热的概念及相关计算 ★★ 考查标准燃烧热的概念 3.化学反应中能量变化的图像解析 ★★★ 读图、析图能力的考查 各种条件下焓变的计算 (1)根据盖斯定律 例如,上图所示的关系,反应A→D可看成反应A→B,B→C,C→D的和,所以反应中的能量变化可表示为ΔH1=ΔH2+ΔH3+ΔH4 (2)根据键能 断裂化学键要吸收能量,形成化学键要释放能量,因此化学反应的焓变与键能的关系为ΔH=反应物的总键能之和-生成物的总键能之和 标准燃烧热的概念及相关计算 要点:1 mol可燃物;生成稳定物质:C→CO2(g),H→H2O(l),N→N2(g),S→SO2(g) 化学反应中能量变化的图像解析 利用图像理解化学反应热效应的原因 (1)从宏观角度分析:ΔH=H1(生成物的总能量)-H2(反应物的总能量) (2)从微观角度分析:ΔH=E1(反应物的键能总和)-E2(生成物的键能总和) (3)从活化能角度分析:ΔH=E1(正反应活化能)-E2(逆反应活化能) 各种条件下焓变的计算 [典例导考1](2018·全国Ⅱ卷)CH4-CO2催化重整不仅可以得到合成气(CO和H2),还对温室气体的减排具有重要意义。回答下列问题: (1)CH4-CO2催化重整反应为CH4(g)+CO2(g) 2CO(g)+2H2(g)。 已知:C(s)+2H2(g)CH4(g) ΔH=-75 kJ· mol-1 C(s)+O2(g)CO2(g) ΔH=-394 kJ· mol-1 C(s)+12O2(g)CO(g) ΔH=-111 kJ· mol-1 该催化重整反应的ΔH= kJ· mol-1。 【审】 盖斯定律的应用。 【切】 通过已知ΔH的反应数据运算求解。 【解】 三个反应依次编号为①②③,根据盖斯定律可知③×2-②-①即得到该催化重整反应CH4(g)+CO2(g)2CO(g)+2H2(g)的ΔH=247 kJ· mol-1。 【答】 247 【思】 应用盖斯定律进行简单计算的注意事项: ①参照新的热化学方程式(目标热化学方程式),结合原热化学方程式(一般2~3个)进行合理“变形”,如热化学方程式颠倒、乘或除以某一个数,然后将它们相加、减,得到目标热化学方程式,求出目标热化学方程式的ΔH与原热化学方程式之间ΔH的换算关系。 ②当热化学方程式乘、除以某一个数时,ΔH也相应地乘、除以某一个数;热化学方程式进行加减运算时,ΔH也同样要进行加减运算,且要带“+”“-”符号,即把ΔH看作一个整体进行运算。 ③运用盖斯定律的关键在于分析总反应可由哪些中间过程构成,化简要细心,计算时ΔH(带“+”“-”)也要参与运算。 [应用提能1-1]NF3是一种温室气体,其存储能量的能力是CO2的12 000~20 000倍,在大气中的寿命可长达740年,如表所示是几种化学键的键能: 化学键 N≡N F—F N—F 键能/(kJ/mol) 946 154.8 283.0 下列说法中正确的是( ) A.过程N2(g)→2N(g)放出能量 B.N2比NF3稳定 C.反应N2(g)+3F2(g)2NF3(g)的ΔH>0 D.NF3吸收能量后如果没有化学键的断裂与生成,仍可能发生化学反应 【答案】 B 【微探究】 N2(g)→2N(g)为化学键的断裂过程,应吸收能量,A项错误;N≡N键键能大于N—F键键能,破坏N≡N键所需的能量大,分子稳定性强,B项正确;反应N2(g)+3F2(g)2NF3(g) ΔH=(946+3×154.8-283.0×6) kJ/mol=-287.6 kJ/mol,ΔH<0,为放热反应,C项错误;NF3吸收能量后如果没有化学键的断裂与生成,无化学反应的发生,D项错误。 [应用提能1-2]联氨(N2H4)常温下为无色液体,可用作火箭燃料。下列说法不正确的是( ) ①2O2(g)+N2(g)N2O4(l) ΔH1 ②N2(g)+2H2(g)N2H4(l) ΔH2 ③O2(g)+2H2(g)2H2O(g) ΔH3 ④2N2H4(l)+N2O4(l)3N2(g)+4H2O(g) ΔH4=-1 048.9 kJ· mol-1 A.O2(g)+2H2(g)2H2O(l) ΔH5,ΔH5>ΔH3 B.ΔH4=2ΔH3-2ΔH2-ΔH1 C.1 mol O2(g)和2 mol H2(g)具有的总能量高于2 mol H2O(g)具有的能量 D.联氨和N2O4做火箭推进剂的原因之一是反应放出大量的热 【答案】 A 【微探究】 O2(g)+2H2(g)2H2O(g) ΔH3,O2(g)+2H2(g)2H2O(l) ΔH5,两个反应均为放热反应,ΔH均为负值,放热越多,ΔH越小,由于生成液态水放热更多,所以ΔH5<ΔH3,A项错误;根据盖斯定律,③×2-②×2-①得2N2H4(l)+N2O4(l)3N2(g)+4H2O(g),所以ΔH4=2ΔH3-2ΔH2-ΔH1,B项正确;O2(g)+2H2(g)2H2O(g) ΔH3,该反应为放热反应,反应物的总能量大于生成物的总能量,C项正确;由ΔH4=-1 048.9 kJ· mol-1知,反应放出大量的热,所以可以用联氨和N2O4做火箭推进剂,D项正确。 标准燃烧热的概念及相关计算 [典例导考2](2019·浙江十二名校联考)下列说法正确的是( ) A.在25 ℃、101 kPa下,1 mol C与适量O2反应生成 1 mol CO 时,放出110.5 kJ热量,则C的标准燃烧热为110.5 kJ· mol-1 B.在25 ℃、101 kPa下,1 mol H2完全燃烧生成液态水放出285.8 kJ热量,则H2的标准燃烧热为-285.8 kJ· mol-1 C.测定HCl和NaOH反应的中和热时,每次实验均应测量3个温度,即盐酸起始温度、NaOH起始温度和反应后最高温度 D.在稀溶液中:H+(aq)+OH-(aq)H2O(l) ΔH=-57.3 kJ· mol-1,若将含0.5 mol H2SO4的浓硫酸与含1 mol NaOH的溶液混合,则放出的热量等于57.3 kJ 【审】 考查对概念的理解。 【切】 标准燃烧热是以1 mol可燃物在氧气中充分燃烧为标准;中和热是以稀溶液中生成1 mol水为标准。 【解】 C的标准燃烧热指1 mol C完全燃烧生成CO2时放出的热量,生成CO时放出的热量不是C的标准燃烧热,A项错误;1 mol H2完全燃烧生成液态水时放出的热量是H2的标准燃烧热,则H2的标准燃烧热为285.8 kJ· mol-1,B项错误;浓硫酸稀释时放热,故含0.5 mol H2SO4的浓硫酸与含1 mol NaOH的溶液混合,放出的热量大于57.3 kJ,D项错误。 【答】 C 【思】 标准燃烧热和中和热应用的注意事项:二者均为放热反应,ΔH<0,单位为kJ· mol-1。 [应用提能2]下列有关热化学方程式及其叙述正确的是( ) A.氢气的标准燃烧热为285.5 kJ/mol,则水电解的热化学方程式为2H2O(l)2H2(g)+O2(g) ΔH=285.5 kJ/mol B.1 mol甲烷完全燃烧生成CO2和H2O(l)时放出890 kJ热量,它的热化学方程式为1/2CH4(g)+O2(g)1/2CO2(g)+H2O(l) ΔH=-445 kJ/mol C.已知2C(s)+O2(g)2CO(g) ΔH=-221 kJ· mol-1,则C(s)的标准燃烧热为110.5 kJ/mol D.HF与NaOH 溶液反应:H+(aq)+OH-(aq)H2O(l) ΔH=-57.3 kJ/mol 【答案】 B 【微探究】 根据标准燃烧热的定义,水电解的热化学方程式为2H2O(l)2H2(g)+O2(g) ΔH=571 kJ· mol-1,A项错误;1 mol甲烷完全燃烧放出的热量为890 kJ,则0.5 mol CH4燃烧放出的热量为890×0.5 kJ=445 kJ,热化学方程式为1/2CH4(g)+O2(g)1/2CO2(g)+H2O(l) ΔH=- 445 kJ/mol,B项正确;C(s)燃烧生成的稳定氧化物为CO2,C(s)的标准燃烧热的绝对值大于110.5 kJ/mol,C项错误;HF为弱酸,与NaOH反应生成1 mol H2O时放出的热量小于57.3 kJ,且HF应写化学式,D项错误。 化学反应中能量变化的图像解析 [典例导考3](2019·湖南衡阳市八中高三第四次月考)一定条件下,在水溶液中1 mol Cl-、ClOx-(x=1,2,3,4)的能量相对大小如图所示,下列有关说法正确的是( ) A.a、b、c、d、e 中,c 最稳定 B.一定温度下,Cl2与 NaOH 溶液反应生成的产物有 a、b、d,溶液中 a、b、d 的浓度之比可能为 11∶1∶2 C.b→a+c 反应的活化能为反应物的总能量减去生成物的总能量 D.b→a+d 反应的热化学方程式为3ClO- (aq)ClO3- (aq)+2Cl- (aq) ΔH=116 kJ· mol-1 【审】 化学反应中能量变化的图像分析。 【切】 ΔH=生成物的总能量-反应物的总能量。 【解】 根据氯元素的化合价,a、b、c、d、e依次代表Cl-、ClO-、ClO2-、ClO3-、ClO4-,据此答题。a、b、c、d、e中a能量最低,所以a最稳定,A项错误;氧化还原反应遵循得失电子守恒,Cl2与NaOH溶液反应生成的产物有a(Cl-)、b(ClO-)、d(ClO3-),氯元素的化合价由0价分别降为-1价,升为+1价和+5价,由得失电子守恒得:n(Cl-)=n(ClO-)+5n(ClO3-),当溶液中a、b、d的浓度之比为11∶1∶2,上述得失电子守恒式成立,B项正确;反应物的总能量-生成物的总能量=-ΔH,依据图中数据无法判断b→a+c反应的活化能,C项错误;b→a+d,根据得失电子守恒得该反应方程式为 3ClO-ClO3-+2Cl-,反应热=(64 kJ·mol-1+2×0 kJ·mol-1)-3×60 kJ·mol-1=-116 kJ·mol-1,所以该热化学方程式为3ClO-(aq)ClO3-(aq)+2Cl-(aq) ΔH=-116 kJ·mol-1,D项错误。 【答】 B 【思】 一般情况下,物质的能量越低越稳定;物质中所含化学键键能越大越稳定。 [应用提能3-1] 下列图像分别表示有关反应的反应过程与能量变化的关系。 据此判断下列说法中正确的是( ) A.由图1知,石墨转变为金刚石是吸热反应 B.由图2知,S(g)+O2(g)SO2(g) ΔH1,S(s)+O2(g)SO2(g) ΔH2,则ΔH1>ΔH2 C.由图3知,白磷比红磷稳定 D.由图4知,CO(g)+H2O(g)CO2(g)+H2(g) ΔH>0 【答案】 A 【微探究】 金刚石的能量高于石墨,所以石墨转变为金刚石是吸热反应,A项正确;固态S的能量低于气态S的能量,所以气态S燃烧放出的热量多,但放热越多,ΔH越小,B项错误;白磷的能量高于红磷的能量,所以红磷比白磷稳定,C项错误;由图4可知,CO(g)和H2O(g)的总能量高于CO2(g)和H2(g)的总能量,所以D项反应为放热反应,ΔH<0,D项错误。 [应用提能3-2]某反应过程能量变化如图所示,下列说法正确的是( ) A.反应过程a有催化剂参与 B.该反应为放热反应,热效应等于ΔH C.改变催化剂,不能改变该反应的活化能 D.有催化剂的条件下,反应的活化能等于E1+E2 【答案】 B 【微探究】 由图可知,反应过程a需要的活化能比b高,所以a没有催化剂参与,A项错误;由图可知,该反应中,反应物的总能量大于生成物的总能量,所以该反应属于放热反应,反应的热效应等于生成物与反应物的能量之差,即ΔH,B项正确;改变催化剂,改变了反应进行的途径,能改变反应的活化能,C项错误;有催化剂的条件下,反应的活化能为E1,D项错误。查看更多