- 2021-04-28 发布 |
- 37.5 KB |
- 11页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2018-2019学年内蒙古第一机械制造(集团)有限公司第一中学高二上学期期中考试化学试题(Word版)
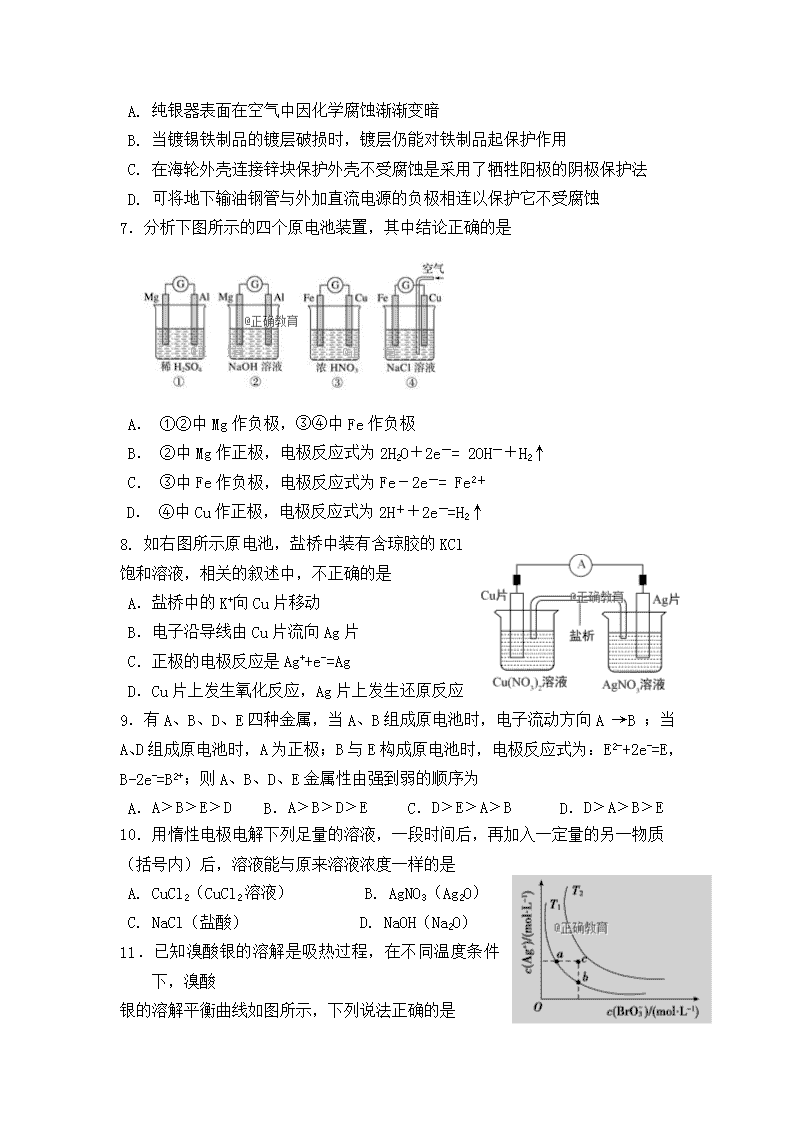
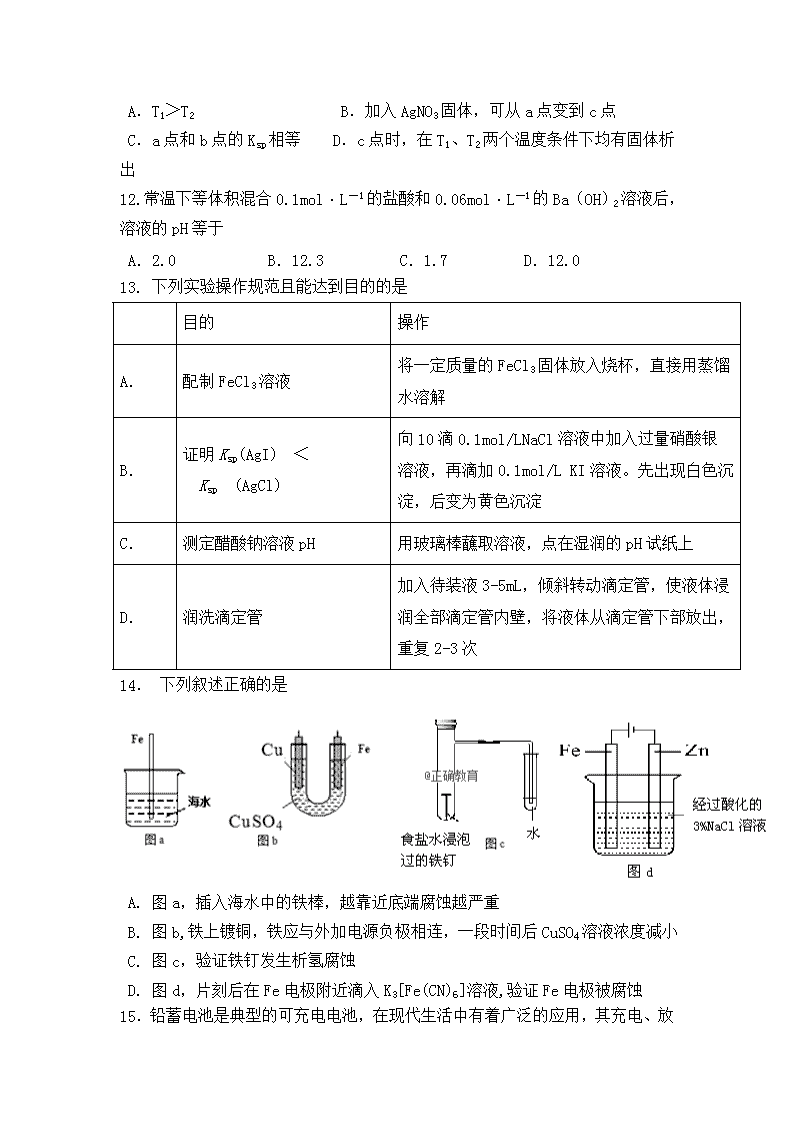
2018-2019学年内蒙古第一机械制造(集团)有限公司第一中学高二上学期期中考试化学试题 可能用到的元素相对原子质量:H — 1 O — 16 C —12 Cu —64 Ag —108 一、选择题:(每小题2分,共50分.每小题只有一个选项符合题意) 1.下列叙述不正确的是 A. 明矾能水解生成Al(OH)3胶体,可用作净水剂 B. 除去MgCl2酸性溶液中的Fe3+,可加入MgO固体 C. 手机上用的锂离子电池属于一次电池 D. Zn具有还原性和导电性,可用作锌锰干电池的负极材料 2.下列水解离子方程式正确的是 A. CH3COO-+ H2OCH3COOH+OH- B. HCO3-+H2OH3O++CO32- C. CO32-+2H2OH2CO3+2OH- D. Fe3++3H2OFe(OH)3↓+3H+ 3.下列水溶液可以确定显酸性的是 A. 含氢离子的溶液 B. 能使酚酞显无色的溶液 C. pH<7 的溶液 D. c(H+)>c(OH-)的溶液 4.下列各组离子在相应的条件下一定能大量共存的是 A.能使pH试纸变红的溶液中:SO32-、S2-、K+、Na+ B.由水电离产生的c(OH-)=1×10-10 mol·L-1的溶液中:Mg2+、Na+、Br-、ClO- C.在c(OH-)/c(H+)=1×10-10的溶液中:NH、Ca2+、Cl-、NO D. 含有大量Fe3+的溶液:CO、I-、K+、Br- 5.下列事实能说明醋酸是弱电解质的是 ①醋酸与水能以任意比互溶; ②醋酸溶液能导电; ③醋酸稀溶液中存在醋酸分子; ④常温下,0.1 mol/L醋酸的pH比0.1 mol/L盐酸的pH大; ⑤醋酸能和碳酸钙反应放出CO2; ⑥0.1 mol/L醋酸钠溶液pH=8.9; ⑦大小相同的铁片与同物质的量浓度的盐酸和醋酸反应,醋酸产生H2速率慢 ⑧pH=a的溶液的物质的量浓度等于pH=a+1的溶液的物质的量浓度的10倍 A.②⑥⑦⑧ B.③④⑥⑦ C.③④⑥⑧ D.①② 6.下列有关金属腐蚀与防护的说法不正确的是 A. 纯银器表面在空气中因化学腐蚀渐渐变暗 B. 当镀锡铁制品的镀层破损时,镀层仍能对铁制品起保护作用 C. 在海轮外壳连接锌块保护外壳不受腐蚀是采用了牺牲阳极的阴极保护法 D. 可将地下输油钢管与外加直流电源的负极相连以保护它不受腐蚀 7.分析下图所示的四个原电池装置,其中结论正确的是 A. ①②中Mg作负极,③④中Fe作负极 B. ②中Mg作正极,电极反应式为2H2O+2e-= 2OH-+H2↑ C. ③中Fe作负极,电极反应式为Fe-2e-= Fe2+ D. ④中Cu作正极,电极反应式为2H++2e-=H2↑ 8. 如右图所示原电池,盐桥中装有含琼胶的KCl饱和溶液,相关的叙述中,不正确的是 A.盐桥中的K+向Cu片移动 B.电子沿导线由Cu片流向Ag片 C.正极的电极反应是Ag++e-=Ag D.Cu片上发生氧化反应,Ag片上发生还原反应 9.有A、B、D、E四种金属,当A、B组成原电池时,电子流动方向A →B ;当A、D组成原电池时,A为正极;B与E构成原电池时,电极反应式为:E2-+2e-=E,B-2e-=B2+;则A、B、D、E金属性由强到弱的顺序为 A.A﹥B﹥E﹥D B.A﹥B﹥D﹥E C.D﹥E﹥A﹥B D.D﹥A﹥B﹥E 10.用惰性电极电解下列足量的溶液,一段时间后,再加入一定量的另一物质(括号内)后,溶液能与原来溶液浓度一样的是 A. CuCl2(CuCl2溶液) B. AgNO3(Ag2O) C. NaCl(盐酸) D. NaOH(Na2O) 11.已知溴酸银的溶解是吸热过程,在不同温度条件下,溴酸 银的溶解平衡曲线如图所示,下列说法正确的是 A.T1>T2 B.加入AgNO3固体,可从a点变到c点 C.a点和b点的Ksp相等 D.c点时,在T1、T2两个温度条件下均有固体析出 12.常温下等体积混合0. 1mol·L-1的盐酸和0.06 mol·L-1的Ba(OH)2溶液后,溶液的pH等于 A.2.0 B.12.3 C.1.7 D.12.0 13. 下列实验操作规范且能达到目的的是 目的 操作 A. 配制FeCl3溶液 将一定质量的FeCl3固体放入烧杯,直接用蒸馏水溶解 B. 证明Ksp(AgI) < Ksp (AgCl) 向10滴0.1mol/LNaCl溶液中加入过量硝酸银溶液,再滴加0.1mol/L KI溶液。先出现白色沉淀,后变为黄色沉淀 C. 测定醋酸钠溶液pH 用玻璃棒蘸取溶液,点在湿润的pH试纸上 D. 润洗滴定管 加入待装液3-5mL,倾斜转动滴定管,使液体浸润全部滴定管内壁,将液体从滴定管下部放出,重复2-3次 14. 下列叙述正确的是 A. 图a,插入海水中的铁棒,越靠近底端腐蚀越严重 B. 图b,铁上镀铜,铁应与外加电源负极相连,一段时间后CuSO4溶液浓度减小 C. 图c,验证铁钉发生析氢腐蚀 D. 图d,片刻后在Fe电极附近滴入K3[Fe(CN)6]溶液,验证Fe电极被腐蚀 15.铅蓄电池是典型的可充电电 池,在现代生活中有着广泛的应用,其充电、放电按下式进行:Pb + PbO2 + 2H2SO4 2PbSO4 + 2H2O,有关该电池的说法正确的是 放电 充电 A.放电时,负极质量减少 B.放电一段时间后,溶液的pH值减小 C.充电时,阳极反应:PbSO4 +2e-=Pb+SO42- D.充电时,铅蓄电池的负极与外接电源的负极相连 16.关于下列各装置图的叙述中,不正确的是 A. 用装置①精炼铜,则a极为粗铜,电解质溶液为CuSO4溶液 B. 装置②的总反应式是Cu+2Fe3+=Cu2++2Fe2+ C. 装置③中钢闸门应与外接电源的负极相连 D. 装置④中的铁钉几乎没被腐蚀 17. 将如图所示实验装置的K闭合,下列判断正确的是 A.片刻后甲池中c(SO42﹣)增大 B.电子沿 Zn→a→b→Cu 路径流动 C.Cu 电极上发生还原反应 D.片刻后可观察到滤纸b点变红色 18.如图为阳离子交换膜法电解饱和食盐水原理示意图。下列说法不正确的是( ) A. 从D口逸出的气体是H2 B. 从B口加入稀NaOH(增强导电性)的水溶液 C. 每生成22.4 L Cl2,同时产生2 mol NaOH D. 从A口加入精制的浓食盐水 19.下图中X、Y分别是直流电源的两极,通电后发现a电极质量增加,b电极处有无色无味气体放出。符合这一情况的是表中的 a b X 溶液 A 锌 石墨 负极 CuSO4 B 石墨 石墨 负极 NaOH C 银 铁 正极 AgNO3 D 铜 石墨 负极 CuCl2 20.镍氢电池放电时的总反应原理为:MH+NiOOH→M+Ni(OH)2 (M 为储氢金属,也可看做氢直接参加反应).下列说法正确的是 A.充电时阴极区电解质溶液 pH 降低 B.在使用过程中此电池要不断补充水 C.放电时 NiOOH 在电极上发生氧化反应 D.充电时阳极反应为:Ni(OH)2﹣e﹣+OH﹣=NiOOH+H2O 21. 有人设计出利用CH4和O2的反应,用铂电极在KOH溶液中构成原电池。电池的总反应类似于CH4在O2中燃烧,则下列说法正确的是 ①每消耗1 mol CH4可以向外电路提供8 mol e- ②负极上CH4失去电子,电极反应式:CH4+10OH--8e-= +7H2O ③负极上是O2获得电子,电极反应式为O2+2H2O+4e- = 4OH- ④电池放电后,溶液pH不断升高 A. ①② B. ①③ C. ①②④ D. ③④ 22.向10.00mL0.01mol·L-1某一元酸HA溶液中逐滴加入0.01mol·L-1NaOH溶液,溶液pH变化曲线如右图所示。下列说法不正确的是 A.HA是弱酸 B.b点表示的溶液中:2c(Na+)=c(A-)+c(HA) C.c点时:V>10.00mL D.b、c、d点表示的溶液中:c(Na+)+c(H+)=c(A-)+c(OH-) 23. 常温下,将一定浓度的盐酸和醋酸加水稀释,溶液的导电能力随溶液体积变化的曲线如图所示。判断下列说法中,正确的是 A.两溶液稀释前的浓度相同 B.a、b、c三点溶液的pH由大到小顺序为a>b>c C.a点的KW值比b点的KW值大 D.a点水电离的c(H+)大于c点水电离的c(H+) 24.下列溶液中有关物质的量浓度关系正确的是 A.常温下,浓度均为0.1mol/L CH3COOH和NaOH溶液等体积混合:c(CH3COOH)+c(CH3COO-)=0.1mol/L B.pH相等的CH3COONa、NaOH和Na2CO3三种溶液: c(NaOH)<c(CH3COONa)<c(Na2CO3) C.物质的量浓度相等的CH3COOH和CH3COONa溶液等体积混合: c(CH3COO-) +2c(OH-) = 2c(H+) + c(CH3COOH) mD.0.1mol·L-1的NaHA溶液,其pH=4:c(HA-)>c(H+)>c(H2A)>c(A2-) 25. 在298K时,已知下列物质的溶度积 CH3COOAg AgCl Ag2CrO4 Ag2S Ksp 2.3×10-3 1.8×10-10 1.12×10-12 6.3×10-50 下列说法正确的是 A. 等体积浓度均为0.02 mol/L的CH3COONa和AgNO3溶液混合能产生沉淀 B. 向浓度均为0.01 mol/L的CrO42-和Cl-混合溶液中慢慢滴入AgNO3溶液时,CrO42-先沉淀 C. 在CH3COOAg悬浊液中加入盐酸发生反应的离子方程式:CH3COOAg+H++C1-=CH3COOH+AgCl D. 上述四种饱和溶液的物质的量浓度:c(CH3COOAg)>c(AgCl)>c(Ag2CrO4)>c(Ag2S) 二、非选择题(共50 分) 26.(6分)按要求填空。 (1)浓度均为0.1 mol/L的①硫酸 ②氢氧化钠③氯化铵四种溶液中由水电离出的H+浓度由大到小的顺序是_________________________(填序号)。 (2)向饱和FeCl3溶液中加入CaCO3粉末,发现碳酸钙逐渐溶解,同时还产生的现象有____________________________________________________。 (3)常温下,用0.01 mol/L HCl溶液完全中和pH=11的下列溶液各100mL,需HCl溶液体积的大小关系是_________________________________________(填序号) ①NaOH ②Ba(OH)2 ③NH3·H2O 27.(12分) (1)氯化铵的水溶液显弱酸性,其原因为___________________(用离子方程式表示), 0.1 mol•L-1的氨水中加入少量的NH4Cl固体,溶液的pH________(填“升高”或“降低”);若加入少量的明矾,溶液中的NH4+的浓度__________(填“增大”或“减小”); (2)25℃,几种酸的电离平衡常数如下表。 化学式 CH3COOH H2CO3 HCN HClO H2SO3 电离常数 1.8×10-5 K1=4.3×10-7 K2=5.6×10-11 5×10-10 3.0×10-8 K1=2×10-2 K2=1×10-7 ①物质的量浓度均为0.1 mol/L的四种溶液: a.CH3COONa b.Na2CO3 c.NaClO d.NaHCO3 pH最大的为__________(用编号填写)。 ②根据上表数据判断,下列离子方程式错误的是__________ A. CO2(过量)+H2O+ClO-=HCO3-+HClO B. SO2(过量)+H2O+ClO-=HSO3-+HClO C. CO2(少量)+H2O+CN-=HCO3-+HCN D. SO2(少量)+H2O+CN-=HSO3-+HCN ③0.10 mol•L-1Na2SO3溶液中离子浓度由大到小的顺序为___________________ ④25℃ 时,NaCN与HCN的混合溶液,若c(CN-)=c(HCN),则溶液中pH=__________(已知lg2=0.3,lg5=0.7) 28. (9分) 某学生用0.1000mol/L KMnO4标准液滴定未知浓度的H2C2O4溶液。(将20.00mL H2C2O4待测液注入锥形瓶,用KMnO4溶液滴定) 回答下列问题: (1)请写出该实验所需使用的玻璃仪器,锥形瓶和___________, 。 (2)高锰酸钾溶液应使用______式(填“酸”或“碱”) 滴定管盛放。 (3)①在滴定过程是否需要指示剂?_________(填“是”或“否”) ②请描述滴定终点时溶液颜色的变化_________________________。 ③若滴定终点时,仰视标准液滴定管的刻线读数,其他操作正确,则测定结果__________(填“偏高”、“偏低”或“无影响”);若最终消耗标准液体积为18.00mL(平均值),则H2C2O4的浓度为_________(结果保留4位有效数字)。 (已知:5H2C2O4+2MnO4-+6H+=2Mn2++10CO2↑+8H2O) 29.(13分) 如图所示三套实验装置,分别回答下列问题。 (1) 装置1为铁的吸氧腐蚀实验。一段时间后,向插入铁钉的玻璃筒内滴入NaOH溶液,即可观察到铁钉附近的溶液有沉淀,表明铁被________(填“氧化”或“还原”); 向插入石墨棒的玻璃筒内滴入酚酞溶液,可观察到石墨棒附近的溶液变红,该电极反应式为_______________________。 (2) 装置2中的石墨是________极(填“正”或“负”),该电极反应式为_______________________________。 (3) 装置3中甲烧杯盛放100 mL 0.2 mol·L-1的NaCl溶液,乙烧杯盛放100 mL 0.5 mol·L-1的CuSO4溶液。反应一段时间后,停止通电。向甲烧杯中滴入几滴酚酞,观察到石墨电极附近首先变红。 ①电源的M端为________极;甲烧杯中铁电极的电极反应式为_________________。 ②乙烧杯中电解反应的离子方程式为_________________________________。 ③停止电解,取出Cu电极,洗涤、干燥、称量,电极增重0.64 g,甲烧杯中产生的气体标准状况下的体积为________mL。 30.(10分)下图是一个化学过程的示意图。 (1)图中甲池是________装置(填“电解池”或“原电池”) (2)写出通入CH3OH的电极的电极反应式: _______________________。 (3)向乙池两电极附近分别滴加适量紫色石蕊试液,附近变红的电极为________极(填“A”或“B”),并写出此电极的电极反应式:______________。 (4) 若丙中电极不变,将其溶液换成NaCl溶液,丙池中总反应的离子方程式:__________。 (5)常温下,当乙池中B(Ag)极的质量增加5.40 g时,乙池的pH是________(若此时乙池中溶液的体积为500 mL); 高二年级期中考试化学试题答案 选择题:(每小题2分,共50分) 1-5 CADCB 6-10 BBADB 11-15CDDDD 16-20 BCCAD 21-25 ACDCC 26. (6分,每空2分) (1) ③ >②>① (2) 出现红褐色沉淀,同时有无色无味气体产生 (3) ③>①=② 27. (12分) (1). NH4++H2ONH3•H2O+H+ (2分) 降低(1分) 增大(1分) (2) ①b (2分) ②B D(2分) ③c(Na+)>c(SO32-)>c(OH-)>c(HSO3-)>c(H+) (2分) ④ 9.3 (2分) 28. (9分) (1)酸式滴定管、烧杯(各1分,无先后顺序) (2) 酸(1分) (3) ① 否(1分) ②高锰酸钾滴入后呈现紫红色,且半分钟溶液颜色保持不变(其他合理答案即可)(2分) ③偏高(1分);0.2250mol/L (2分) 29.(13分)(除标注外,其余各2分) (1)氧化(1分) O2+4e-+2H2O===4OH- (2)正(1分) Fe3++e-===Fe2+ (3)①正(1分) Fe-2e-===Fe2+ ②2Cu2++2H2O2Cu+O2↑+4H+ ③224 30. (10分) (1)原电池 (1分) (2)CH3OH-6e-+8OH-===CO+6H2O(2分) (3)A (1分) 2H2O-4e-===O2↑+4H+ (2分) (4)2Cl++2H2OCl2+H2↑+2OH-(2分) (5)1 (2分)查看更多