- 2021-04-28 发布 |
- 37.5 KB |
- 4页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2020届高考化学二轮复习热重分析计算学案
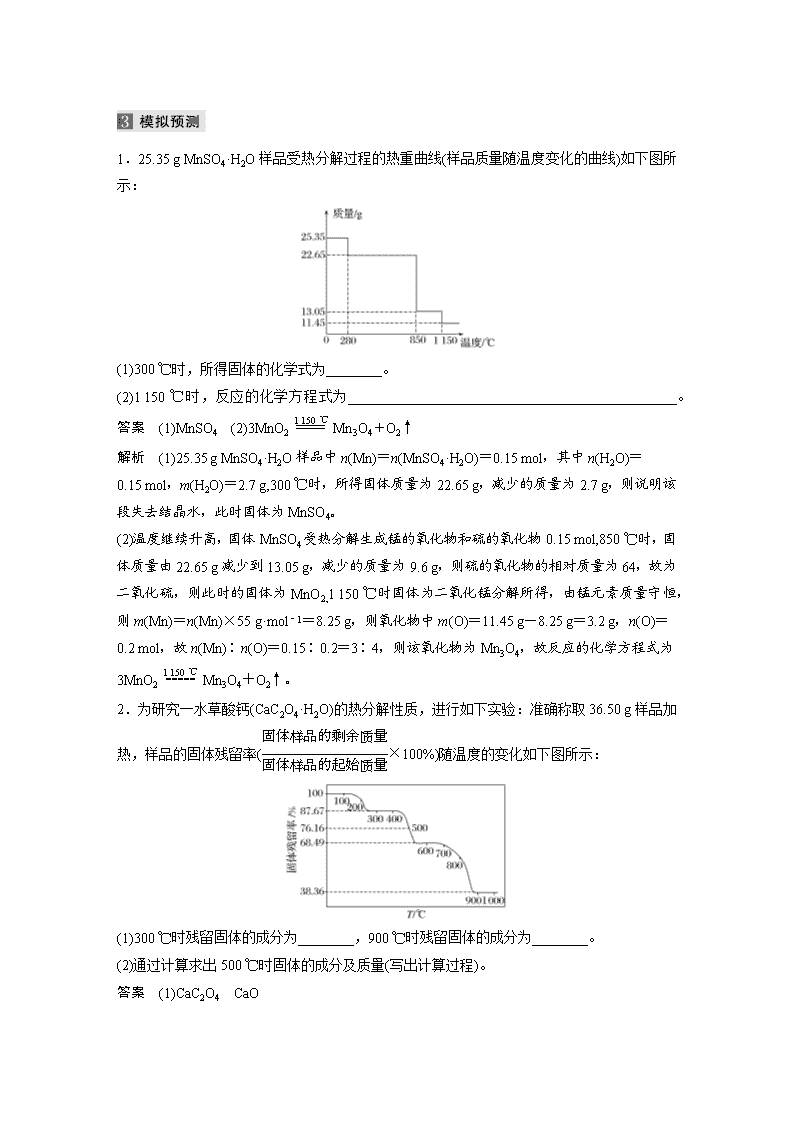
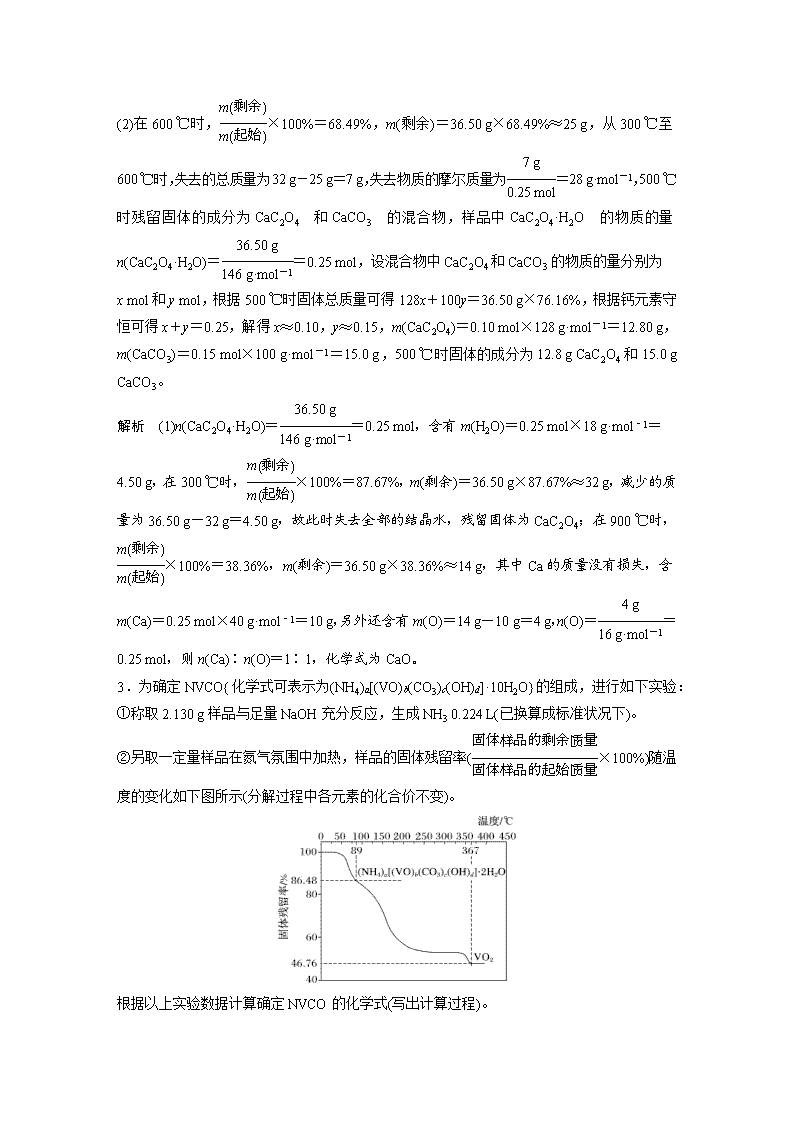
(1)设晶体为1 mol。 (2)失重一般是先失水,再失非金属氧化物。 (3)计算每步的m剩余,×100%=固体残留率。 (4)晶体中金属质量不减少,仍在m剩余中。 (5)失重最后一般为金属氧化物,由质量守恒得m(O),由n(金属)∶n(O),即可求出失重后物质的化学式。 1.[2019·全国卷Ⅰ,27(5)]采用热重分析法测定硫酸铁铵晶体样品所含结晶水数,将样品加热到150 ℃时失掉1.5个结晶水,失重5.6%。硫酸铁铵晶体的化学式为__________________。 答案 NH4Fe(SO4)2·12H2O 解析 失重5.6%是质量分数,设结晶水合物的化学式为NH4Fe(SO4)2·xH2O,由题意知=,解得x≈12。 2.[2014·新课标全国卷Ⅱ,27(4)]PbO2在加热过程发生分解的失重曲线如下图所示,已知失重曲线上的a点为样品失重4.0%(即×100%)的残留固体。若a点固体组成表示为PbOx或mPbO2·nPbO,列式计算x值和m∶n值。 答案 根据PbO2PbOx+O2↑,有×32=239×4.0%,解得x=2-≈1.4,根据mPbO2·nPbO,有=1.4,得==。 1.25.35 g MnSO4·H2O样品受热分解过程的热重曲线(样品质量随温度变化的曲线)如下图所示: (1)300 ℃时,所得固体的化学式为________。 (2)1 150 ℃时,反应的化学方程式为_______________________________________________。 答案 (1)MnSO4 (2)3MnO2Mn3O4+O2↑ 解析 (1)25.35 g MnSO4·H2O样品中n(Mn)=n(MnSO4·H2O)=0.15 mol,其中n(H2O)= 0.15 mol,m(H2O)=2.7 g,300 ℃时,所得固体质量为22.65 g,减少的质量为2.7 g,则说明该段失去结晶水,此时固体为MnSO4。 (2)温度继续升高,固体MnSO4受热分解生成锰的氧化物和硫的氧化物0.15 mol,850 ℃时,固体质量由22.65 g减少到13.05 g,减少的质量为9.6 g,则硫的氧化物的相对质量为64,故为二氧化硫,则此时的固体为MnO2,1 150 ℃时固体为二氧化锰分解所得,由锰元素质量守恒,则m(Mn)=n(Mn)×55 g·mol-1=8.25 g,则氧化物中m(O)=11.45 g-8.25 g=3.2 g,n(O)= 0.2 mol,故n(Mn)∶n(O)=0.15∶0.2=3∶4,则该氧化物为Mn3O4,故反应的化学方程式为3MnO2Mn3O4+O2↑。 2.为研究一水草酸钙(CaC2O4·H2O)的热分解性质,进行如下实验:准确称取36.50 g样品加热,样品的固体残留率(×100%)随温度的变化如下图所示: (1)300 ℃时残留固体的成分为________,900 ℃时残留固体的成分为________。 (2)通过计算求出500 ℃时固体的成分及质量(写出计算过程)。 答案 (1)CaC2O4 CaO (2)在600 ℃时,×100%=68.49%,m(剩余)=36.50 g×68.49%≈25 g,从300 ℃至600 ℃时,失去的总质量为32 g-25 g=7 g,失去物质的摩尔质量为=28 g·mol-1,500 ℃ 时残留固体的成分为CaC2O4和CaCO3的混合物,样品中CaC2O4·H2O的物质的量n(CaC2O4·H2O)==0.25 mol,设混合物中CaC2O4和CaCO3的物质的量分别为 x mol和y mol,根据500 ℃时固体总质量可得128x+100y=36.50 g×76.16%,根据钙元素守恒可得x+y=0.25,解得x≈0.10,y≈0.15,m(CaC2O4)=0.10 mol×128 g·mol-1=12.80 g,m(CaCO3)=0.15 mol×100 g·mol-1=15.0 g,500 ℃时固体的成分为12.8 g CaC2O4和15.0 g CaCO3。 解析 (1)n(CaC2O4·H2O)==0.25 mol,含有m(H2O)=0.25 mol×18 g·mol-1= 4.50 g,在300 ℃时,×100%=87.67%,m(剩余)=36.50 g×87.67%≈32 g,减少的质量为36.50 g-32 g=4.50 g,故此时失去全部的结晶水,残留固体为CaC2O4;在900 ℃时,×100%=38.36%,m(剩余)=36.50 g×38.36%≈14 g,其中Ca的质量没有损失,含m(Ca)=0.25 mol×40 g·mol-1=10 g,另外还含有m(O)=14 g-10 g=4 g,n(O)==0.25 mol,则n(Ca)∶n(O)=1∶1,化学式为CaO。 3.为确定NVCO{化学式可表示为(NH4)a[(VO)b(CO3)c(OH)d]·10H2O}的组成,进行如下实验: ①称取2.130 g样品与足量NaOH充分反应,生成NH3 0.224 L(已换算成标准状况下)。 ②另取一定量样品在氮气氛围中加热,样品的固体残留率(×100%)随温度的变化如下图所示(分解过程中各元素的化合价不变)。 根据以上实验数据计算确定NVCO的化学式(写出计算过程)。 答案 设NVCO的摩尔质量为M g·mol-1,由=0.864 8,可得M≈1 065,由=0.467 6可得b=6;由×a=n(NH3)==0.01 mol,解得a=5,由最后产物为VO2,则VO为+2价,2c+d=5×1+2×6=17,由化合物的相对分子质量18a+67b+60c+17d+180=1 065可知60c+17d=393,解得c=4,d=9,将a=5,b=6,c=4,d=9代入化学表达式,可得化学式为(NH4)5[(VO)6(CO3)4(OH)9]·10H2O。查看更多