2013高考百天仿真冲刺卷(理综试卷四)
2013高考百天仿真冲刺卷
理 综 试 卷(四)
可能用到的相对原子质量:H 1 C 12 N 14 O 16 Na 23 P 31 Cu 64 Hg 201
第Ⅰ卷(选择题 共120分)
本卷共20小题,每小题6分,共120分。在每小题列出的四个选项中,选出符合题目要求的一项。
1.下列生物细胞结构的说法不正确的是 ( )
A.酵母菌有染色体,而硝化细菌没有
B.酵母菌有核糖体,而硝化细菌没有
C.黑藻细胞有线粒体,而蓝藻细胞没有
D.黑藻细胞有叶绿体,而蓝藻细胞没有
2.下图表示甲型H1N1流感病毒在人体细胞中的一些变化以及相关反应。有关叙述不正确的是( )
A.细胞1和B细胞都属于保留分裂能力的细胞
B.细胞2的作用是使靶细胞裂解暴露病原体
C.合成a所需原料及合成场所都是由人体细胞提供的
D.注射的疫苗可直接刺激细胞3产生大量物质b
3.筛选是生物技术中的一个重要环节。下列叙述不正确的是 ( )
A.基因工程中,利用目的基因对受体细胞进行筛选
B.杂交育种中,利用病原体感染法筛选出F2中抗病植株
C.细胞工程中,利用特定的选择培养基筛选出杂交细胞
D.微生物培养中,利用尿素作为唯一氮源的培养基筛选出分解尿素的细菌
4.已知家鸡的无尾(A)对有尾(a)是显性。现用有尾鸡(甲群体)自交产生的受精卵来孵小鸡,在孵化早期向卵内注射微量胰岛素,孵化出的小鸡就表现出无尾性状(乙群体)。为研究胰岛素在小鸡孵化过程中是否引起基因突变,可行性方案是 ( )
A.甲群体×甲群体,孵化早期不向卵内注射胰岛素
B.乙群体×乙群体,孵化早期向卵内注射胰岛素
C.甲群体×乙群体,孵化早期向卵内注射胰岛素
D.甲群体×乙群体,孵化早期不向卵内注射胰岛素
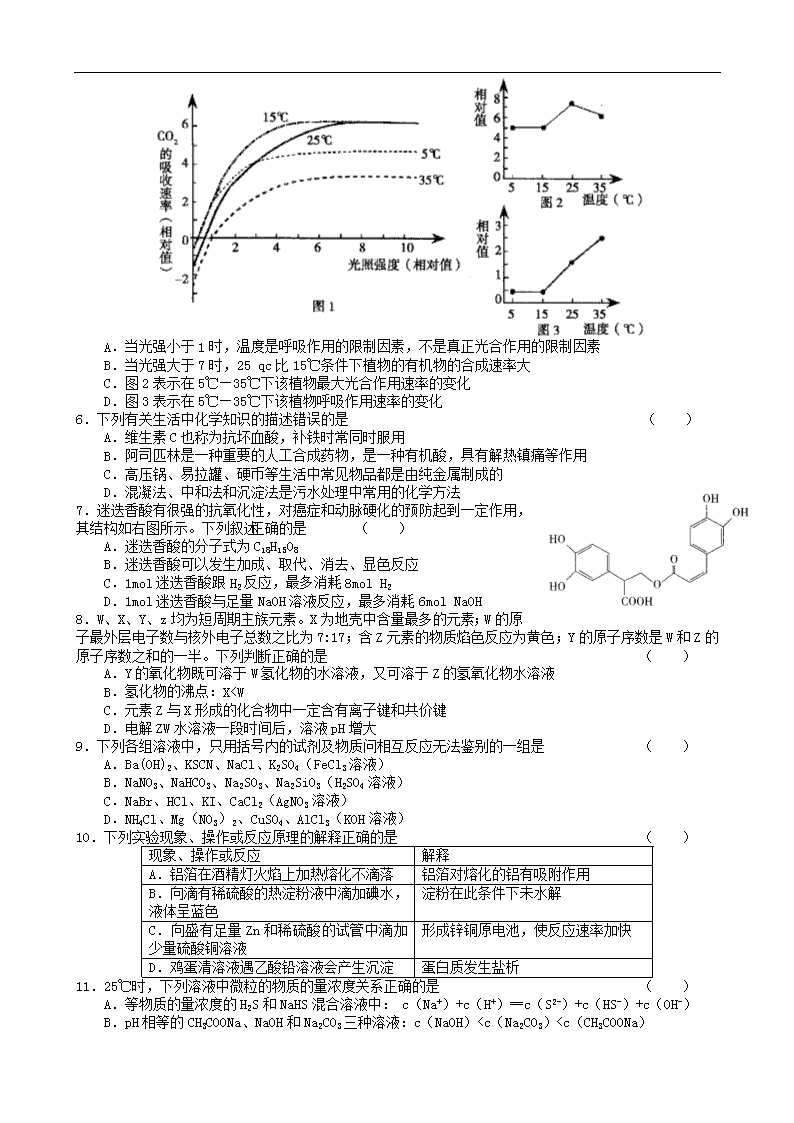
5.将某种植物置于CO2浓度适宜、水分充足的环境中,温度分别保持在5℃、15℃、25℃和35℃下,改变光照强度,测定CO2的吸收速率,得到图1所示的结果。处理图1中有关数据得到图2、图3。下列叙述不正确的是 ( )
A.当光强小于1时,温度是呼吸作用的限制因素,不是真正光合作用的限制因素
B.当光强大于7时,25 qc比15℃条件下植物的有机物的合成速率大
C.图2表示在5℃—35℃下该植物最大光合作用速率的变化
D.图3表示在5℃—35℃下该植物呼吸作用速率的变化
6.下列有关生活中化学知识的描述错误的是 ( )
A.维生素C也称为抗坏血酸,补铁时常同时服用
B.阿司匹林是一种重要的人工合成药物,是一种有机酸,具有解热镇痛等作用
C.高压锅、易拉罐、硬币等生活中常见物品都是由纯金属制成的
D.混凝法、中和法和沉淀法是污水处理中常用的化学方法
7.迷迭香酸有很强的抗氧化性,对癌症和动脉硬化的预防起到一定作用,其结构如右图所示。下列叙述正确的是 ( )
A.迷迭香酸的分子式为C18H15O8
B.迷迭香酸可以发生加成、取代、消去、显色反应
C.1mol迷迭香酸跟H2反应,最多消耗8mol H2
D.1mol迷迭香酸与足量NaOH溶液反应,最多消耗6mol NaOH
8.W、X、Y、z均为短周期主族元素。X为地壳中含量最多的元素;W的原子最外层电子数与核外电子总数之比为7:17;含Z元素的物质焰色反应为黄色;Y的原子序数是W和Z的原子序数之和的一半。下列判断正确的是 ( )
A.Y的氧化物既可溶于W氢化物的水溶液,又可溶于Z的氢氧化物水溶液
B.氢化物的沸点:X
c(A-)>c(OH-)>c(H+)
D.0.4mol/L NH4Cl和0.2mol/L NaOH两种溶液等体积混合后pH=9:
c(NH+4)>c(Cl-)>c(Na+)>c(OH-)>c(H+)
12.已知:可逆反应N2(g)+3H2(g)2NH3(g)△H<0。现有甲、乙两个容积相同且不变的真空密闭容器,向甲容器中加入1mol N2(g)和3mol H2(g),在一定条件下发生反应,达到平衡时放出热量为Q1kJ。在相同条件下,向乙容器中加入2mol NH3(g)并发生反应,达到平衡时吸收热量为Q2kJ,若Q1=3Q2。下列叙述中正确的是( )
A.达平衡时甲中N2的转化率为75%
B.达平衡时甲、乙中NH,的体积分数乙>甲
C.达到平衡后,再向乙中加入0.25mol N2(g)、0.75mol H2(g)和1.5mol NH3(g),平衡向生成N2的方向移动
D.乙中反应的热化学方程式为2NH3(g)N2(g)+3H2(g)△H=+Q2kJ/mol
13.下列说法中不正确的是 ( )
A.在粒子散射实验中,使少数粒子产生大角度偏转的力是原子核对粒子的库仑斥力
B.氢原子在辐射出一个光子后,核外电子的动能增大
C.已知氦原子的质量m1、电子质量m2、质子质量m3、中子质量m4,则质子和中子在结合成氦核时的质最亏损为(2m4+2m3—m1)
D.爱因斯坦狭义相对论的基本结论之一是运动物体长度会收缩即,它是因时空条件不同而引起的观测效应
14.如图所示,细光束AD以45°的入射角从某种介质射向空气时,分成a、b两束,a光频率为v1,b光频率为v2。关于这两种单色光,下列说法中正确的是 ( )
A.从该介质射向空气时,光发生全反射时的临界角一定大于45°
B.该介质对b光的折射率一定小于
C.用a光和b光分别做双缝干涉实验,若实验条件相同,则b光在光屏上形成的明条纹的间距较小
D.若用a光照射某金属板能发生光电效应,则用b光照射该金属板也一定能发生光电效应
15.一位高三年级的男生骑着自行车在水平公路上以较快的速度行驶,没所受阻力为车和人总重的0.05倍,则该同学骑车的功率最接近于 ( )
A.10W B.50W
C.250W D.1KW
16.电阻为1Ω的矩形线圈,绕垂直于磁场方向的轴在匀强磁场中匀速转动,产生的交变电动势随时间变化的图象如图所示。现把交流电加在电阻为9Ω的电热丝上,则下列说法中正确的是 ( )
A.线圈转动的角速度为
B.如果线圈转速提高一倍,则电流不会改变
C.电热丝两端的电压U=100V
D.电热丝的发热功率P=1800W
17.如图所示为一列沿x轴正方向传播的简谐横波在t时刻的波形图。已知该波的周期为T,a、b、c、d为沿波传播方向上的四个质点,则下列说法中正确的是 ( )
A.在时,质点c的速度达到最大值
B.在时,质点d的加速度达到最大值
C.从t时刻起,质点a比质点b先回到平衡位置
D.从t时刻起,在一个周期内,a、b、c、d四个质点所通过的路程均为一个波长
18.没嫦娥号登月飞船贴近月球表而做匀速圆周运动,测得飞船绕月运行周期为T。飞船在月球上着陆后,自动机器人在月球上做自由落体实验,将某物体由距月球表面高h处释放,经时问t后落到月球表面。已知引力常量为G,由以上数据不能求出的物理量是 ( )
A.月球的半径
B.月球的质量
C.月球表面的重力加速度
D.月球绕地球做匀速圆周运动的向心加速度
19.如图所示,一些商场安装了智能化的自动扶梯。为了节约能源,在没有乘客乘行时,自动扶梯以较小的速度匀速运行,当有乘客乘行时自动扶梯经过先加速再匀速两个阶段运行。则电梯在运送乘客的过程中( )
A.乘客始终受摩擦力作用
B.乘客经历先超重再失重
C.乘客对扶梯的作用力先指向右下方,再竖直向下
D.扶梯对乘客的作用力始终竖直向上
20.矩形线框abcd在匀强磁场中静止不动,磁场方向与线框平面垂直,磁感应强度B随时间t变化的图象如图甲所示。设t=0时刻,磁感应强度的方向垂直纸面向里,则在0~4s时间内,图乙中能正确表示线框ab边所受的安培力F随时间t变化的图象是(规定ab边所受的安培力方向向左为正) ( )
第Ⅱ卷(非选择题共180分)
21.(18分)
(1)“测定某电阻丝的电阻率”实验
①实验中,用螺旋测微器测量一种电阻值很大的电阻丝直径,刻度位置如图所示,则电阻丝的直径是 mm。
②用多用表的欧姆档粗测电阻丝的阻值:已知此电阻丝的阻值约为几十kΩ。下面给出的操作步骤中,合理的实验步骤顺序是: (填写相应的字母)。旋转选择开关其尖端应对准的欧姆档位是 ;根据表中指针所示位置,电阻丝的阻值约为 Ω。
a.将两表笔短接,调节欧姆档调零旋钮使指针对准刻度盘上欧姆档的零刻度,而后断开两表笔
b.将两表笔分别连接到被测电阻丝的两端,读出阻值后,断开两表笔
c.旋转选择开关S,使其尖端对准欧姆档的某一档位
d.旋转选择开关S,使其尖端对准交流500V档,并拔出两表笔
③若用电流表和电压表精确测量此电阻丝的阻值,实验室提供下列可供选用的器材:
电压表V(量程3V,内阻50kΩ);电流表A1(量程200,A,内阻200Ω);电流表A2(量程5mA,内阻20Ω);电流表A3(量程0.6A,内阻1Ω);滑动变阻器尺(最大阻值1kΩ);电源E(电源电压为4V);开关S、导线
a.在所提供的电流表中应选用 (填字母代号);
b.在虚线框中画出测电阻的实验电路;
④分别用l、d、Rx表示电阻丝的长度、直径和阻值,则该电阻丝的电阻率表达式为 。
(2)某学习小组学生利用线圈、强磁铁、光电门传感器、电压传感器等器材研究“线圈中感应电动势大小与磁通量变化快慢的关系”。在探究线圈感应电动势E与时间△t的关系时,他们把线圈和光电门传感器固定在水平光滑轨道上,强磁铁和挡光片固定在运动的小车上,实验装置如图所示。当小车在轨道上运动经过光电门时,光电门会记录下挡光片的挡光时间△t,同时小车上的强磁铁插入线圈中,接在线圈两端的电压传感器记录下在这段时间内线圈中产生的感应电动势E的大小(E近似看成恒定)。调节小车末端的弹簧,小车能够以不同的速度从轨道的最右端弹出。下表是小组同学进行多次测量得到的一系列感应电动势E和挡光时间△t。
次数
测量值
1
2
3
4
5
6
7
8
E/×10-1V
1.16
1.36
1.70
1.91
2.15
2.75
2.92
3.29
△t/10-3s
9.20
7.49
6.29
5.61
5.34
4.30
3.98
3.42
①由实验装置可以看出,实验中每次测量在△t时间内磁铁相对线圈运动的距离都相同,这样可以实现控制 不变;
②为了探究E与△t的关系,请你根据表格中提供的信息提出一种处理数据的方案。
(写出必要的文字说明)
22.(16分)
如图所示,一质量为0.99kg的木块静止在足够长的水平轨道AB的B端,水平轨道与半径为10m的光滑弧形轨道BC相切。现有一质量为10g的子弹以500rn/s的水平速度从左边射入木块但未穿出。已知木块与轨道AB的动摩擦因数=0.5,g=10m/s2。
求:
(1)子弹射人木块与木块获得的共同速率;
(2)子弹射入后与木块在圆弧轨道上升的最大高度;
(3)从木块返回B点到静止在水平面上,摩擦阻力的冲量的大小。
23.(18分)
如图甲所示,两平行金属板间接有如图乙所示的随时问t变化的交流电压u。金属板间电场可看作均匀,且两板外无电场,板长L=0.2m,板间距离d=0.1m。在金属板右侧有一边界为MN的区域足够大的匀强磁场,MN与两板中线OO′垂直,磁感应强度B=5×10-3T,方向垂直纸面向里。现有带正电的粒子流沿两板中线OO′连续射人电场中,已知每个粒子的速度v0=105m/s,比荷=108C/kg,重力忽略不计,在每个粒子通过电场区域的极短时间内,电场可视为恒定不变。求:
(1)带电粒子刚好从极板边缘射出时两金属板问的电压;
(2)带电粒子进入磁场时粒子最大速度的大小;
(3)证明:任意时刻从电场射出的带电粒子,进入磁场时在MN上的人射点和出磁场时在MN上的出射点间的距离为定值,并计算出两点问的距离。
24.(20分)
如图所示,de和fg是两根足够长且固定在竖直方向上的光滑金属导轨,导轨间距离为L、电阻忽略不计。在导轨的上端接电动势为E、内阻为r的电源。一质量为m、电阻为R的导体棒以ab水平放置于导轨下端e、g处,并与导轨始终接触良好。导体棒与金属导轨、电源、开关构成闭合回路,整个装置所处平面与水平匀强磁场垂直,磁场的磁感应强度为B,方向垂直于纸面向外。已知接通开关S后,导体棒ab由静止开始向上加速运动。求:
(1)导体棒ab刚开始向上运动时的加速度以及导体棒ab所能达到的最大速度;
(2)导体棒ab达到最大速度后电源的输出功率;
(3)分析导体棒ab达到最大速度后的一段时间△t内,整个同路中能量是怎样转化的?并证明能量守恒。
25.(16分)
经质潜法分析得知,某单烯烃Q的相对分子质量为56;其核磁共振氢谱与红外光谱表明,Q分子中有两种化学环境不同的氢原子,氢蘑峰面积显示两种氢的原子个数比为1:3(Q分子中含有支链)。
(1)Q的结构简式为 。
(2)在锂离子电池中,需要一种有机聚合物作为正负极之问锂离子迁移的介质,该有机聚合物的单体之一(用M表示)的结构简式如右:
M的合成方法之一如下:
请回答下列问题:
①合成M的反应中,反应I和反应III的反应类型分别是 、 ;
试剂Ⅱ是 ,C中含有官能团的名称是 。
②E的结构简式是 。
③M与足量氯氧化钠溶液反应的化学方程式是 。
(3)D在一定条件下?能发生缩聚反应生成高聚物,请写出D发生缩聚反应的化学方程式 。
(4)已知:I.
(其中R为烃基)
II.
若,请写出符合下列条件的物质的一种结构简式 。
a.碳骨架与W相同;
b.能发生银镜反应;
c.1mol该物质与足量金属钠作用生成1.5molH2;
d.分子中每个碳原子上不同时连有两个官能团。
26.(14分)下图为某套实验装置示意图,其中加热装置和部分药品等已经省略(装置①和装置②
为气体发生装置)。
(1)甲同学利用装置(在A、B间增加一盛有浓硫酸的洗气瓶)制备NO2并验证其性质。装置①用于实验室制备NH3,用装置②制备过量O2。A装置中相应药品在催化加热时发生反应的化学方程式是 。B处冰水冷却的U型管中有红棕色气体生成且越接近U型管底部颜色越浅,请解释原因 。
(2)乙同学利用此套装置合成SO3,B处冰水冷却的U型管中的固体出现。C中若盛放K2Cr2O7溶液,则在C中发生的氧化还原反应的离子方程式是 (生成物中Cr以Cr3+形式存在);现欲制得纯净干燥的SO3,若C中盛放NaOH溶液,则此装置中存在明显不足,应如何改进 (从下面给出的实验装置中选择字母标号补充或替换,并用简要文字说明)
(3)丙同学拟验证NO能被氨气还原并测算其转化率(装置①、装置②分别制NO和NH3),将上述装置A、B、C分别换成下列⑤、⑥、⑦。
请回答:装置⑦的作用可能是 ;若进入装置⑤的NO共2688mL(已折算为标准状况,下同),氨气过量,最后收集到标准状况下2016 mLN2,则NO的转化率是 (能正确表达出计算过程即可)
27.(14分)
最近科学家提出“绿色自由”构想:把空气吹入碳酸钾溶液,然后再把CO2从溶液中提取出来,经化学反应后使空气中的CO2转变为可再生燃料甲醇。“绿色自由”构想技术流程如下:
(1)分解池中发生分解反应的物质是 。
(2)在合成塔中,若有2.2kgCO2与足量H2恰好完全反应,生成气态的水和甲醇,可放出2473.5kJ的热量,试写出合成塔中发生反应的热化学方程式 。
(3)①从平衡移动原理分析,低温有利于原料气的转化,而实际生产中采用300°C的温度,原因之一是考虑到催化剂的催化活性,原因之二是 。
②从合成塔中分离出甲醇的原理与下列哪个相符 (选填字母)。
a.过滤 b.分液 c.蒸馏
③“绿色自由”构想技术流程中常包括物质和能量的“循环利用”,上述流程中能体现“循环利用”的除碳酸钾溶液外,还包括 。
(4)右图是甲醇燃料电池的结构示意图。已知电池总反应为:
2CH3OH+3O2=2CO2+4H2O。通入a—端的电极是
(填“正极”或“负极”),负极发生的电极反应是 。
28.(14分)
四种短周期元素A、B、C、D的性质或结构信息如下:
信息① 原子半径大小:A>B>C>D
信息② 四种元素之间形成的某三种分子的比例模型及部分性质:
甲:是地球上最常见的物质之一,是所有生命体生存的重要资源,约占人体体重的三分之二。
乙:无色,无气味并且易燃。是常见的一种基础能源。
丙:有强氧化性的弱酸,可以用于消毒杀菌。
请根据上述信息回答下列问题。
(1)B元素在周期表中的位置 ,请写出BC2分子的电子式 。
(2)A所在周期中,E元素的单质还原性最强,F元素的某些盐类常用作净水剂。E单质与甲反应有化合物X生成。请写出以下两个反应的离子方程式。
①A元素的单质与物质甲发生的反应 。
②F、C两种元素组成的化合物Y可作为高温结构陶瓷材料,X与Y两种化合物在溶液中发生的反应 。
(3)物质丁的元素组成和甲相同,丁分子具有18电子结构。向盛有一定浓度丁溶液的试管中,逐滴加入用少量稀硫酸酸化的硫酸亚铁溶液。滴加过程中的现象是:
①浅绿色溶液变成深棕黄色,②有少量气泡出现(经验证是氧气),片刻后反应变得剧烈,并放出较多热量,继续滴加溶液,静置一段时间,③试管底部出现红褐色沉淀。向浊液中再滴入稀硫酸,沉淀溶解,溶液呈黄色。请用化学方程式或离子方程式及必要的文字解释①、②、③中加点的字。① ② 3 。
29.(14分)
下图表示某地区农业生态系统的结构模式图。请据图回答:
(1)人们通常将大豆和玉米实施套种,大豆和玉米之间的关系为
。农田中经常发生虫害,若调查该农田某种害虫虫卵的密度应采用的方法是 。废弃农田上会发生群落的演替,该演替的类型是 。
(2)秸秆在沼气池中处理成沼渣后肥效提高,这是因为 。
(3)为了提高蔬菜产量,人们通常将蘑菇房与蔬菜大棚相通,原因是 。
(4)该生态系统充分利用了废弃物中能量,形成“无废弃物农业”,遵循了生态工程的
原理。
(5)假设该农场将生产玉米的1/3作为饲料养鸡,2/3供人食用,生产出的鸡供人食用。现调整为2/3的玉米养鸡,1/3供人食用,生产出的鸡仍供人食用。理论上,该农场供养的人数将 。(增加、减少)
30.(18分)
请回答下列与大肠杆菌有关的问题:
(1)从生态系统的成分上看,大肠杆菌属于 ;它的同化作用类型是 。
(2)下表是某公司研发的一种培养大肠杆菌菌群的培养基配方。
成分
含量
蛋白胨
10.0g
乳糖
5.0g
蔗糖
5.0g
K2HPO4
2.0g
显色剂
0.2g
琼脂
12.0g
将上述物质溶解后,用蒸馏水定容到1000mL
根据用途划分该培养基属于 培养基(选择、鉴别)。该培养基中的碳源是 。
(3)培养大肠杆菌时,常用的接种方法是平板划线法和 。为防止杂菌污染需要对培养基和培养皿进行 。
(4)现有一升水样,用无菌吸管吸取1mL轩至盛有9mL无菌水的试管中,依次稀释103稀释度。各取0.1mL已稀释103倍的水样分别接种到三个培养基上培养,记录的菌落数分别为55、56、57,则每升原水样中大肠杆菌数为 。
(5)以下微生物发酵生产特定产物时,所利用主要微生物的细胞结构与大肠杆菌相同的是 。
A.制作果酒 B.由果酒制作果醋 C.制作泡菜 D.制作腐乳
(6)利用培养基不仅可以分离培养微生物,也可以进行植物组织培养。与微生物培养明显不同的是,用于组织培养的培养基中还需要加入 。
31.(18分)
某研究性学习小组的同学对某地区人类的遗传病进行调查。在调查中发现甲种遗传病(简称甲病)发病率较高,往往是代代相传,乙种遗传病(简称乙病)的发病率较低。下表是甲病和乙病在该地区万人中表现情况统计表(甲、乙病均由核基因控制)。请分析回答:
表现型
人数
性别
有甲病、无乙病
无甲病、有乙病
有甲病、有乙病
无甲病、无乙病
男性
279
250
7
4464
女性
281
16
3
4700
(1)若要了解甲病和乙现的发病情况,应在人群中 调查并计算发病率。
(2)控制甲病的基因最可能位于 染色体上,控制乙病的基因最可能位于 染色体上。
(3)假设被调查群体中患甲病的纯合子为200人,则被调查的人群中显性基因(A)的基因频率是 %。
(4)下图是该小组的同学在调查中发现的甲病(基因为A、a)、乙病(基因为B、b)的家庭系谱图。请据图回答:
①III2的基因型是 。
②如果IV6是男孩,则该男孩同时患甲病和乙病的概率为 。
③如果IV6是女孩,且为乙病的患者,说明III1在有性生殖产生配子的过程中发生了 。
④现需要从第III代个体中取样(血液、皮肤细胞、毛发等)获得乙病致病基因,提供样本的合适个体为 。
(5)若要快速栓测正常人群中的个体是否携带乙病致病基因,可利用特定的分子探针进行检测,这一方法依据的原理是 。
2013高考百天仿真冲刺卷
理综试卷(四)参考答案
第Ⅰ卷(选择题 共120分)
本卷共20小题,每小题6分,共120分.在每小题列出的四个选项中,选出符合题目要求的一项.
题号
1
2
3
4
5
6
7
8
9
10
答案
B
D
A
D
C
C
D
D
C
C
题号
11
12
13
14
15
16
17
18
19
20
答案
B
A
C
B
C
D
B
D
C
A
第Ⅱ卷(非选择题 共180分)
21.(18分)
(1)(14分)
①0.642; …………2分
②c、a、b、d;×1k;32000Ω ……每空2分
③a.A1 …………2分
b.如图 …………2分
④ …………2分
(2)(4分)
①磁通量的变化量 …………1分
②方法1:选择多组数据,计算感应电动热E和挡光时间的乘积,在误差范围内其乘积为定值,得到在磁通量变化一定时,E与成正比;
方法2:以感应电动势E与挡光时间为横、纵坐标,根据数据描点作图,科线为通过原点的直线,得到在磁通量变化一定时,E与成正比。
22.(16分)
解:(1)(5分)设子弹射入木块与木块获得的共同速度为v,子弹射入木块前后系统动量定恒
…………3分
…………2分
(2)(5分)设木块上升最大高度为h,子弹与木块在光滑孤形轨道BC上运动,到达最高点的过程机械能定恒
…………3分
…………2分
(3)(6分)木块返回B点进入水平轨道作匀减速运动最终静止,摩擦力的冲量为I,由牛顿第二定律、匀变速运动规律得
…………2分
…………1分
…………2分
…………1分
23.(18分)
解:(1)(5分)设带电粒子刚好从极板边缘射出电场时电压为U
…………1分
…………1分
…………1分
…………2分
(2)(4分)粒子刚好从极板边缘射出电场时速度最大,设最大速度为,
由动能定理
…………2分
…………2分
(3)(9分)
设粒子进入磁场时速度方向与的夹角为,
则任意时刻粒子进入磁场的速度大小 ……2分
粒子在磁场中做圆周运动的轨道半径为R
…………2分
设粒子从磁场中飞出的位置与进入磁场的位置之间的距离为
…………2分
由上式可知,射出电场的任何一个带电粒子,进入磁场时的入射点与射出磁场时的出射点间距离为定值,无关、与所加电压值有关。 …………1分
得 …………2分
24.(20分)
解:(1)(10分)导体棒ab刚开始运动时的速度为零,由欧姆定律
…………1分
导体棒ab所受安培力 …………1分
由牛顿第二定律 …………1分
导体棒ab开始运动时的加速度 …………1分
设导体棒ab向上运动的最大速度为,
当导体棒所受重力与安培力相等时,达到最大速度,回路电流为
…………2分
由欧姆定律 …………2分
得 …………2分
(2)(4分)电源的输出功率 …………2分
…………2分
(3)(6分)电源的电能转化为导体棒的机械能和电路中产生的焦耳热之和 …………1分
时间内:电源的内能 …………1分
导体棒ab增加的机械能 …………1分
电路中产生的焦耳热
△t时间内,导体棒ab增加的机械能与电路中产生的焦耳热之和为
整理得 …………1分
由此得到,回路另能量定恒。
25.(16分)
26.(14分)
(1)4NH3+5O2 4NO+6H2O …………2分
因为2NO+O2=2NO2,2NO2(红棕) N2O4(无色),正反应是放热反应,U型管底部的温度降低,上述平衡向右移动,NO2浓度降低,颜色变浅 …………4分
(2)Cr2O2-7+3SO2+2H+ 2Cr3++3SO2-4+H2O …………2分
将e、m依次连接在B、C之间或将C装置换成f …………2分
(3)吸收未反应的NO …………2分
(90%) …………2分
27.(14分)
(1)KHCO3(或碳酸氢钾) …………2分
(2)CO2(g)+3H2(g) H2O(g)+CH3OH(g) △H=-149.47kJ/mol………2分
(3)①考虑反应快慢 …………2分
②c …………2分
③高温水蒸气 …………2分
(4)负极 …………2分
CH3OH+H2O-6e- CO2+6H+ …………2分
28.(14分)
(1)第2周期IVA族 …………2分
…………2分
(2)①Cl2+H2O H++Cl-+HClO …………2分
②Al2O3+2OH- 2AlO-2+H2O …………2分
(3)①2Fe2++H2O2+2H+ 2Fe3++2H2O,浅绿色Fe2+被过氧化氢氧化成黄色Fe3+(浓度大时呈深棕黄色)2分
②过氧化氢分解可产生氧气,常温时反应2H2O2 2H2O+O2↑较慢,因而开始气泡少;受热并且被逐渐增多的Fe3+催化,使反应速率加快而剧烈…………2分
③反应①使c(H+)降低且反应②放热,从而使水解平衡Fe3++2H2O Fe(OH)3+3H+
正向移动,当水解出的Fe(OH)3较多时就聚集为沉淀(因反应放热会使氢氧化铁部分分解为红棕色氧化铁) …………2分
29.(14分)
(1)竞争 样方法 次生演替
(2)微生物将秸秆中的有机物分解为无机物
(3)蘑菇呼吸作用产生的CO2可以提高蔬菜光合作用强度
(4)物质循环再生
(5)减少
30.(18分)
(1)分解者 异养型
(2)鉴别 乳糖、蔗糖(蛋白胨)
(3)稀释涂布平板法 灭菌
(4)5.6×108
(5)B、C
(6)植物激素(或生长素和细胞分裂素)
31.(18分)
(1)随机抽样
(2)常 X
(3)3.85
(4)①aaXBXB 或aaXBXb ②1/8 ③基因突变 ④III3、III4
(5)碱基互补配对原则
版权所有:高考资源网(www.ks5u.com)
版权所有:高考资源网(www.ks5u.com)