- 2021-04-27 发布 |
- 37.5 KB |
- 15页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
黑龙江省绥化市青冈县第一中学2019-2020学年高一上学期期中考试(B班)化学试题
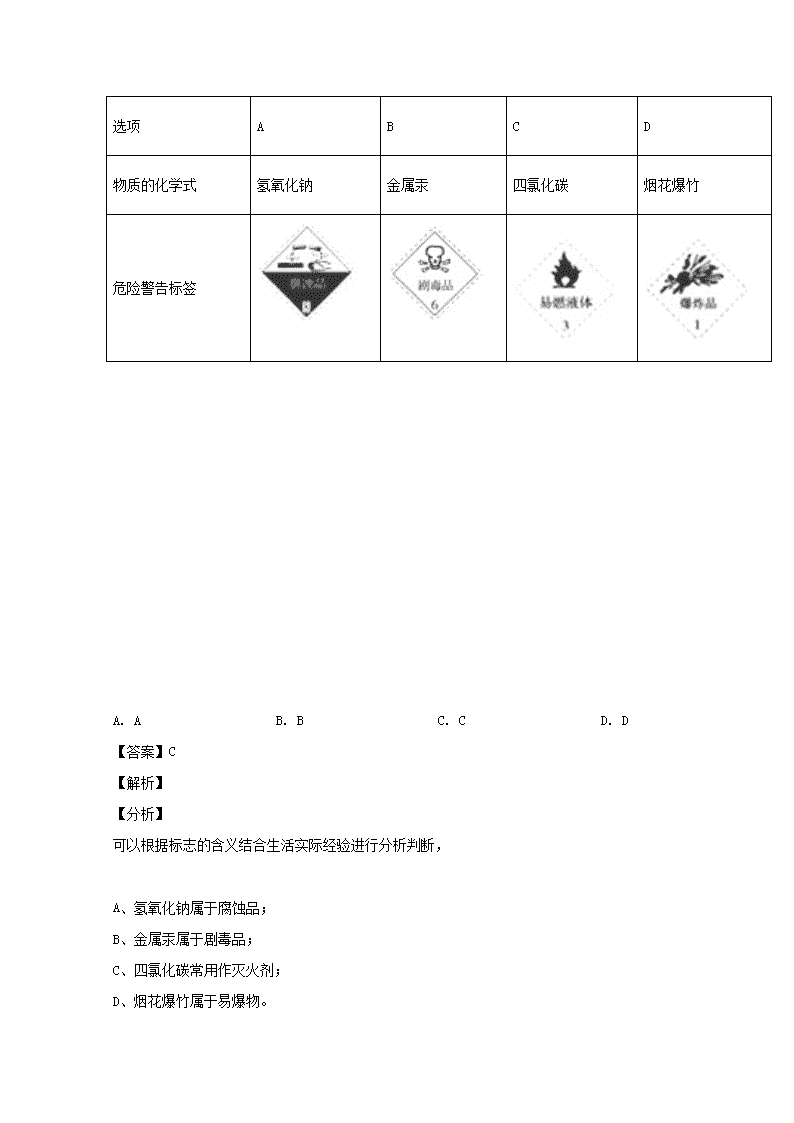
www.ks5u.com 青冈一中高一学年期中考试 化学试卷(B卷) (90分钟 100分) 可能用到的相对原子质量:H:1 C:12 N:14 O:16 Na:23 S:32 Cl:35.5 Cu:64 第Ⅰ卷 (选择题共60分) 1.下列诗句或成语只涉及物理变化的是 ( ) A. 爆竹声中一岁除 B. 铁杵磨成针 C. 野火烧不尽 D. 百炼成钢 【答案】B 【解析】 A项,爆竹声中一岁除,爆竹燃烧属于化学变化;B项,铁杵磨成针过程中没有新物质生成,属于物理变化;C项,野火烧不尽发生燃烧反应,属于化学变化;D项,百炼成钢,指通过化学反应降低生铁中的含碳量并除去杂质,属于化学变化;答案选B。 【点睛】物理变化和化学变化的区别是:物理变化中没有新物质生成,化学变化中有新物质生成。 2.化学实验中安全意识是重要的科学素养,下列行为中符合安全要求的是( ) A. 进入煤矿井时,用火把照明 B. 节日期间,在开阔的广场燃放烟花爆竹 C. 实验时,将水倒入浓硫酸配制稀硫酸 D. 用点燃的火柴在液化气钢瓶口检验是否漏气 【答案】B 【解析】 【详解】A. 煤矿井里含有甲烷气体,甲烷为易燃气,用火把照明会引起爆炸,故A错误; B. 节日期间,在开阔的广场燃放烟花炮竹可以避免出现安全事故,故B正确; C. 在稀释浓硫酸时应该把浓硫酸逐滴加入到水中,边加边搅拌,故C错误; D. 液化气为易燃气体,用点燃的火柴在液化气钢瓶口检验是否漏气可引起爆炸,故D错误; 正确答案是B。 3.对于易燃、易爆、有毒的 化学物质,往往会在其包装上贴上危险警告标签.下面所 列的物质中,标签贴错了的是 选项 A B C D 物质的化学式 氢氧化钠 金属汞 四氯化碳 烟花爆竹 危险警告标签 A. A B. B C. C D. D 【答案】C 【解析】 【分析】 可以根据标志的含义结合生活实际经验进行分析判断, A、氢氧化钠属于腐蚀品; B、金属汞属于剧毒品; C、四氯化碳常用作灭火剂; D、烟花爆竹属于易爆物。 【详解】A、氢氧化钠具有强烈的腐蚀性,故应贴腐蚀品的标志,图为腐蚀品标志,故A正确; B、金属汞是剧毒品,图为剧毒品标志,故B正确; C、四氯化碳常用作灭火剂,图为易燃液体标志,故C错误; D、烟花爆竹属于易爆物,故应贴爆炸品的标志,图为爆炸品标志,故D正确; 故选C。 【点睛】本题考查危险品标志,解题关键:首先要知道各种物质的性质,然后根据各个标签所代表的含义进行分析判断。易错点C,四氯化碳为有机物,却不能燃烧。 4.下列仪器用酒精灯加热时,需垫石棉网的是 ( ) ①烧杯 ②坩埚 ③锥形瓶 ④蒸发皿 ⑤试管 ⑥蒸馏烧瓶 ⑦表面皿 A. ②④⑤ B. ①⑥⑦ C. ③④⑥ D. ①③⑥ 【答案】D 【解析】 【分析】 实验室中可直接加热的仪器有蒸发皿、试管、坩埚,垫石棉网可加热的有烧杯、烧瓶、锥形瓶等,不能加热的有集气瓶、广口瓶、细口瓶等。 【详解】①烧杯③锥形瓶⑥烧瓶垫石棉网可加热;②坩埚④蒸发皿⑤试管可直接加热;⑦表面皿不能用来加热。故选D。 5.某合作学习小组讨论辨析以下说法。其中错误的是 ( ) A. 冰和干冰既是纯净物又是化合物 B. 纯碱和熟石灰都是碱 C. 盐酸和食醋都属于混合物 D. 豆浆和雾都是胶体 【答案】B 【解析】 A. 冰和干冰既是纯净物又是化合物,故A正确;B. 纯碱是盐,故B错误;C. 盐酸和食醋都属于溶液,都属于混合物,故C正确;D. 豆浆和雾都是胶体,故D正确。故选B。 6.下列仪器常用于物质分离的是 A. ①③⑤ B. ②③⑤ C. ②④⑤ D. ①②④ 【答案】B 【解析】 【详解】①为试管,一般用于反应等,②为漏斗,一般用于过滤和向容器中添加液体,③为分液漏斗,用于分液,④是托盘天平,用于称量,⑤为蒸馏烧瓶,可以用于蒸馏或分馏等,因此用于物质分离的仪器是②③⑤,故选项B正确。 7.为了除去粗盐中的Ca2+、Mg2+、SO42-及泥沙,得到纯净的NaCl,可将粗盐溶于水,在下列操作中选取必要的步骤和正确的操作顺序 ①过滤 ②加过量的NaOH溶液 ③加过量的盐酸 ④加过量的Na2CO3溶液 ⑤加过量的BaCl2溶液 ⑥加热蒸发 A. ②④⑤①③⑥ B. ④⑤②①③⑥ C. ①②⑤④③⑥ D. ②⑤④①③⑥ 【答案】D 【解析】 加入NaOH的作用是除去Mg2+;加入BaCl2的作用是除去SO42-;由于除SO42-时加入的BaCl2溶液过量,则加入Na2CO3的作用是除去Ca2+和过量的Ba2+,Na2CO3必须在BaCl2之后加入;由于Mg(OH)2、CaCO3、BaCO3都能溶于盐酸,所以过滤后加入盐酸除去过量的OH-和CO32-;获得的NaCl溶液用蒸发结晶得到纯净的NaCl;所以操作顺序可为:⑤②④①③⑥、②⑤④①③⑥,答案选D。 点睛:物质分离提纯的原则:不增(不增加新杂质)、不减(不减少被提纯物质)、所加除杂试剂过量、过量的除杂试剂要除去、易分离、易复原。 8.高一入学体检时,小明体检的血液化验单中,出现了如下图所示的体检指标。表示该体检指标的物理量是( ) 甘油三酯 0.52 mmol/L 总胆固醇 4.27 mmol/L 高密度脂蛋白胆固醇 1.57 mmol/L 低密度脂蛋白胆固醇 1.40 mmol/L 葡萄糖 4.95 mmol/L A. 溶解度 B. 物质的量浓度 C. 质量分数 D. 摩尔质量 【答案】B 【解析】 【详解】A.溶解度是指一定温度下100g水中溶解某种溶质达到饱和状态时的该溶质的克数,单位是g,显然A项错误; B.物质量浓度是指单位体积的溶液里所含溶质的物质的量,单位是mol/L或mmol/L(毫摩尔每升),B项正确; C.溶质的质量分数是指溶质质量与溶液质量之比,单位是“1”,显然C项错误; D.摩尔质量是指单位物质的量的物质所具有的质量,单位是g/mol,D项错误。答案选B。 9.向盛有I2水溶液的试管中,再加四氯化碳振荡,静置后观察到的现象是( ) A. 上层橙红色,下层接近无色 B. 均匀、透明、紫红色 C. 均匀、透明、无色 D. 上层接近无色,下层紫红色 【答案】D 【解析】 【详解】I2水溶液是棕色,加入密度大于水的四氯化碳,因为I2在四氯化碳中的溶解度大于在水中的溶解度,所以下层为四氯化碳的典溶液,为紫红色,上层为水,接近无色,故D正确。 10.下列离子检验的方法正确的是( ) A. 向某溶液中加入硝酸银溶液,生成白色沉淀,说明原溶液中有Cl- B. 向某溶液中加入氯化钡溶液,生成白色沉淀,说明原溶液中有 C. 向某溶液中加入氢氧化钠溶液,生成蓝色沉淀,说明原溶液中有Cu2+ D. 向某溶液中加入盐酸后有无色气体逸出,此气体能使澄清石灰水变浑浊,可判定含有 【答案】C 【解析】 【详解】A.加入硝酸银溶液,生成白色沉淀,可能为氯化银或碳酸银、硫酸银等沉淀,不能排除其它离子的干扰,应加入硝酸酸化的硝酸银进行检验,故A错误; B.加入氯化钡溶液,生成白色沉淀,不能排除氯化银的干扰,检验SO42-,应先加入盐酸,如无现象,再加入氯化钡溶液,故B错误; C. 氢氧化铜为蓝色,加入氢氧化钠溶液,生成蓝色沉淀,说明原溶液中有Cu2+,故C正确; D. 向某溶液中加入盐酸后有无色气体逸出,此气体能使澄清石灰水变浑浊,可判定含有,也可能是,故D错误; 正确答案是C。 11.胶体区别于其它分散系本质特征是( ) A. 胶体的分散质能透过滤纸 B. 胶体纯净物,其它分散系是混合物 C. 胶体能产生丁达尔现象 D. 胶体的分散质粒子直径在1~100 nm之间 【答案】D 【解析】 【详解】胶体区别于其它分散系的本质特征是胶体的分散质粒子直径在1~100 nm之间,故合理选项是D。 12.“纳米材料”是粒子直径为1nm~100nm(1nm=10-9m)的材料,纳米碳就是其中的一种。若将纳米碳均匀地分散到蒸馏水中,所形成的物质 ①是溶液 ②是胶体 ③能产生丁达尔效应 ④能透过滤纸 ⑤不能透过半透膜 ⑥静置后,会析出黑色沉淀。其中正确的是 A. ①④⑥ B. ②③④ C. ②③⑤ D. ②③④⑤ 【答案】D 【解析】 【详解】由于纳米碳直径在1nm~100nm之间,分散到蒸馏水中形成胶体,胶体能产生丁达尔效应,能透过滤纸,不能透过半透膜,是一种介稳体系,静置不会析出黑色沉淀,正确的有②③④⑤,答案选D。 13. 下列离子方程式中,正确的是( ) A. 稀硫酸滴在铜片上:Cu + 2H+ = Cu2+ + H2↑ B. 氧化镁和稀盐酸混合:MgO +2H+ = Mg2+ + H2O C. 铜片插入硝酸银溶液中:Cu + Ag+ = Cu2+ + Ag D. 稀盐酸滴在石灰石上:CO32- + 2H+ = H2O + CO2↑ 【答案】B 【解析】 试题分析:铜与稀硫酸不反应,与浓硫酸在加热的条件下才反应,A错;氧化镁为碱性氧化物与酸反应生成对应的盐和水,B正确;铜比银活泼,会置换出银,但该离子方程式电荷不守恒,C错;碳酸盐与酸反应分步发生,先生成碳酸氢根,再生成二氧化碳,当酸不足时仅生成碳酸氢根,D错。 考点:离子反应方程式的书写 点评:离子方程方是高中化学中考察的重点,重在考察学生对离子方程式书写的熟练程度,如离子方程式的书写应符合客观实事,电荷应守恒,微溶物,难溶物及弱电解质不可拆成离子式等几项注意事项。本题难度属中等 14.在下列各溶液中,离子一定能大量共存的是( ) A. 强碱性溶液中:K+、Al3+、Cl-、SO42— B. 在无色透明的溶液中:K+、Cu2+、NO3—、SO42— C. 含有0.1 mol·L−1 Ca2+的溶液中:Na+、K+、CO32—、Cl- D. 室温下,pH=1的溶液中:Na+、Fe3+、NO3—、SO42— 【答案】D 【解析】 试题分析:A、强碱性溶液含有OH-离子,与Al3+反应,生成Al(OH)3沉淀,故不能共存;B、溶液无色透明,故要排除Cu2+,错误;C、Ca2+与 CO32-形成沉淀,故错误;D、酸性溶液中,均共存。 考点:考查了离子共存的相关知识 15.下列名词中,哪个名词不属于物理量 A. 长度 B. 质量 C. 摩尔 D. 时间 【答案】C 【解析】 【详解】A.长度是国际单位制中七个基本物理量之一,故A不选; B.质量是国际单位制中七个基本物理量之一,故B不选; C.物质的量是国际单位制中七个基本物理量之一,其单位是摩尔,摩尔是物质的量的单位,不属于物理量,故C选; D.时间是国际单位制中七个基本物理量之一,故D不选; 答案选C。 16. 下列叙述正确的是( ) A. 1mol H2O的质量为18g/mol B. CH4的摩尔质量为16g C. 3.01×1023个SO2分子的质量为32g D. 标准状况下,1mol任何物质体积均为22.4L 【答案】C 【解析】 【详解】A. 1mol H2O的质量为1mol×18g/mol=18g,A错误; B. CH4的相对分子质量是16,摩尔质量为16g/mol,B错误; C. 3.01×1023个SO2分子的物质的量是0.5mol,质量为0.5mol×64g/mol=32g,C正确; D. 标准状况下,1mol任何气体的体积约为22.4L,D错误; 答案选C。 【点睛】注意摩尔质量与相对分子质量的区别:相对原子(分子)质量与摩尔质量(以g为单位时)不是同一个物理量,单位不同,只是在数值上相等。摩尔质量的单位为g·mol-1,相对原子(分子)质量的单位为1。 17.用NaOH固体配制一定物质的量浓度的NaOH溶液。下列操作中正确的是( ) A. 将固体氢氧化钠直接放在托盘天平左盘上称量 B. 将烧杯中溶解固体氢氧化钠所得溶液,冷却到室温后转移至容量瓶中 C. 定容时,如果加水超过刻度线,用胶头滴管直接吸出多余的部分 D. 定容、摇匀后,发现液体体积低于刻度线,再补加少量蒸馏水至刻度线 【答案】B 【解析】 A、氢氧化钠具有腐蚀性,易吸水,称量固体氢氧化钠时应该放在烧杯中称量,A错误;B、氢氧化钠溶于水放热,因此需要冷却到室温后转移至容量瓶中,B正确;C、定容时,如果加水超过刻度线,实验失败,需要重新配制,C错误;D、定容、摇匀后,发现液体体积低于刻度线,不能再补加少量蒸馏水至刻度线,否则浓度偏低,D错误,答案选B。 点睛:选项D是解答的易错点,注意定容、摇匀后,发现液体体积低于刻度线属于正常现象,不需要作任何处理。 18.用NA表示阿伏加德罗常数,下列叙述正确的是( ) A. 64 g SO2含有氧原子数NA B. 物质的量浓度为0.5 mol·L-1的MgCl2溶液,含有Cl-数为 NA C. 标准状况下,22.4 L H2O的分子数为NA D. 常温常压下,14 g N2含有分子数为0.5 NA 【答案】D 【解析】 【详解】A、64g二氧化硫的物质的量为1mol,1mol二氧化硫分子中含有2mol氧原子,含有氧原子数为2NA,故A错误; B、没有告诉氯化镁溶液的体积,无法计算溶液中氯离子的数目,故B错误; C、标况下水不是气体,不能使用标况下的气体摩尔体积计算水的物质的量,故C错误; D、14g氮气的物质的量为:=0.5mol,含有分子数为0.5NA,故D正确; 故选D。 19.某校化学兴趣小组在实验中发现一瓶溶液,标签上标有 “CaCl2 0.1 mol·L-1”的字样,下面是该小组成员对溶液的叙述,正确的是( ) A. 配制1 L该溶液,可将0.1 mol CaCl2溶于1 L水中 B. Ca2+和Cl-的物质的量浓度都是0.1 mol·L-1 C. 从试剂瓶中取该溶液的一半,则所取溶液的物质的量浓度为0.05 mol·L-1 D. 将该瓶溶液稀释一倍,则所得溶液的c(Ca2+)为 0.05 mol·L-1 【答案】D 【解析】 【详解】A.将0.1mol CaCl2溶于1L水中,所得溶液的体积大于1L,故A错误; B.在CaCl2中,Ca2+和Cl-的物质的量之比为1:2,则浓度之比也为1:2,故Ca2+的浓度为0.1mol/L,而Cl- 的浓度应为0.2mol/L,故B错误; C.溶液是均一稳定的,浓度与取出的溶液的体积是多少无关,故C错误; D.溶液中Cl-的浓度为0.2mol/L,将溶液稀释一倍,则浓度减半,故稀释后Cl-的浓度应为0.1mol/L,故D正确; 故选D。 【点睛】本题考查了溶液的配制方法和溶液中离子浓度的比值关系等问题,难度不大,掌握好基础知识是关键。 20.两个体积相同的容器,一个盛有一氧化氮,另一个盛有臭氧,则在同温同压下两容器内的气体一定具有相同的( ) A. 原子总数 B. 分子数总数 C. 质子总数 D. 质量 【答案】B 【解析】 【分析】 试题分析:由阿伏伽德罗定律可知,在相同条件下,相同体积的气体所含分子数相同,物质的量相同,由于一氧化氮是双原子分子,臭氧是三原子分子,则原子数不相同,原子中质子数不同,相同物质的量时两种气体所含质子数不同,由于二者的摩尔质量不同,则相同物质的量时二者质量不同。 【详解】A. 阿伏伽德罗定律可知,在相同条件下,相同体积的气体所含分子数相同,物质的量相同,由于一氧化氮是双原子分子,臭氧是三原子分子,则原子数不相同,故A错误; B. 由阿伏伽德罗定律可知,在相同条件下,相同体积的气体所含分子数相同,物质的量相同,故B正确; C. 原子中质子数不同,相同物质的量时两种气体所含质子数不同,故C错误; D. 由于二者的摩尔质量不同,则相同物质的量时二者质量不同,故D错误; 故选B。 【点睛】本题考查阿伏伽德罗定律以及相关物理量的计算,题目难度不大,注意组成原子的构成特点。 第Ⅱ卷 (非选择题共40分) 21.(1)无机化合物可以根据其组成和性质进行分类: 上图所示的物质分类方法名称是________。 (2)现有以下物质:①NaCl晶体 ②液态SO3 ③液态的醋酸 ④汞 ⑤BaSO4固体 ⑥蔗糖(C12H22O11) ⑦酒精(C2H5OH) ⑧熔融的K2SO4 ⑨纯水。请回答下列问题(用序号): 以上物质中能导电的是________属于电解质的是__________属于非电解质的是______________ 【答案】 (1). 树状分类法 (2). ④⑤ (3). ①⑤⑧⑨ (4). ②⑥⑦ 【解析】 【详解】(1)图示方法将无机化合物分成酸、碱、盐、氧化物、氢化物等,按照层次,符合树状分类的特点,属于树状分类,故答案为:树状分类法; (2)①NaCl晶体不能导电,在水溶液中能导电,是电解质;②液态SO3不能导电,是非电解质;③液态的醋酸属于酸,在水溶液中能导电,是电解质;④汞是金属单质,能导电,既不是电解质也不是非电解质;⑤BaSO4固体是盐,熔融状态下能导电,是电解质;⑥蔗糖(C12H22O11)是有机物,在水溶液和熔融状态下都不导电,是非电解质;⑦酒精(C2H5OH)是有机物,在水溶液和熔融状态下都不导电,是非电解质;⑧熔融的K2SO4是盐,可以导电,是电解质;⑨纯水是电解质,不能导电;以上物质中能导电的是④⑤;属于电解质的是①⑤⑧⑨;属于非电解质的是②⑥⑦。 【点睛】本题考查物质的导电性的判断,电解质、非电解质概念的辨析,难度不大.解题时紧抓住电解质必须是化合物,以及导电是在水溶液或熔化状态下为条件。 22.(1)写出下列物质的电离方程式: ①H2SO4: ________ ②NaOH: ________ ③Fe2(SO4)3: ________ (2)写出下列化学反应的离子方程式: ①氢氧化钠与盐酸反应:________ ②铁片与硫酸的反应:________ ③硫酸铜与氢氧化钡的反应:________ 【答案】 (1). H2SO4=2H++SO42- (2). NaOH=Na++OH- (3). Fe2(SO4)3=2Fe3++3SO42- (4). H++OH-=H2O (5). Fe+2H+=H2↑+Fe2+ (6). Cu2+ +SO42- +Ba2+ +2OH- =BaSO4+Cu(OH)2 【解析】 【详解】(1)①硫酸在溶液中完全电离出硫酸根离子和氢离子,电离方程式为:H2SO4=2H++SO42-;②氢氧化钠是强电解质,能完全电离,电离方程式为:NaOH=Na++OH-;③硫酸铁是盐,属于强电解质,电离方程式为:Fe2(SO4)3=2Fe3++3SO42-; (2)①盐酸与NaOH溶液反应生成氯化钠和水,离子方程式为:H++OH-=H2O;故答案为:H++OH-=H2O;②铁和稀硫酸反应生成硫酸亚铁和氢气,离子方程式:Fe+2H+=H2↑+Fe2+;故答案为:Fe+2H+=H2↑+Fe2+;③CuSO4溶液与Ba(OH)2溶液反应生成硫酸钡和氢氧化铜沉淀,离子方程式为:Cu2+ +SO42- +Ba2+ +2OH- =BaSO4+Cu(OH)2;故答案为:Cu2+ +SO42- +Ba2+ +2OH- =BaSO4+Cu(OH)2 23.如下图所示是中学化学中常用于混合物分离和提纯的装置: 请根据装置图回答下列问题: (1)从氯化钾溶液中得到氯化钾固体选择装置________(填代表装置图的字母,下同);除去自来水中的Cl-等杂质得到蒸馏水,选择装置________。 (2)从碘水中分离出I2 ,选择装置________,该分离方法的名称为________。 (3)装置A中①的名称是________,冷凝水流动的方向_________。 (4)在用装置B进行操作时,为使液体顺利滴下,应进行的具体操作是___________。分液时下层液体从分液漏斗的________(填“上口”或“下口”)转移到烧杯中。 【答案】 (1). D (2). A (3). B (4). 萃取分液 (5). 冷凝管 (6). 下口进,上口出 (7). 先打开分液漏斗颈上的玻璃塞,再打开下面的活塞 (8). 下口 【解析】 【详解】(1)从氯化钾溶液中得到氯化钾固体应蒸发结晶,选用装置D,除去自来水中的Cl- 等杂质得到蒸馏水,应采用蒸馏的方法,选择装置A,故答案为:D、A; (2)从碘水中分离出I2,应采用萃取和分液的方法,选择装置B,故答案为:B、萃取分液; (3)注意冷凝水是从下口进,上口出,充分利用逆流的原理,故答案为:冷凝管;从下口进,上口出; (4)在使用分液漏斗进行操作时,如果上口关闭,则装置内的压强会逐渐减小,导致液体无法流出。此时,可打开上口部的塞子,或使塞子上的小孔(或凹槽)对准漏斗口上的小孔。当下层液体放完时,应及时关闭活塞,防止上层液体流下。分液漏斗内上层液体从上口倒出,故答案为:先打开分液漏斗颈上的玻璃塞,再打开下面的活塞;下口。 【点睛】本题主要考查了萃取分液的实验操作,特别要注意一个操作细节为:在使用分液漏斗进行分液操作时,须打开上口部的塞子,或使塞子上的小孔(或凹槽)对准漏斗口上的小孔,使分液漏斗上部气体与大气相通,利于液体顺利流出。 24.Ⅰ.实验室要配制500 mL 0.2 mol/L NaOH溶液,请回答下列问题: (1)配制过程中不需要使用的化学仪器有________(填字母)。 A 烧杯 B 500 mL容量瓶 C 漏斗 D 胶头滴管 E 玻璃棒 (2)用托盘天平称取氢氧化钠,其质量为________ g。 (3)下列主要操作步骤的正确顺序是________(填序号)。 ①称取一定质量的氢氧化钠,放入烧杯中,用适量蒸馏水溶解; ②加水至液面离容量瓶瓶颈刻度线下1~2 cm时,改用胶头滴管滴加蒸馏水至凹液面与刻度线相切; ③待冷却至室温后,将溶液转移到500 mL容量瓶中; ④盖好瓶塞,反复上下颠倒,摇匀; ⑤用少量蒸馏水洗涤烧杯内壁和玻璃棒2~3次,洗涤液转移到容量瓶中。 (4)如果实验过程中缺少步骤⑤,会使配制出的NaOH溶液浓度_______(填“偏高、偏低”或“不变”)。 Ⅱ.如图实验室某浓盐酸试剂瓶标签上的有关数据,试根据标签上的有关数据回答下列问题: (1)该浓盐酸中HCl的物质的量浓度为______ mol/L。 (2)取用任意体积的该盐酸溶液时,下列物理量中不随所取体积的多少而变化的是______。 A 溶液中HCl的物质的量 B 溶液的浓度 C 溶液中Cl-的数目 D 溶液的密度 (3)某学生欲用上述浓盐酸和蒸馏水配制500 mL物质的量浓度为0.400 mol/L的稀盐酸。该学生需要量取______mL上述浓盐酸进行配制。 Ⅲ.现有0.27Kg质量分数为10%的CuCl2溶液,则溶液中CuCl2的物质的量为___________ 【答案】 (1). C (2). 4.0g (3). ①③⑤②④ (4). 偏低 (5). 11.9 (6). BD (7). 16.8 (8). 0.2 【解析】 【详解】Ⅰ.(1)溶液配制过程中需要烧杯溶解固体,需要500mL容量瓶配制溶液,需要胶头滴管定容,需要玻璃棒搅拌和引流,所以没有用到的是漏斗,故选C; (2)用托盘天平称取氢氧化钠,其质量为m=c×V×M=0.2mol/L×0.5L×40g/mol=4.0g,故答案为:4.0g; (3)实验操作步骤:计算、称量、溶解、移液、洗涤移液、定容、摇匀等操作进行排序,所以其排列顺序为:①③⑤②④,故答案为:①③⑤②④; (4)因洗涤液中含有溶质,未将洗涤液转入容量瓶,溶质的质量减少,浓度偏低,故答案为:偏低; Ⅱ.(1)设盐酸的体积为1L,则溶质的质量为1000mL×1.19g ▪cm -3 ×36.5%,溶质的物质的量为 =11.9mol,所以溶质的物质的量浓度为 =11.9mol/L,故答案为:11.9; (2)A.n=cV,所以与溶液体积有关,故A错误;B.溶液的浓度是均一稳定的,与所取溶液的体积无关,故B正确;C.N=nN A =cVN A ,所以与溶液体积有关,故C错误; D.溶液的密度是均一的,所以与所取溶液的体积无关,故D正确;故选:BD; (3)根据溶液稀释前后溶质的量不变可知,V(浓盐酸)×11.9=0.400mol·L-1×0.5L,V(浓盐酸)= 0.0168L=16.8mL;综上所述,本题答案是:16.8; Ⅲ. 根据质量分数,可以求得氯化铜溶液中含有氯化铜的质量为:0.27Kg×0.1=0.027Kg,即为27g氯化铜溶液,求得其物质的量为 =0.2mol; 查看更多