- 2021-04-27 发布 |
- 37.5 KB |
- 10页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
四川省新津中学高 2016 级高二下入学考试化学试题
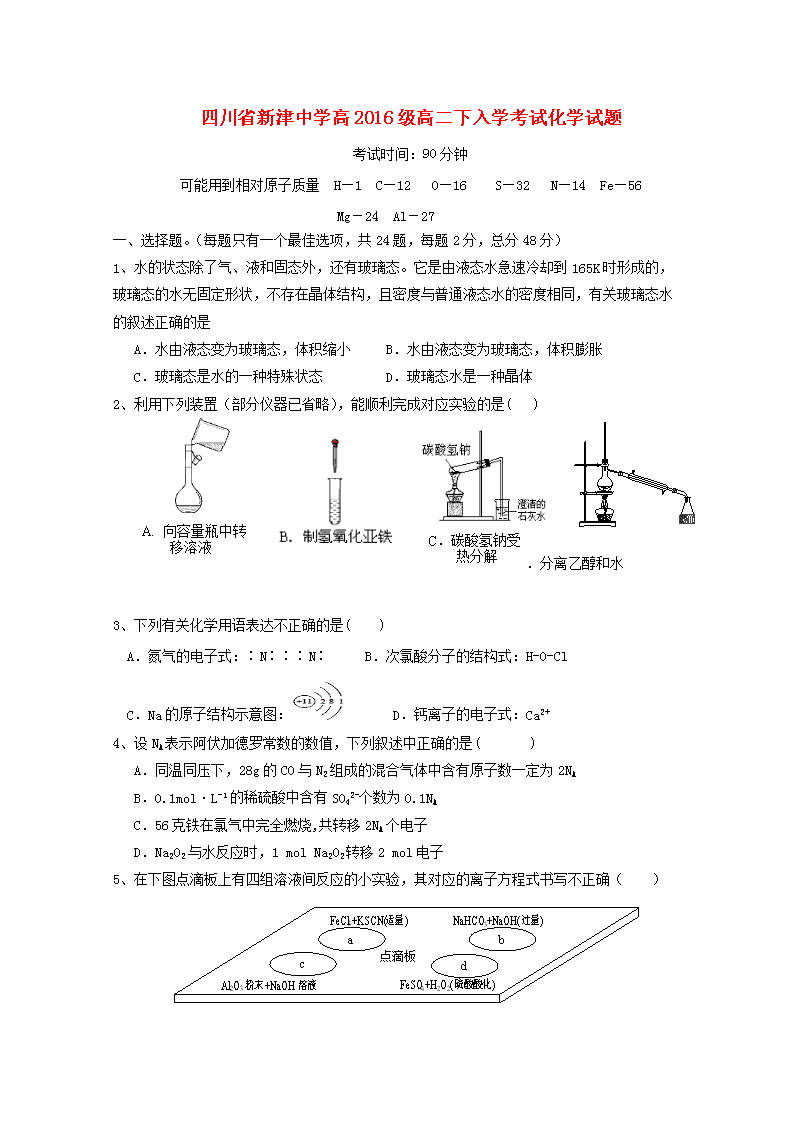
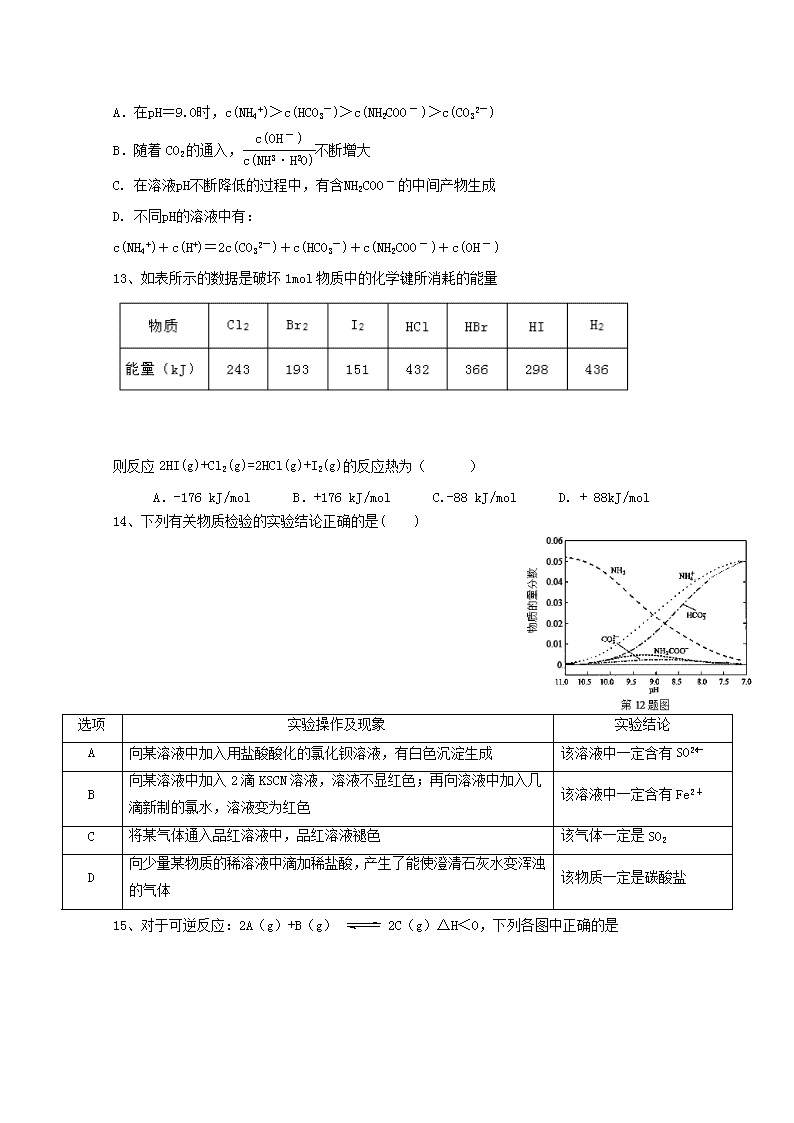
四川省新津中学高 2016 级高二下入学考试化学试题 考试时间:90 分钟 可能用到相对原子质量 H—1 C—12 O—16 S—32 N—14 Fe—56 Mg-24 Al-27 一、选择题。(每题只有一个最佳选项,共 24 题,每题 2 分,总分 48 分) 1、水的状态除了气、液和固态外,还有玻璃态。它是由液态水急速冷却到 165K 时形成的, 玻璃态的水无固定形状,不存在晶体结构,且密度与普通液态水的密度相同,有关玻璃态水 的叙述正确的是 A.水由液态变为玻璃态,体积缩小 B.水由液态变为玻璃态,体积膨胀 C.玻璃态是水的一种特殊状态 D.玻璃态水是一种晶体 2、利用下列装置(部分仪器已省略),能顺利完成对应实验的是( ) D.分离乙醇和水 3、下列有关化学用语表达不正确的是( ) A.氮气的电子式:∶N∶∶∶N∶ B.次氯酸分子的结构式:H-O-Cl C.Na 的原子结构示意图: D.钙离子的电子式:Ca2+ 4、设 NA 表示阿伏加德罗常数的数值,下列叙述中正确的是( ) A.同温同压下,28g 的 CO 与 N2 组成的混合气体中含有原子数一定为 2NA B.0.1mol·L-1 的稀硫酸中含有 SO4 2-个数为 0.1NA C.56 克铁在氯气中完全燃烧,共转移 2NA 个电子 D.Na2O2 与水反应时,1 mol Na2O2 转移 2 mol 电子 5、在下图点滴板上有四组溶液间反应的小实验,其对应的离子方程式书写不正确( ) A. 向容量瓶中转 移溶液 C.碳酸氢钠受 热分解 a 点滴板 c b d FeCl3+KSCN(适量) NaHCO3+NaOH(过量) Al2O3 粉末+NaOH 溶液 FeSO4+H2O2(硫酸酸化) A.a反应:Fe3+ + 3SCN-=Fe(SCN)3 B.b反应:HCO3 -+ OH-=CO3 2-+ H2O C.c反应:Al2O3+2OH-=2AlO2 -+H2O D.d反应:Fe2++ 2H++ H2O2=Fe3++ 2H2O 6、常温下,下列各组离子在指定条件下一定能大量共存的是 A 由水电离的 c(H+)=10-12mol/L 的澄清溶液中:K+、Na+、MnO4 -、SO4 2- B.c(NH4 +) =0.1 mol/L 的溶液中:Na+、Cl-、OH-、SO4 2- C. c(H+)/ c(OH-)=1010 的溶液中:NH4 +. Ba2+、ClO-、Cl- D.加入少量铝粉后能产生氢气的溶液中:NH4 +、Fe2+、NO3 -、SO4 2- 7、向 m 克 Mg 和 Al 的混合物中加入足量的盐酸,充分反应后再向溶液中加入过量的 NaOH 溶 液,过滤,将沉淀充分灼烧,得到的固体仍为 m 克,则原混合物中 Al 的质量百分数为( ) A、50% B、40% C、47% D、70% 8、用漂白粉溶液浸泡过的有色布条,如果晾置在空气中,过了一段时间,其漂白效果会更好 的原因可能是 ( ) A、漂白粉被氧化 B、有色布条被空气中的氧气氧化 C、漂白粉跟空气中的CO2反应,生成较多 HClO D、漂白粉溶液蒸发掉部分水,其浓度增 大 9、下列有关物质分类的说法中正确的是( ) A.石英玻璃、普通玻璃主要成分都属于硅酸盐 B.CH2Cl2、C2H6 都是纯净物 C.煤、石油都属于可再生能源 D.纯碱、烧碱都属于碱类物质 10、硫与硒位于元素周期表中第ⅥA 族,下列对硫与硒元素的有关叙述中,正确的是( ) A.硒化氢比硫化氢稳定 B. 氯气能与水反应而硫不能与水反应,说明氯元素非金属性强于硫 C. H2SeO4 的酸性比 H2SO4 强 D.硒的原子半径比硫的大 11、一定条件下硝酸铵受热分解的化学方程式为:5NH4NO3 △ 2HNO3+4N2+9H2O,在反应中被 氧化与被还原的氮原子数之比为 ( ) A.5∶3 B.5∶4 C.1∶1 D.3∶5 12、40℃时,在氨-水体系中不断通入CO2,各种离子的变化趋势如下图所示。下列说法不正 确的是 A.在pH=9.0时,c(NH4 +)>c(HCO3 -)>c(NH2COOˉ)>c(CO3 2-) B.随着 CO2 的通入, c(OHˉ) c(NH3·H2O) 不断增大 C. 在溶液pH不断降低的过程中,有含NH2COOˉ的中间产物生成 D. 不同pH的溶液中有: c(NH4 +)+c(H+)=2c(CO3 2-)+c(HCO3 -)+c(NH2COOˉ)+c(OHˉ) 13、如表所示的数据是破坏 1mol 物质中的化学键所消耗的能量 则反应 2HI(g)+Cl2(g)=2HCl(g)+I2(g)的反应热为( ) A.-176 kJ/mol B.+176 kJ/mol C.-88 kJ/mol D. + 88kJ/mol 14、下列有关物质检验的实验结论正确的是( ) 选项 实验操作及现象 实验结论 A 向某溶液中加入用盐酸酸化的氯化钡溶液,有白色沉淀生成 该溶液中一定含有 SO2- 4 B 向某溶液中加入 2 滴 KSCN 溶液,溶液不显红色;再向溶液中加入几 滴新制的氯水,溶液变为红色 该溶液中一定含有 Fe2+ C 将某气体通入品红溶液中,品红溶液褪色 该气体一定是 SO2 D 向少量某物质的稀溶液中滴加稀盐酸,产生了能使澄清石灰水变浑浊 的气体 该物质一定是碳酸盐 15、对于可逆反应:2A(g)+B(g) 2C(g)△H<0,下列各图中正确的是 16、在 t℃时,AgBr 在水中的沉淀溶解平衡曲线如图所示.又知 t℃时 AgCl 的 Ksp=4×10-10,下列说法不正确的是 A.在 t℃时,AgBr 的 Ksp 为 4.9×l0-13 B.在 AgBr 饱和溶液中加入 NaBr 固体,可使溶液由 c 点到 b 点 C.图中 a 点对应的是 AgBr 的不饱和溶液 D.在 t℃时,AgCl(s)+Br-(aq)⇌ AgBr(s)+Cl-(aq)平衡常数 K≈816 17、把在空气中久置的铝片 5.0 g 投入盛有 500 mL 0.5 mol·L-1 硫酸溶液的烧杯中,该铝片 和硫酸反应产生氢气的速率 v 与反应时间 t 可用如图所示的坐标曲线来表示。下列推论错误 的是( ) A.O→a 段不产生氢气是因为表面的氧化物阻碍了铝和硫酸溶液的接触 B.b→c 段产生氢气的速率增加较快的主要原因之一是温度升高 C.t=c 时反应达到平衡状态 D.t>c 时产生氢气的速率降低主要是因为溶液中 c(H+)降低 18、相同温度下,等物质的量浓度的下列溶液中,pH 最小的是 A.NH4Cl B.NH4HSO3 C.NH4HSO4 D. (NH4)2SO4 19、酸碱中和滴定原理在产品检验、水质抽样检查中有重要应用。将未知浓度的 NaOH 溶液装 入锥形瓶中,用一定浓度的 HCl 标准溶液来滴定,下列说法正确的是( ) A.滴定时右手摇动锥形瓶,左手控制滴定管活塞,操作如图 B.读取标准液的刻度时,滴定前平视,滴定后俯视,会使测定结果偏大 C.滴定临近终点时,用洗瓶中的蒸馏水洗下滴定管尖嘴口的半滴标准溶液至锥形瓶中,对 测定结果无影响。 D.若用甲基橙作指示剂,最后一滴盐酸滴入使溶液由橙色变为红色。 20、如果慢慢加热蒸干并灼烧下列溶液,可以得到该溶液溶质固体的是 A.高锰酸钾 B.亚硫酸钠 C.硝酸铝 D.碳酸钾 21、有关①100ml 0.1 mol/L NaHCO3、②100ml 0.1 mol/L Na2CO3 两种溶液的叙述不正确的是 A.溶液中水电离出的 H+个数:②>① B.溶液中阴离子的物质的量浓度之和:②>① C.①溶液中: c (CO3 2-) ﹥ c(H2CO3) D.②溶液中: c (HCO3 -) ﹥ c(H2CO3) 22、平衡常数的分析正确的是 H2CO3 HBO3(硼酸) K1=4.4×10-7 K2=4.7×10-11 K=5.8×10-10 A.向饱和硼酸溶液中滴加 Na2CO3 溶液,无反应发生 B.等浓度的碳酸钠和硼酸钠溶液:pH(碳酸钠)< pH(硼酸钠) C.硼酸为三元酸 D.向饱和硼酸溶液中滴加 Na2CO3 溶液,无气体产生 23、甲壳素(chitin)又名甲壳质、壳多糖、壳蛋白,是法国科学家布拉克诺(Braconno)1811 年从蘑菇中发现的一种有用的、物质。有关专家认为,甲壳素是继蛋白质、油脂、糖、维生 素和微量元素外维持人体生命的第六要素。以下关于糖类、油脂和蛋白质这三大营养物质的 叙述正确的是( ) A.糖类、油脂、蛋白质都能发生水解反应 B.淀粉水解的最终产物不能发生银镜反应 C.多糖、油脂、蛋白质都属于高分子化合物 D.脂肪能发生皂化反应,生成甘油和高级脂肪酸盐 24、分子式为 C5H10O2 的有机物在酸性条件下可水解为酸和醇,若不考虑立体异构,该酯可能的 同分异构体共有( ) A.8 种 B.9 种 C.10 种 D.11 种 第Ⅱ卷 非选择题(4 个题,共 52 分) 25、(共 12 分)X、Y 和 Z 均为短周期元素,原子序数依次增大,X 的单质为密度最小的气体, Y 原子最外层电子数是其周期数的三倍,Z 与 X 原子最外层电子数相同。回答下列问题: (1)X、Y 的元素名称分别为 、 Y 元素的原子结构示意图_____________ (2)由上述元素组成的化合物中,既有共价键又有离子键的有 、 (填 化学式) (3)X 与 Z 可形成一种离子化合物,其电子式为___________ 它与水能剧烈反应放出无色气体,对应的化学方程式为: 。 (4)X 和 Y 组成的化合物中,既含有极性共价键又含有非极性共价键的是 (填结构 式),该化合物的溶沸点较高的原因是: ; 此化合物在酸性条件下与高锰酸钾反应产生一种无色气体,该反应的离子方程式为: ; 26、(共 12 分)汽车尾气中含有 CO、NO2 等有毒气体,对汽车加装尾气净化装置,可使有毒 气体相互反应转化为无毒气体 CO2 和 N2 等。 (1)汽车尾气中 CO、NO2 气体在一定条件下可以发生反应: 4CO(g)+2NO2(g) 4CO2(g)+N2(g) ΔH=-1200 kJ·mol-1。恒温恒容条件下,不能说明该反 应已达到平衡状态的是________(填序号); A.容器内混合气体颜色不再变化 B.容器内的压强保持不变 C.2v 逆(NO2)=v 正(N2) D.容器内混合气体密度保持不 变 对于该反应,温度不同(T2>T1)、其他条件相同时,下列图象正确的是______(填代号). 汽车尾气中的 CO 与 H2O(g)在一定条件下可以发生反应: CO(g)+H2O(g) CO2(g)+H2(g)ΔH<0; 某温度时在甲、乙、丙三个恒容密闭容器中,起始时 按照右表进行投料,达到平衡状态时 K=81。 起始物质的量 甲 乙 丙 n(H2O)/mol 0.10 0.20 0.20 n(CO)/mol 0.10 0.10 0.20 (2)平衡时,甲容器中 CO 的转化率是 ;平衡时,比较容器中 H2O 的转化率: 乙 甲(填“>”、“<”或“=”,下同);丙 甲。 (3)已知温度为 T 时:CH4(g)+2H2O(g)=CO2(g)+4H2(g) △H=+165 KJ•mol CO(g)+H2O(g)=CO2(g)+H2(g) △H=-41 KJ•mol 。贮氢合金 ThNi5 可催化由 CO、H2 合 成 CH4 的 反 应 , 温 度 为 T 时 , 该 反 应 的 热 化 学 方 程 式 是 ___________________________________。 27、(16 分)Na2S2O3 是重要的化工原料,易溶于水。在中性或碱性环境中稳定。 I.制备 Na2S2O3•5H2O 反应原理:Na2SO3(aq)+S(s)△ Na2S2O3(aq) 实验步骤: ①称取 15 g Na2SO3 加入圆底烧瓶中,再加入 80 ml 蒸馏水,另取 5 g 研 细的硫粉,用 3 ml 乙醇润湿,加入上述溶液中 ②安装实验装置(如图所示,部分夹持装置略去),水浴加热,微沸 60 分钟。 ③趁热过滤,将滤液水浴加热浓缩,冷却析出 Na2S2O3•5H2O,经过滤, 洗涤,干燥,得到产品。 回答问题: (1)硫粉在反应前用乙醇润湿的目的是_________。 (2)仪器 a 的名称是_________,其作用是_________。 (3)产品中除了有未反应的 Na2SO3 外,最可能存在的无机杂质是_________, 检 验 是 否 存 在 该 杂 质 的 方 法 是 。 (4)该实验一般控制在碱性环境下进行,否则产品发黄,用离子方程式表 示其原因: 。 II.测定产品纯度: 准确称取 W g 产品,用适量蒸馏水溶解,以淀粉作指示剂,用 0.1000 mol•L¯1 碘的标准 溶液滴定。反应原理为:2S2O2-3+I2=S4O2-6+2I¯ ←水 a ← (5)滴定至终点时,溶液颜色的变化:_________。 (6)滴定起始和终点的液面位置如图,则消耗碘的标准溶液体积为_______mL。 产品的纯度为(设 Na2S2O3•5H2O 相对分子质量为 M)_________。 III.Na2S2O3 的应用 (7)Na2S2O3 还原性较强,在水溶液中易被 Cl2 氧化成 SO2-4,常用作脱氯剂,该反应的 离子方程式为 。 28、(12 分)卤块的主要成分是 MgCl2,此外还含 Fe2+、Fe3+和 Mn2+等杂质离子。以卤块为原料 按下图所示流程进行生产,可制得轻质氧化镁。 查阅资料得下表相关数据: 表 1: 生成氢氧化物沉淀的 pH 表 2: 原料价格表 物质 开始沉淀 沉淀完全 物质 价格(元/吨) Fe(OH)3 2.7 3.7 a.漂液(含 25.2%NaClO) 450 Fe(OH)2 7.6 9.6 b.双氧水(含 30%H2O2) 2400 Mn(OH)2 8.3 9.8 c.烧碱(含 98%NaOH) 2100 Mg(OH)2 9.6 11.1 d.纯碱(含 99.5%Na2CO3) 600 Fe2+氢氧化物呈絮状,不易从溶液中除去,必须将它氧化后以 Fe(OH)3 沉淀形式才能除尽。 若要求产品尽量不含杂质且生产成本较低,请根据上表提供的资料回答: (1)流程中加入的试剂 X、Y、Z 最佳选择依次是表 2 中的 (选 填试剂编号)。 ( 2 ) 步 骤 ② 发 生 反 应 的 离 子 方 程 式 为 ; 步 骤 ⑤ 中 发 生 反 应 的 化 学 方 程 为 。 ( 3 ) 步 骤 ③ 控 制 pH=9.8 的 目 的 是 。 ( 4 ) 若 在 实 验 室 进 行 步 骤 ⑥ 的 灼 烧 实 验 , 必 须 用 到 的 仪 器 是 三 脚 架 、 酒 精 喷 灯、 和泥三角。 (5)在探究 Mg(OH)2 溶解性的实验中,发现向装有少量 Mg(OH)2 浊液的试管中加入适量 NH4Cl 晶体,充分振荡后溶液会变澄清,请用化学平衡的原理解释浊液变澄清的原因 。查看更多