- 2021-04-27 发布 |
- 37.5 KB |
- 9页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2018-2019学年山西大学附属中学高一上学期期中考试 化学
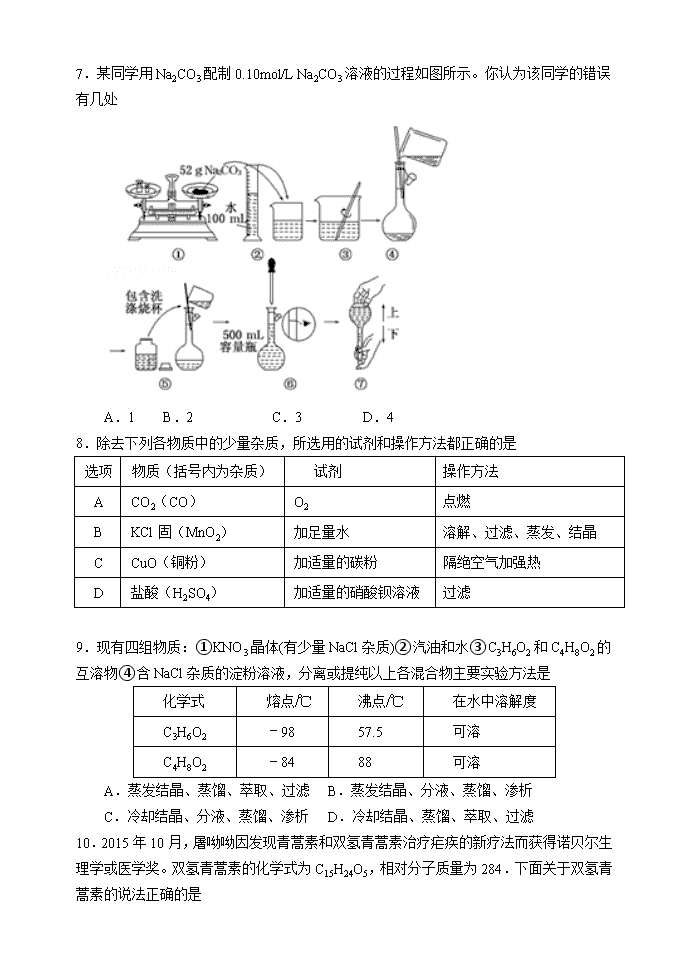
2018-2019学年山西大学附属中学高一上学期期中考试 化学 试题分数 100分 答题时间90分钟 相对原子质量: H-1 C-12 N-14 O-16 S-32 Cl-35.5 Na-23 Fe-56 一.选择题(共44分,包括22小题,每小题只有一个正确选项) 1.下列说法中正确的是 A.在任何条件下,1 mol任何气体的体积都约是22.4 L B.空气中的PM2.5颗粒物(直径2.5微米左右)属于胶体粒子 C.科学家提出的假说一定能成为科学理论 D.在氧化还原反应中,还原剂和氧化剂可能是同一物质 2.在标准状况下:①6.72L CH4②3.01×1023个HCl分子 ③17.6g CO2④0.2mol Cl2,下列对这四种气体的关系从大到小表达正确的是 A.体积:②>③>④>① B.密度:④>③>②>① C.质量:③>②>④>① D.原子数:③>①>④>② 3.已知NA为阿伏伽德罗常数的数值,下列说法不正确的是 A.硫酸的摩尔质量与NA个硫酸分子的质量在数值上相等 B.常温常压下,17gNH3所含有的原子数为4NA C.500mL0.2mol•L﹣1的Ba(NO3)2溶液中NO3﹣的物质的量浓度为0.4mol•L﹣1 D.22g二氧化碳与11.2L的HCl含有相同的分子数 4.1g CO中含a个原子,则阿伏加德罗常数的值NA可表示为 A.mol﹣1 B.mol﹣1 C.14a mol﹣1 D.28a mol﹣1 5.宋代《开宝本草》中记载了KNO3的提纯方法“……所在山泽,冬月地上有霜,扫取以水淋汁后,乃煎炼而成”,这里不涉及到的操作方法是 A.蒸馏 B.蒸发 C.结晶 D.溶解 6.每年10月23日上午6:02到晚上6:02被誉为“摩尔日“(Mole Day),这个时间的美式写法为6:02 10/23,外观与阿伏加德罗常数6.02×1023相似。NA为阿伏加德罗常数的值,下列说法正确的是 A.标准状况下22.4 LH2与11.2LO2充分反应,产物的分子数为NA B.0.1mol/L的Na2SO4溶液中,SO42﹣数目是0.1NA C.标准状况下.22.4L氧气与足量铁粉完全反应,转移的电子数为3NA D.0.1molNH4+的质子数为NA 7.某同学用Na2CO3配制0.10mol/L Na2CO3溶液的过程如图所示。你认为该同学的错误有几处 A.1 B.2 C.3 D.4 8.除去下列各物质中的少量杂质,所选用的试剂和操作方法都正确的是 选项 物质(括号内为杂质) 试剂 操作方法 A CO2(CO) O2 点燃 B KCl固(MnO2) 加足量水 溶解、过滤、蒸发、结晶 C CuO(铜粉) 加适量的碳粉 隔绝空气加强热 D 盐酸(H2SO4) 加适量的硝酸钡溶液 过滤 9.现有四组物质:①KNO3晶体(有少量NaCl杂质)②汽油和水③C3H6O2和C4H8O2的互溶物④含NaCl杂质的淀粉溶液,分离或提纯以上各混合物主要实验方法是 化学式 熔点/℃ 沸点/℃ 在水中溶解度 C3H6O2 ﹣98 57.5 可溶 C4H8O2 ﹣84 88 可溶 A.蒸发结晶、蒸馏、萃取、过滤 B.蒸发结晶、分液、蒸馏、渗析 C.冷却结晶、分液、蒸馏、渗析 D.冷却结晶、蒸馏、萃取、过滤 10.2015年10月,屠呦呦因发现青蒿素和双氢青蒿素治疗疟疾的新疗法而获得诺贝尔生理学或医学奖。双氢青蒿素的化学式为C15H24O5,相对分子质量为284.下面关于双氢青蒿素的说法正确的是 A.14.2g双氢青蒿素中含有的原子总数为2.2NA B.双氢青蒿素的摩尔质量等于它的相对分子质量 C.1mol双氢青蒿素的质量为284g•mol﹣1 D.1mol双氢青蒿素含有6.02×1023个碳原子 11.目前科学家己发现人体中的气体信号分子有NO、CO和H2S三种,下列说法正确的是 A.NO、CO都属于酸性氧化物 B.NO、CO、H2S均属于电解质 C.H2S既有氧化性又有还原性 D.2NO+2CO N2+2CO2属于置换反应 12.下列关于胶体的叙述不正确的是 A.胶体区别于其他分散系的本质特征是分散质的微粒直径在10﹣9~10﹣7m之间B.光线透过胶体时,胶体可发生丁达尔效应 C.将氯化铁浓溶液与氢氧化钠浓溶液混合,可制得Fe(OH)3胶体 D.向Fe(OH)3胶体中逐滴加入过量稀硫酸,可观察到“先沉淀后溶解”现象 13.下列物质的分类合理的是( ) A.非电解质:氨气、酒精、氯气 B.混合物:盐酸、碱石灰、纯牛奶 C.碱:烧碱、纯碱、氢氧化钡 D.酸性氧化物:CO2、SiO2、Na2O 14.某无色透明的溶液中,能大量共存的离子组是( ) A.Ag+、K+、NO3﹣、Cl﹣ B.Ca2+、Fe3+、Cl﹣、NO3﹣ C.Mg2+、Na+、Cl﹣、SO42﹣ D.H+、NH4+、Na+、CH3COO﹣ 15.下列离子方程式正确的是( ) A.氧化铜与稀硫酸反应:CuO+2H+ ═ Cu2++H2O B.向碳酸镁中加入足量稀醋酸:MgCO3+2H+═Mg2++CO2↑+H2O C.用三氯化铁溶液制取氢氧化铁胶体:Fe3++3H2O═Fe(OH)3↓+3H+ D.硫酸镁溶液与氢氧化钡溶液反应: SO42﹣+Ba2+﹣═BaSO4↓ 16.下列有关反应Cr2O72﹣+3SO32﹣+aH+═2Cr3++3Y+4H2O的说法不正确的是 A.Y是SO42﹣ B.a=8 C.Cr2O72﹣被还原成Cr3+ D.生成1mol Cr3+时转移的电子数是6×6.02×1023 17.下列氧化还原反应中,实际参加反应的氧化剂与还原剂的物质的量之比正确的是①KClO3+6HCl(浓)═KCl+3Cl2↑+3H2O;1:6 ②Fe2O3+2AlAl2O3+2Fe;1:2 ③SiO2+3CSiC(硅为+4价)+2CO↑;1:2 ④3NO2+H2O═2HNO3+NO;2:1 A.①③ B.②③ C.②④ D.①④ 18.硫代硫酸钠可用作脱氯剂,已知25.0 mL 0.1 mol·L-1的Na2S2O3溶液恰好把标准状况下112 mL Cl2完全转化为Cl-时,S2O32-转化成 A.S2- B.S C.SO32- D.SO42- 19.赤铜矿的主要成分是氧化亚铜(Cu2O),辉铜矿的主要成分是硫化亚铜(Cu2S),将赤铜矿与辉铜矿混合加热有如下反应: Cu2S+2Cu2O 6Cu+SO2↑ 下列对于该反应的说法中,正确的是 A.该反应中的氧化剂只有Cu2O B.Cu2S在反应中只做还原剂 C.Cu既是氧化产物又是还原产物 D.氧化产物与还原产物的物质的量之比为1:6 20.向盛有一定量Ba(OH)2溶液的烧杯中逐滴加入稀硫酸,直至过量,整个过程中混合溶液的导电能力(用电流强度Ⅰ表示)近似的用下图中曲线表示的是 21.已知常温下,在溶液中发生如下反应:①16H++10Z﹣+2XO4﹣=2X2++5Z2+8H2O ②2A2++B2=2A3++2B﹣③2B﹣+Z2=B2+2Z﹣由此推断,下列说法中正确的是 A.反应Z2+2A2+=2A3++2Z﹣不可以进行 B.氧化性由强到弱的顺序是XO4﹣、Z2、B2、A3+ C.Z元素在①③反应中均被还原 D.还原性由强到弱的顺序是Z﹣、B﹣、A2+、X2+ 22.某工厂的工业废水中含有大量的Fe2+、SO42﹣和较多的Cu2+及少量的Na+.为了减少污染并变废为宝,工厂计划从该废水中回收硫酸亚铁和金属铜。请根据流程图分析推断,下列说法不正确的是 A. 操作⑨是:蒸发浓缩、冷却结晶、过滤 B. 加入的试剂①⑤分别是:铁粉和稀硫酸 C. 物质④⑧都是溶有相同溶质的溶液 D. 物质③和⑦都有金属铜 二、非选择题(共56分,包括5小题) 23.(12分)(1)“纳米材料”是粒子直径为1nm~100nm的材料,纳米碳就是其中的一种。某研究所将纳米碳均匀的分散到蒸馏水中,得到的物质:①是溶液 ②是胶体 ③具有丁达尔效应 ④不能透过滤纸 ⑤能透过半透膜 其中说法不正确的是 。(填序号,下同) (2)下列物质:①水银 ②烧碱 ③SO3 ④液态氯化钠 ⑤盐酸 ⑥氨气 ⑦乙醇溶液 ⑧蔗糖 ⑨液态氯化氢 ⑩稀硫酸。其中能导电的是 ,属于电解质的是 。 (3)熔融NaHSO4的电离方程式为: 。向Ba(OH)2溶液中逐滴加入NaHSO4溶液至钡离子恰好沉淀完全,写出发生反应的离子方程式 ; (4)用“双线桥”标出下列反应中电子转移的方向和数目。 2KClO3+4HCl═2ClO2↑+2KCl+Cl2↑+2H2O 24.(13分)实验室需要1.0mol/L NaCl溶液450mL和0.5mol/L硫酸溶液500mL.根据这两种溶液的配制情况回答下列问题: (1)如图所示的仪器中配制溶液肯定不需要的是 (填序号),配制上述两种溶液还需用到的玻璃仪器是 (填仪器名称)。 (2)在配制NaCl溶液时: 根据计算,用托盘天平称取NaCl的质量为 g;在实验中其它操作均正确,若NaCl溶液在转移至容量瓶时,洒落了少许,则所得溶液浓度(填“大于”、“等于”或“小于”,下同) 1.0mol/L;若定容时仰视刻度线,则所得溶液浓度 1.0mol/L。 (3)在配制硫酸溶液时: 所需质量分数为98%、密度为1.84g•cm﹣3的浓硫酸的体积为(保留三位有效数字) mL,如果实验室有15mL、20mL、50mL量筒,应选用 mL;配制硫酸溶液时,一般可分为以下几个步骤:①量取 ②计算 ③稀释 ④摇匀 ⑤转移 ⑥洗涤 ⑦定容 ⑧冷却。其正确的操作顺序为: (填序号)②→①→③→ → → → →④ 25.(14分)请完成下列物质的分离提纯问题。 Ⅰ.现有含NaCl、Na2SO4和NaNO3的混合物,选择适当的试剂除去溶液中的NaCl和Na2SO4,从而得到纯净的NaNO3溶液。相应的实验过程可用如图表示: 请回答下列问题: (1)写出实验流程中试剂X的化学式: 。 (2)写出步骤③的有关离子方程式 、 。 (3)按此实验方案得到的溶液3中肯定含有 (填化学式)杂质;为了解决这个问题,可以向溶液3中加入适量的 (填化学式),之后若要获得固体NaNO3需进行的实验操作是 (填操作名称)。 Ⅱ.某同学欲用CCl4萃取较高浓度的碘水中的碘,操作过程分解为如下主要几步: A.把盛有溶液的分液漏斗放在铁架台的铁圈中; B.把50mL碘水和15mLCCl4加入分液漏斗中,并盖好玻璃塞; C.检查分液漏斗活塞和上口的玻璃塞是否漏液; D.倒转漏斗用力振荡,并不时旋开活塞放气,最后关闭活塞,把分液漏斗放正; E.旋开活塞,用烧杯接收溶液; F.从分液漏斗上口倒出上层液体; G.静置 (1)萃取过程正确操作步骤的顺序是: (填编号字母)。 (2)E步操作下层液体流出不畅,可能的原因是 。 (3)G步操作看到的实验现象是 。 26.(12分)A、B、C、D为四种可溶性的盐,它们包含的阳离子和阴离子分别为Ba2+、Ag+、Na+、Cu2+和NO3﹣、SO42﹣、Cl﹣、CO32﹣(离子在物质中不能重复出现). ①若把四种盐分别溶于盛有蒸馏水的四支试管中,只有C盐的溶液呈蓝色; ②若向①的四支试管中分别加入盐酸,B盐的溶液有沉淀生成,D盐的溶液有无色无味的气体逸出. 根据①②实验事实,回答下列问题: (1)写出化学式A D ; (2)在足量C盐溶液中加入5.6g铁粉,待铁粉完全反应后,转移电子的数目是 ; (3)将含相同物质的量A、B、C的三种盐溶液充分混合后,写出混合溶液中存在离子的物质的量之比[用n(X):n(Y)…=a:b…形式表示] ;在此溶液中加入锌粒,发生反应的离子方程式 。 (4)A盐溶液中阴离子的检验方法是: 。 27.(5分)某厂废水中含KCN,其浓度为0.01mol•L﹣1,现用氯氧化法处理,发生如下反应(化合物中N化合价均为﹣3价),已知氰化物和氰酸盐都有毒。 (1)KCN+2KOH+Cl2═KCNO+2KCl+H2O被氧化的元素是 ,还原产物是 。 (2)投入过量液氯,可将氰酸盐进一步氧化为氮气: KCNO + Cl2+ KOH → K2CO3 + N2 + KCl + H2O(未配平) 若将10L含KCN的浓度为0.01mol•L﹣1的废水中KCN全部氧化成无污染的物质,最少需要标准状况下的氯气 L。 山大附中2018~2019学年第一学期期中考试 高一化学试题参考答案 一.选择题(共44分,包括22小题,每小题只有一个正确选项) 题号 1 2 3 4 5 6 7 8 9 10 11 选项 D B D C A A B B C A C 题号 12 13 14 15 16 17 18 19 20 21 22 选项 C B C A D B C D C B C 二、非选择题(共56分,包括5小题) 23.(12分,每空2分) (1)①④⑤ (2)①④⑤⑩;②④⑨; (3)NaHSO4=Na++HSO4﹣ H++SO42﹣+OH﹣+Ba2+=BaSO4↓+H2O (4) 24.(13分,除注明外,每空2分) (1)A C (2)烧杯 玻璃棒 (3)29.3 小于(1分) 小于(1分) (4)13.6 15(1分) ⑧⑤⑥⑦ 25.(14分,除注明外,每空2分) Ⅰ.(1) Ba(NO3)2(或BaCl2)(1分) (2) 2Ag+ + CO32- ===Ag2 CO3↓ Ba2++ CO32- === Ba CO3↓ (3) Na2CO3 HNO3 蒸发(各1分) Ⅱ.(1)C B D A G E F (2)没有打开上口玻璃塞(或没有把上口的小孔与玻璃塞的凹槽对齐) (3)液体分为上下两层,下层呈紫色,上层接近无色 26. (12分,每空2分) (1)BaCl2 Na2CO3 ; (2)0.2NA(或1.206x1023); (3)n(Cl﹣):n(NO3﹣):n(Cu2+)=1:1:1 ; Zn + Cu2+ ═ Zn2+ + Cu (4)取少量A溶液于试管中(1分),先加稀硝酸酸化,再加硝酸银溶液有白色沉淀生成,则证明A中阴离子为Cl﹣(1分). 27.(5分) (1) C KCl(各1分) (2) 5.6L(3分)查看更多