- 2021-04-27 发布 |
- 37.5 KB |
- 28页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2020届高考化学二轮复习仪器连接、操作先后顺序课件(28张)
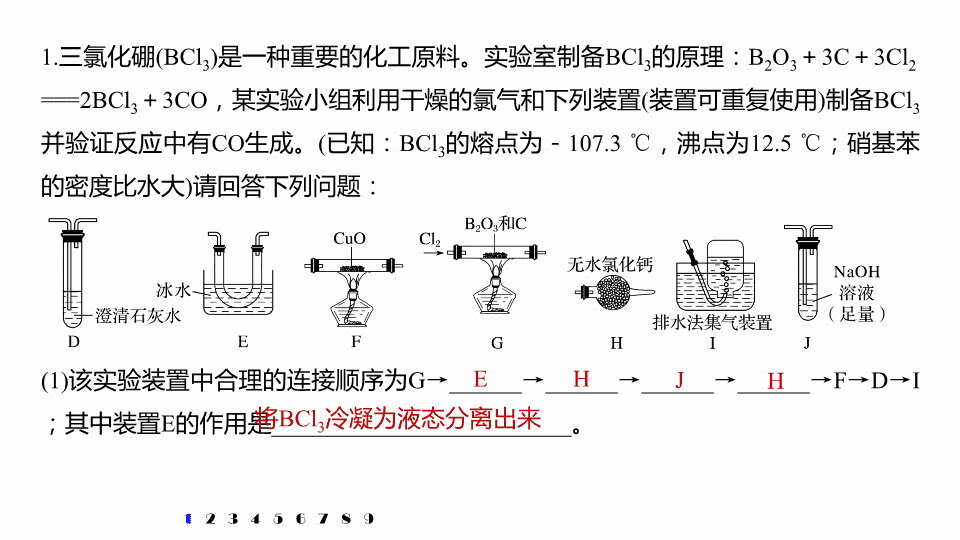
仪器连接、操作先后顺序集训 专题 八 大题 题 空逐空突破 ( 十四 ) 1. 三氯化硼 (BCl 3 ) 是一种重要的化工原料。实验室制备 BCl 3 的原理: B 2 O 3 + 3C + 3Cl 2 == =2BCl 3 + 3CO ,某实验小组利用干燥的氯气和下列装置 ( 装置可重复使用 ) 制备 BCl 3 并验证反应中有 CO 生成。 ( 已知: BCl 3 的熔点为- 107.3 ℃ ,沸点为 12.5 ℃ ;硝基苯的密度比水大 ) 请回答下列问题: 1 2 3 4 5 6 7 (1) 该实验装置中合理的连接顺序为 G → ______ → ______ → ______ → ______ → F → D → I ;其中装置 E 的作用是 _________________________ 。 E H J H 将 BCl 3 冷凝为液态分离出来 8 9 1 2 3 4 5 6 7 解析 干燥的氯气、 B 2 O 3 、 C 反应生成 BCl 3 和 CO , BCl 3 的熔点为- 107.3 ℃ ,沸点为 12.5 ℃ ,收集三氯化硼要用冰水冷却,未反应的氯气用氢氧化钠溶液吸收,三氯化硼易水解,为防止氢氧化钠溶液中的水进入装置 E ,在 E 和 J 之间添加 H 装置,用于吸水,生成的 CO 经干燥后再通过 F 装置还原氧化铜,再将生成的气体通过澄清石灰水检验,可以证明原反应中有 CO 生成,多余的 CO 不能排放到空气中,用排水法收集。则该实验装置中合理的连接顺序为 G → E → H → J → H → F → D → I ;其中装置 E 的作用是将 BCl 3 冷凝为液态分离出来。 8 9 (2)BCl 3 接触潮湿空气时会形成白雾,请写出该反应的化学方程式: _______________ _____________ 。 1 2 3 4 5 6 7 解析 BCl 3 接触潮湿空气时会形成白雾,是三氯化硼水解生成 HCl , HCl 溶于空气中的水形成盐酸小液滴,则三氯化硼水解的化学方程式为 BCl 3 + 3H 2 O == =H 3 BO 3 + 3HCl 。 BCl 3 + 3H 2 O == = H 3 BO 3 + 3HCl 8 9 (3) 能证明反应中有 CO 生成的现象是 _______________________________________ 。 1 2 3 4 5 6 7 解析 CO 能还原氧化铜,使黑色的氧化铜还原成红色的铜单质, CO 自身被氧化成二氧化碳,能使澄清石灰水变浑浊,则能证明反应中有 CO 生成的现象是 F 中黑色固体变成红色且澄清石灰水变浑浊。 F 中黑色固体变成红色且澄清石灰水变浑浊 8 9 (1)A 中发生反应的离子方程式为 _________________________________________ 。 (2)F 中发生反应的化学方程式为 _________________________________ 。 (3) 盛装碱石灰的仪器名称为 _______ ,其作用为 _________ 。 1 2 3 4 5 6 7 2. 氯化氨基汞 [Hg(NH 2 )Cl] 是祛斑霜中常用的添加剂,可由反应: Hg + 2NH 3 + Cl 2 == =Hg(NH 2 )Cl ↓ + NH 4 Cl 制备,某学习小组在实验室中利用下列装置制备氯化氨基汞,回答下列问题。 NH 3 ·H 2 O + CaO == =NH 3 ↑ + Ca(OH) 2 U 形管 干燥氨气 8 9 解析 整个装置分成两部分,一部分是由 A 装置中的氯气经除杂并干燥后得到干燥的氯气,一部分是由 F 装置生成的氨气经干燥后得到干燥的氨气,最后将干燥的氯气和氨气一起通入 E 中制得 Hg(NH 2 )Cl ,则整个装置的仪器连接顺序为 A → D → B → E ← C ← F ,该实验的不足之处是没有尾气处理装置。 1 2 3 4 5 6 7 (4) 整个装置的仪器连接顺序为 A → ________________ ( 装置不能重复使用 ) 。该实验的不足之处是 _______________ 。 D → B → E ← C ← F 无尾气处理装置 8 9 1 2 3 4 5 6 7 (5)E 中短导管 a 通入的气体是 ______ ,导管 ab 采用长短不同的原因是 _______________ _________________________________________________________________ 。 氯气 空气,氨气的密度小于空气,采用逆流原理,使氯气、氨气、汞充分混合 氯气的密度大于 8 9 3. 探究草酸的不稳定性。已知:草酸晶体 (H 2 C 2 O 4 ·2H 2 O) 无色,易溶于水,熔点为 101 ℃ ,受热易脱水、升华, 170 ℃ 以上分解产生 H 2 O 、 CO 和 CO 2 。草酸的酸性比碳酸强,其钙盐难溶于水。 1 2 3 4 5 6 7 (1) 请选取以上的装置证明草酸晶体分解的产物 ( 可重复使用,加热装置和连接装置已略去 ) 。仪器装置连接顺序为: A → ____ → ____ → ____ → ____ → E → B → G → ___ 。 C D G F J 8 9 解析 为证明草酸受热分解的产物中含有 H 2 O 、 CO 2 和 CO ,首先将混合气体通入盛有无水硫酸铜的干燥管检验水蒸气,如果变蓝说明有水蒸气产生; 1 2 3 4 5 6 7 再通入盛有冷水的洗气瓶除去草酸蒸气,防止草酸干扰二氧化碳的检验; 接着通入盛有澄清石灰水的洗气瓶检验二氧化碳,如果澄清石灰水变浑浊,则证明含有二氧化碳气体; 再用盛有足量氢氧化钠溶液的洗气瓶吸收二氧化碳,防止二氧化碳干扰一氧化碳的检验; 8 9 如果澄清石灰水变浑浊,则证明该混合气体中含有一氧化碳;为防止有毒的一氧化碳污染环境,用排水集气法收集一氧化碳,连接顺序为 A → C → D → G → F → E → B → G → J 。 1 2 3 4 5 6 7 然后再将洗气后的气体进行干燥,再将气体通入黑色的氧化铜装置,一氧化碳和黑色的氧化铜反应生成红色的铜和二氧化碳,再用澄清石灰水检验二氧化碳是否存在, 8 9 (2) 若实验结束后测得 B 管质量减轻 4.8 g ,则至少需分解草酸晶体的质量为 _____g( 已知草酸晶体的 M = 126 g·mol - 1 ) 。 1 2 3 4 5 6 7 37.8 8 9 解析 由化学方程式 CuO + CO Cu + CO 2 可知 A 管减轻的质量为氧原子的质量,则 n (CO) ∶ m (O) = 1 ∶ 16 = n (CO) ∶ 4.8 g ,解得 n (CO) 为 0.3 mol , H 2 C 2 O 4 ·2H 2 O 受热分解 1 2 3 4 5 6 7 的方程式为 H 2 C 2 O 4 ·2H 2 O 3H 2 O + CO ↑ + CO 2 ↑ , 由方程式可知分解的草酸晶体为 0.3 mol ,所以质量为 0.3 mol × 126 g·mol - 1 = 37.8 g 。 8 9 4. 制备无水氯化铁。 1 2 3 4 5 6 7 (1) 仪器 X 的名称为 _________ 。 (2) 装置的连接顺序为 a → __________ → j , k → ___________( 按气流方向,用小写字母表示 ) 。 圆底烧瓶 h , i → d , e g , f → b , c 8 9 1 2 3 4 5 6 7 解析 首先制取氯气,然后除杂、干燥,导管应长进短出,所以 a 连接 h , i 接 d ; 在 F 中与铁粉反应,为防止 FeCl 3 堵塞导管,出气导管应用粗导管,则 e 接 j ,冷凝法收集升华出的 FeCl 3 ,所以 k 接 g ; 最后连接盛有碱石灰的干燥管,吸收未反应的氯气,所以 f 接 b ,则装置的连接顺序为 a → h , i → d , e → j , k → g , f → b 。 8 9 (3) 实验结束后,取少量 F 中的固体加水溶解,经检测发现溶液中含有 Fe 2 + ,其原因为 ______________________________________________________ 。 1 2 3 4 5 6 7 未升华出来的 FeCl 3 与未反应的铁粉在水溶液中反应生成 Fe 2 + 8 9 (1) 装置 A 中反应的化学方程式为 __________________________________ 。 (2) 使分液漏斗中液体顺利流下的操作是 ______________________________________ _____________________________________________ 。 5. 硫是一种自然界分布较广的元素,在很多化合物中都含有该元素,回答下列问题: 1 2 3 4 5 6 7 CaSO 3 + 2HCl == =CaCl 2 + SO 2 ↑ + H 2 O 拔下分液漏斗顶部的塞子 ( 或使分液漏斗瓶 塞上的凹槽对准瓶颈的小孔 ) ,然后再旋转下部活塞 8 9 (3) 选用上面的装置和药品探究亚硫酸与次氯酸的酸性强弱: ① 甲同学认为按照 A → C → F 的顺序连接装置即可证明,乙同学认为该方案不合理,其理由是 _________________________________________________________________ 。 1 2 3 4 5 6 7 SO 2 通入次氯酸钙溶液发生氧化还原反应,不能证明强酸制备弱酸的原理 解析 次氯酸具有强氧化性、二氧化硫具有还原性,两者可发生氧化还原反应 ; 8 9 ② 丙同学设计的合理实验方案为: A → C → ____ → ____ → D → F ,其中装置 C 的作用是 _____________ ,证明亚硫酸的酸性强于次氯酸的实验现象是 ____________________ ______________ 。 1 2 3 4 5 6 7 除去 HCl 气体 B E D 中品红不褪色, F 中 出现白色沉淀 8 9 解析 A 装置制备二氧化硫,由于盐酸易挥发,制备的二氧化硫中混有 HCl ,用饱和的亚硫酸氢钠除去 HCl ,再通过碳酸氢钠溶液,可以验证亚硫酸的酸性比碳酸强,用酸性高锰酸钾溶液氧化除去二氧化碳中的二氧化硫,用品红溶液检验二氧化碳中二氧化硫是否除尽,再通入 F 中,则:装置连接顺序为 A → C → B → E → D → F ,其中装置 C 的作用是除去 HCl 气体, D 中品红不褪色, F 中出现白色沉淀,可证明亚硫酸的酸性强于次氯酸。 1 2 3 4 5 6 7 8 9 6. 某化学兴趣小组的同学进行三草酸合铁酸钾晶体 K 3 [Fe(C 2 O 4 ) 3 ]·3H 2 O 分解的实验探究。经小组讨论,他们设计了如下装置进行实验。烧瓶 B 中盛有饱和 NH 4 Cl 和饱和 NaNO 2 混合液 ( 常用于实验室制 N 2 ) ,干燥管 C 1 中装有碱石灰。 1 2 3 4 5 6 7 (1)B 中发生反应的化学方程式为 __________________________________ 。 (2)C 2 的作用是 ___________ , C 3 中盛装的试剂是 ____________ 。 NH 4 Cl + NaNO 2 == =N 2 ↑ + NaCl + 2H 2 O 检验水蒸气 P 2 O 5 或 CaCl 2 8 9 (3) 若实验中观察到 E 1 、 E 4 中的澄清石灰水均变浑浊,则 E 3 中的现象是 _________________ , 证明气体产物是 __________ 。 (4) 实验装置中有 2 个酒精灯,先点燃 A 1 ,一段时间后,熄灭 A 1 ,关闭止水夹 a ,再点燃 A 2 ,待 D 中的样品充分反应后,再次打开止水夹 a ,点燃 A 1 ,则第二次点燃 A 1 的理由是 _____________________________________________________________________ _______ 。 1 2 3 4 5 6 7 溶液褪色 ( 或变浅 ) CO 2 和 CO 第二次点燃 A 1 ,是利用生成的氮气将装置中残余的气体吹到后续装置,使其充 分吸收 8 9 开抽气泵 → a → b → d → ___________ → c → 关抽气泵。 a. 转移固液混合物; b. 关活塞 A ; c. 开活塞 A ; d. 确认抽干; e. 加洗涤剂洗涤 抽滤和普通过滤相比,优点是 _______________________________ 。 7. 如图装置,经过一系列操作完成抽滤和洗涤。请选择合适的编号,按正确的操作顺序补充完整 ( 洗涤操作只需考虑一次 ) : 1 2 3 4 5 6 7 加快过滤速度 ( 其他合理答案也可 ) c → e → b → d 8 9 (1) 仪器 C 的名称是 ____________ 。 (2) 连接好装置,点燃酒精灯之前,需进行的必要操作是 ________________________ ___________________________ 。 (3) 反应结束后,依然要通一段时间的氮气的原因是 ____________________________ ______________________ 。 8. 为探究 (NH 4 ) 2 Cr 2 O 7 ( 摩尔质量为 252 g·mol - 1 ) 的分解产物,按下图连接好装置,在 A 中加入 5.040 g 样品进行实验。 1 2 3 4 5 6 7 ( 球形 ) 干燥管 检查装置的气密性后通入氮 气一段时间将装置内空气排尽 将 A 中分解产生的气体全部赶入 B 中,防止产生实验误差 8 9 (4) 加热 A 至恒重,观察到 D 中溶液不变色,同时测得 A 中残留物为 Cr 2 O 3 、 B 中质量的 变化为 1.44 g ,写出重铬酸铵加热分解反应的化学方程式: ______________________ ______________ 。 1 2 3 4 5 6 7 + N 2 ↑ + 4H 2 O 8 9 1 2 3 4 5 6 7 8 9 (2) 装置 C 的硬质玻璃管中的现象为 _________________ 。 (3) 用离子方程式和必要的文字说明装置 A 的作用 _______________________________ _____________________________________________________ 。 除去空气中的氧气, 4Fe 2 + + O 2 + 4H + == =4Fe 3 + + 2H 2 O ,避免氧气与金属钙反应,使产品不纯 9. 氮化钙 (Ca 3 N 2 ) 是一种重要的化学试剂,通常条件下为棕色易水解的固体。某小组在实验室制备氮化钙,设计了如下实验 ( 夹持装置略去 ) : (1) 按气流由左到右的方向,下列装置合理的连接顺序为 ______________________( 填仪器接口字母,装置不能重复使用 ) 。 1 2 3 4 5 6 7 i - ab - gh - ef( 或 fe) - dc 固体逐渐变成棕色 8 9 (5) 请用化学方法确定氮化钙中含有未反应的钙,写出实验操作及现象: __________ __________________________________________________________________________________ 。 (4) 若用如图装置替代上述流程中 A 的作用,请补充以下实验步骤: 1 2 3 4 5 6 7 ① 检查装置气密性后,装入药品; ② 打开分液漏斗活塞,先点燃装置 ____ 处酒精灯,再点燃装置 ____ 处酒精灯,反应一段时间; ③ 先熄灭装置 ____ 处酒精灯,再熄灭装置 ____ 处酒精灯,最后关闭分液漏斗活塞。 A C C A 取少量反应 后的物质于试管中,加入适量水,用排水法收集到无色气体,则证明产物中含有未反应的钙 8 9查看更多