2018-2019学年安徽省滁州市定远县育才学校高二(普通班)上学期期中考试化学试题 Word版
2018-2019 学年度育才学校上学期期中考试试卷
高二普通班化学
考试时间:90 分钟;命题人:
第 I 卷(选择题)
一、单选题(60 分)
1.可逆反应 2NO2 2NO+O2 在容积固定的密闭容器中反应,达到平衡状态的标志是
A. 单位时间内生成 n mol O2 的同时生成 2n mol NO
B. 用 NO2、NO、O2 的物质的量浓度变化表示的反应速率的比为 2:2:1 的状态
C. 混合气体的颜色不再改变的状态
D. 混合气体的总质量不再改变的状态
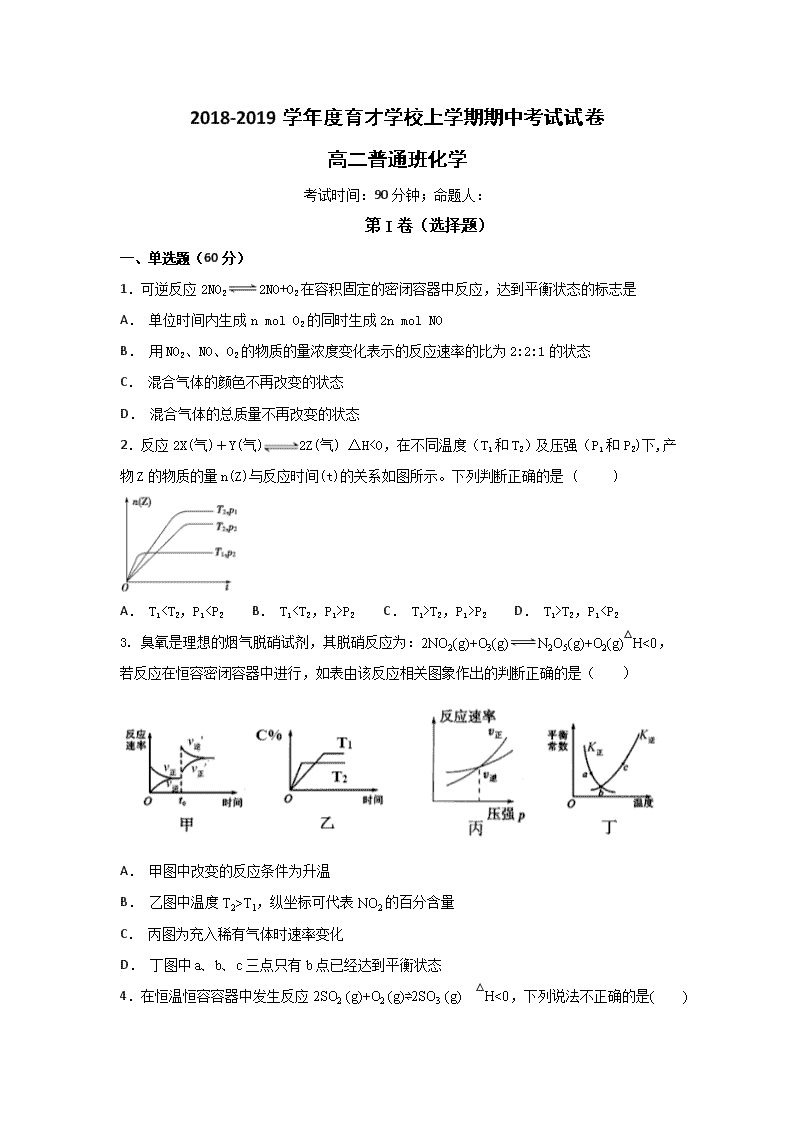
2.反应 2X(气)+Y(气) 2Z(气) △H<0,在不同温度(T1 和 T2)及压强(P1 和 P2)下,产
物 Z 的物质的量 n(Z)与反应时间(t)的关系如图所示。下列判断正确的是 ( )
A. T1
P2 C. T1>T2,P1>P2 D. T1>T2,P1T1,纵坐标可代表 NO2 的百分含量
C. 丙图为充入稀有气体时速率变化
D. 丁图中 a、b、c 三点只有 b 点已经达到平衡状态
4.在恒温恒容容器中发生反应 2SO2 (g)+O2 (g)⇌2SO3 (g) △H<0,下列说法不正确的是( )
A. 容器内压强不再变化,说明反应达到平衡状态
B. 当 c(SO2):c(O2)=1:2 且保持不变,能表明反应达到平衡状态
C. 加入合适的催化剂可显著增大反应速率
D. 达到平衡状态时,相同时间内,每消耗 2molSO3 的同时生成 1molO2
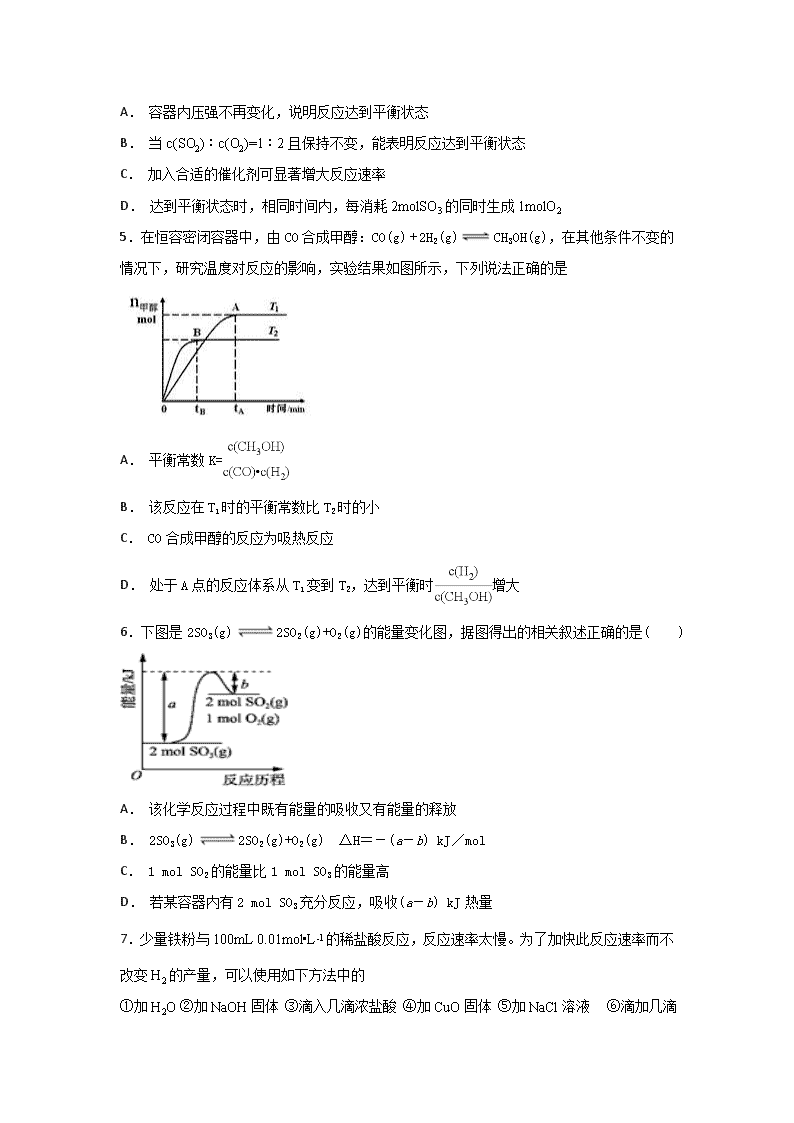
5.在恒容密闭容器中,由 CO 合成甲醇:CO(g) + 2H2(g) CH3OH(g),在其他条件不变的
情况下,研究温度对反应的影响,实验结果如图所示,下列说法正确的是
A. 平衡常数 K=
B. 该反应在 T1 时的平衡常数比 T2 时的小
C. CO 合成甲醇的反应为吸热反应
D. 处于 A 点的反应体系从 T1 变到 T2,达到平衡时 增大
6.下图是 2SO3(g) 2SO2(g)+O2(g)的能量变化图,据图得出的相关叙述正确的是( )
A. 该化学反应过程中既有能量的吸收又有能量的释放
B. 2SO3(g) 2SO2(g)+O2(g) △H=-(a-b) kJ/mol
C. 1 mol SO2 的能量比 1 mol SO3 的能量高
D. 若某容器内有 2 mol SO3 充分反应,吸收(a-b) kJ 热量
7.少量铁粉与 100mL 0.01mol•L﹣1 的稀盐酸反应,反应速率太慢。为了加快此反应速率而不
改变 H2 的产量,可以使用如下方法中的
①加 H2O ②加 NaOH 固体 ③滴入几滴浓盐酸 ④加 CuO 固体 ⑤加 NaCl 溶液 ⑥滴加几滴
硫酸铜溶液 ⑦升高温度(不考虑盐酸挥发) ⑧改用 10mL 0.1mol•L﹣1 的盐酸
A. ①⑤⑦ B. ③⑦⑧ C. ②④⑥ D. ③⑥⑦⑧
8.对可逆反应 2SO2(g)+O2(g) 2SO3(g) ΔH<0,下列图像正确的是
A. A B. B C. C D. D
9.反应 A(g) + 3B(g) ⇌2C(g) + 2D(g) 在四种不同情况下的反应速率分别为
① 、 ② 、
③ 、④ ,
该反应进行的快慢顺序为
A. ①>③=②>④ B. ①>②=③>④ C. ②>①=④>③ D. ①>
④>②=③
10.在四个不同容器中,不同条件下进行合成氨反应。根据在相同时间内测定的结果判断生
成氨的速率最快的是( )
A. v(N2)=0.1mol·L-1·s-1 B. v(H2)=0.1mol·L-1·min-1
C. v(NH3)=0.15mol·L-1·min-1 D. v(H2)=0.3mol·L-1·min-1
11.某温度下,在一个 2 L 的密闭容器中,加入 4 mol A 和 2 mol B 进行如下反应 3A(g)+
2B(g) 4C(s)+2D(g),反应一段时间后达到平衡,测得生成 1.6 mol C,则下列说法正
确的是( )
A. 该反应的化学平衡常数表达式是
B. 此时,B 的平衡转化率是 40%
C. 增大该体系的压强,化学平衡常数增大
D. 增加 B,B 的平衡转化率增大
12.工业上利用 Ga 与 NH3 高温条件下合成固体半导体材料氮化稼(GaN)同时有氢气生成。反
应中,每生成 3molH2 时放出 30.8kJ 的热量。恒温恒容密闭体系内进行上述反应,下列有关
表达正确的是
A. I 图像中如果纵坐标为正反应速率,则 t 时刻改变的条件可以为升温或加压
B. II 图像中纵坐标可以为镓的转化率
C. III 图像中纵坐标可以为化学反应速率
D. IV 图像中纵坐标可以为体系内混合气体平均相对分子质量
13.反应 C(s)+H2O(g) CO(g)+H2(g)在一密闭容器中进行,下列条件的改变能加快反应
速率的是
A. 增加 C 的量
B. 将容器的体积缩小一半
C. 保持容器体积不变,充入 N2
D. 保持压强不变,降低容器内的温度
14.对于可逆反应:mA(g)+nB(?) xC(g) △H,在不同温度及压强(p1,p2)
条件下,反应物 A 的转化率如图所示,下列判断正确的是
A. △H >0,m+n>x,同时 B 为非气态
B. △H >0,m+nx,同时 B 为气态
D. △H <0,m >
17.Ⅰ.化学反应中的焓变(Δ H)与反应物和生成物的键能(E)有关。下表给出了一些
化学键的键能:
化学键 H-H N≡N O=O O-H N-H
键能(kJ/mol) 436 942 500 463 a
已知工业合成氨: N2(g)+3H2(g) 2NH3(g) Δ H= -92.4 kJ· mol-1, 请回答下列问题:
(1)表中 a = kJ· mol-1
(2)1 mol N2 和 3 mol H2 充分反应,放出的热量 92.4 kJ(填“>”、“<”或
“=”)。
II.随着人类对温室效应和资源短缺等问题的重视,如何降低大气中 CO2 的含量及有效地开
发利用 CO2,引起了普遍的重视。
(1)目前工业上有一种方法是用CO2 来生产甲醇:CO2(g)+3H2(g) CH3OH(g)+H2O(g)。下
图表示该反应进行过程中能量的变化,该反应是 (填“吸热”或“放热”)反应;
(2)下列各项中,能说明 CO2(g)+3H2(g) CH3OH(g)+H2O(g)已达到平衡的是 (填
选项)。
A.恒温、恒容条件下,容器内的压强不发生变化
B.一定条件下,CH3OH 分解的速率和 CH3OH 生成的速率相等
C.一定条件下,单位时间内消耗 1 mol CO2,同时生成 1 mol CH3OH
D.一定条件下,H2O(g)的浓度保持不变
18.2SO2(g)+O2(g) 2SO3(g)反应在一体积可变的密闭容器中进行,试完成下列问题:
(1)将容器的体积缩小一半,其正反应速率 ,逆反应速率 。(填
“增大”“减小”或“不变”,以下同)。
(2)保持体积不变,充入 N2 使体系压强增大,其逆反应速率 。
(3)保持压强不变,充入 N2 使容器的体积增大,其正反应速率 。
19.运用化学反应原理研究合成氨反应有重要意义,请完成下列探究。
(1)生成氢气:将水蒸气通过红热的炭即产生水煤气。C(s)+H2O(g) H2(g)+CO(g)
ΔH=+131.3 kJ·mol-1,ΔS=+133.7 J·mol-1·K-1,该反应在低温下 (“能”或“不能”)
自发进行。
(2)已知在 400 ℃时,N2(g)+3H2(g) 2NH3(g)的 K=0.5。
①在 400 ℃时,2NH3(g) N2(g)+3H2(g)的 K′= (填数值)。
②400 ℃时,在 0.5 L 的反应容器中进行合成氨反应,一段时间后,测得 N2、H2、NH3 的物
质的量分别为 2 mol、1 mol、2 mol,则此时反应 v 正(N2) (填“>”“<”“=”或“不能
确定”)v 逆(N2)。
③若在恒温、恒压条件下向平衡体系中通入氩气,则合成氨反应的平衡 (填“向
左”“向右”或“不”)移动;使用催化剂 (填“增大”“减小”或“不改变”)反应的 ΔH。
育才学校期中考试试卷高二普通班化学答案
1.C 2.C 3.A 4.B 5.D 6.A 7.B 8.A 9.D 10.A 11.B 12.A
13.B 14.C 15.C
16.-19.5434 kJ 434 Q1Q2Q3
17. 390.4 < 放热 ABD
18.(1)增大 增大 (2)不变
(3)减小
19.不能 2=向左不改变