2019-2020学年浙江省诸暨中学高二上学期10月阶段性考试 化学 word版
诸暨中学2019学年高二阶段性考试化学试卷
2019.10
一、选择题(本大题包括25小题,每小题2分,共50分,每小题只有一个选项符合题意。)
1.在一定条件下,对于A2(g)+3B2(g)2AB3(g)反应来说,以下化学反应速率的表
示中,化学反应速率最快的是
A.v(A2)=0.8mol·L-1·s-1 B.v(A2)=30mol·L-1·min-1
C.v(AB3)=1.0mol·L-1·s-1 D.v(B2)=1.2mol·L-1·s-1
2.把A、B、C、D四块金属泡在稀H2SO4中,用导线两两相连可以组成各种原电池。若A、B相连A为负极;C、D相连D上有气泡逸出;A、C相连A上发生氧化反应;B、D相连,B是电子流入的一极。则四种金属的活泼性顺序由大到小排列为
A.A>B>C>D B.A>C>B>D C.A>C>D>B D.B>D>C>A
3.以下说法中正确的是
A.△H<0的反应均能自发进行 B.△S<0的反应均不能自发进行
C.碳酸氢铵固体加热分解是一个熵减小的过程
D.冰在室温下自动熔化成水,是熵增加的结果
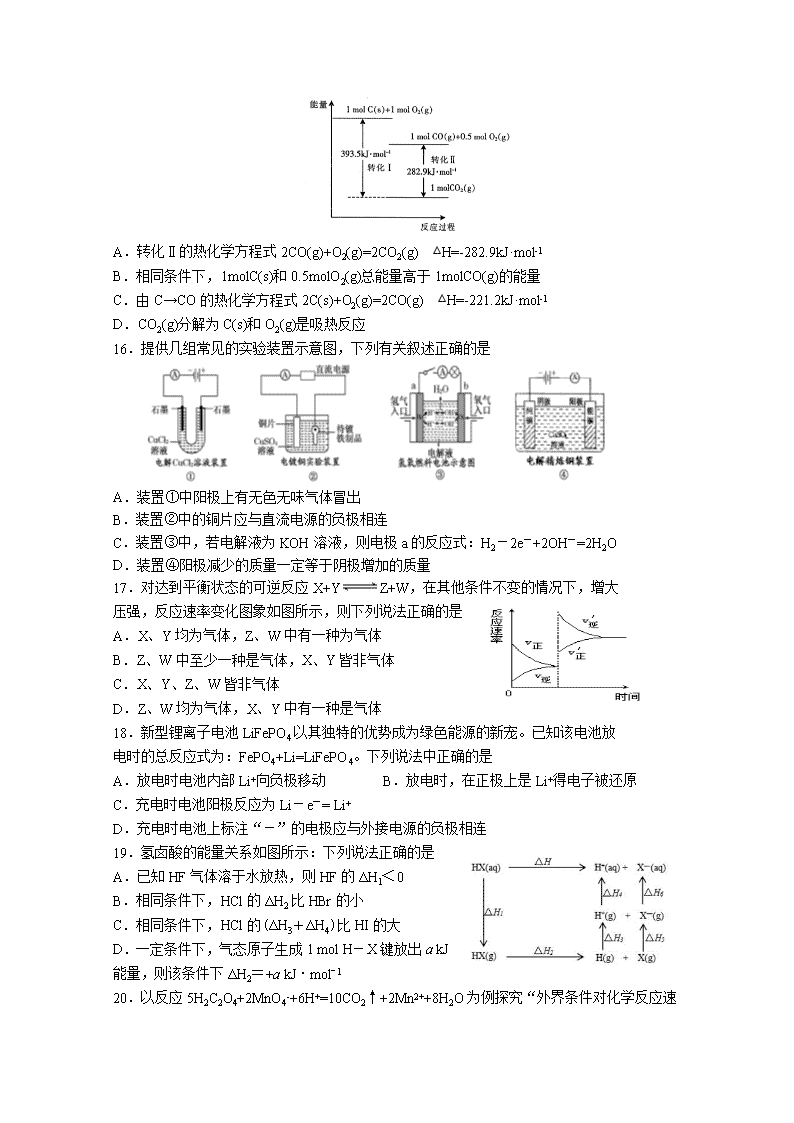
4.下列说法错误的是
A.需要加热方能发生的反应不一定是吸热反应
B.放热的反应在常温下一定很容易发生
C.反应是放热还是吸热必须看反应物和生成物所具有的总能量的相对大小
D.吸热反应在一定的条件下也能发生
5.对于任何一个平衡体系,采用以下措施,一定会使平衡移动的是
A.加入一种反应物 B.升高温度
C.对平衡体系增加压强 D.使用催化剂
6.在一定温度下的定容密闭容器中发生反应H2(g)+I2(g)2HI(g),下列能说明反应已经达到平衡状态的是
A.混合气体的平均摩尔质量不再变化 B.混合气体的密度不再变化
C.v正(H2)=v逆(HI) D.混合气体的颜色不再变化
7.在25℃时,密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如下表:
物质
X
Y
Z
初始浓度/mol·L-1
0.1
0.2
0
平衡浓度/mol·L-1
0.05
0.05
0.1
下列说法错误的是
A.反应达到平衡时,X的转化率为50%
B.增大压强使平衡向生成Z的方向移动
C.在25℃下,反应的平衡常数为1600,改变温度可以改变此反应的平衡常数
D.在25℃下,测得c(X)=0.04mol·L-1,c(Y)=0.1mol·L-1,c(Z)=0.08mol·L-1,则此时v正
丙>乙>丁 D.B的转化率为:丁>乙>丙>甲
25.在容积一定的密闭容器中,可逆反应:A2(g)+B2(g)xC(g)符合下列图Ⅰ所示关系,由此推断对图Ⅱ的正确说法是
A.P3P4,Y轴表示A2的浓度
C.P3>P4,Y轴表示混合气体的密度 D.P3>P4,Y轴表示混合气体的平均摩尔质量
二、简答题(本大题包括4小题,共50分。)
26.(14分)活动小组同学用下图1装置进行实验,试回答下列问题。
(1)若开始时开关K与a连接,则A极的电极反应式为 。
(2)若开始时开关K与b连接,则A极的电极反应式为 。
(3)当开关K与b连接时,关于这个实验,下列说法正确的是(填序号) 。
A.溶液中Na+向A极移动
B.从A极处逸出的气体能使湿润KI淀粉试纸变蓝
C.反应一段时间后加适量盐酸可恢复到电解前电解质的浓度
(4)该小组同学认为,如果模拟工业上离子交换膜法制烧碱的方法,那么可以设想用如图2装置电解硫酸钾溶液来制取氢气、氧气、硫酸和氢氧化钾。
图1 图2
①制得的氢氧化钾溶液从出口(填“A”、“B”、“C”、“D”) 导出,制得的氧气从出口(填“A”、“B”、“C”、“D”) 导出。
②此时通过阴离子交换膜的离子数 (填“大于”、“小于”或“等于”)通过阳离子交换膜的离子数。
③通电开始后,阴极附近溶液pH会增大,请简述原因 。
27.(12分)如图装置闭合电键K时,电流计A的指针将发生偏转。试回答:
(1)丙池是 (填“原电池”或“电解池”)。
(2)乙中Cu极的电极反应是 ,若电路中有0.02mol电子通过,则甲中a电极溶解的质量为 g。
(3)闭合电键K一段时间后,丙池中生成二种气体和一种碱,则丙池中发生的总的离子反应方程式是 。
(4)如果要给丙中铁片上镀上一层Ag,则丙池应作何改进 。
(5)丙池中反应进行较长时间后,收集到标准状况下氢气2.24L。此时测得丙池溶液质量实际减少4.23g,含有碱0.100mol(不考虑气体在水中的溶解),则实际放出气体的物质的量是
mol。
P1 P2 压强
T2
T1
a
b
B
的体积分数
c
28.(12分)对于反应A(g)2B(g) DH>0,在温度为T1和T2时,平衡体系中B的体积分数随压强变化的曲线如图所示。
(1)根据曲线图,下列说法不正确的是 。
A.a、c两点的反应速率:c>a
B.b、c两点A气体的转化率相等
C.由状态b到状态a,可以通过加热的方法
D.由状态b到状态c,可以通过加压的方法
(2)若上述反应在定容密闭容器中进行,达到平衡状态的标志是 。
A.单位时间内生成n mol A的同时分解2n molB B.两种气体的体积分数不再改变
C.混合气体的密度不再发生变化 D.混合气体的质量不再发生变化
(3)若上述反应达平衡时,B气体的平衡浓度为0.1mol·L-1 ,通过减小体积来增大体系的压强(温度保持不变),重新达平衡后,B气体的平衡浓度 0.1mol·L-1(填“大于”、“小于”或“等于”)。
(4)在100℃时,将0.40mol的B气体充入2L密闭容器中,每隔一定时间就对该容器内的物质进行分析,得到如下表的数据:
时间(s)
0
20
40
60
80
n(B)/mol
0.40
n1
0.26
n3
n4
n(A)/mol
0.00
0.05
n2
0.08
0.08
上表中n3 n4(填“大于”、“小于”或“等于”),反应A(g)2B(g)在100℃时的平衡常数K的值为 ,升高温度后,反应2B(g)A(g)的平衡常数K的值 (填“增大”、“减小”或“不变”)。
29.(12分)金属钛(Ti)被称为21世纪金属,在航海、航空、记忆和涂料方面应用广泛,TiO2
是一种优良的光催化剂。20世纪科学家尝试用多种方法将金红石(TiO2)还原,发现金红
石直接氯化是冶炼钛的关键
步骤:
TiO2(s)+2Cl2(g)=TiCl4(g)+O2(g) ΔH=+1493kJ•mol-1,ΔS=+61J•K-1•mol-1
该反应发生温度高达2170℃,能耗大,对设备和生产要求几乎达到苛刻程度。目前科学家采用金红石加碳氯化方法,在较温和条件下成功制取TiCl4,为人类快速迈进钛合金时代做出了巨大贡献。金红石加碳氯化的主要反应如下:
反应Ⅰ:TiO2(s)+2Cl2(g) +C(s)TiCl4(g)+CO2(g) ΔH1,ΔS1=+64J•K-1•mol-1
反应Ⅱ:TiO2(s)+2Cl2(g) +2C(s)TiCl4(g)+2CO(g) ΔH2,△S2
已知:①C(s)+O2(g)=CO2(g) ΔH=-394.3kJ•mol-1
②2C(s)+O2(g)=2CO(g) ΔH=-222.3kJ•mol-1
请回答:
(1)反应Ⅰ的ΔH1= kJ•mol-1。
(2)对于气体参加的反应,表示平衡常数KP时,用气体组分B的平衡压强P(B)代替该气
体物质的量浓度c(B),则反应Ⅰ的KP= (用表达式表示)。
(3)在常温、常压、光照条件下,N2在催化剂TiO2表面与H2O发生反应,
2N2(g)+6H2O(1)=4NH3(g)+3O2(g) ΔH=+1530.4kJ•mol-1
进一步研究相同条件下NH3生成量与温度的关系,部分实验数据见下表:
实验组别
1
2
3
4
T/K
303
313
323
353
NH3生成量/(10-6mol)
4.8
5.9
6.0
2.0
O2生成量/(10-6mol)
3.6
4.4
4.5
1.5
反应时间/h
3
3
3
3
容器体积/L
2
2
2
2
①请在下图中画出上述反应在“有催化剂”与“无催化剂”两种情况下反应过程中体系能量随反应过程的变化趋势示意图(图中标明必要的文字说明)。
O
反应过程
能量
②根据表中数据,在303K时,在3h内用氮气表示其平均反应速率为 mol•L-1•h-1。判断组别4中反应是否达到平衡状态 (填“是”或“否”),并说明理由 。
诸暨中学2019学年高二阶段性考试化学试卷答案
一、选择题(本大题包括25小题,每小题2分,共50分。)
题号
1
2
3
4
5
6
7
8
9
10
答案
A
C
D
B
B
D
D
B
C
C
题号
11
12
13
14
15
16
17
18
19
20
答案
B
C
C
C
A
C
D
D
D
B
题号
21
22
23
24
25
答案
A
D
D
A
D
二、简答题(本大题包括4小题,共50分。)
26、(14分,每空2分)
(1)O2+4e-+2H2O=4OH- (2)2Cl--2e-=Cl2↑ (3)B
(4)①D;B ②小于;③H+放电,促进水的电离,OH-浓度增大
27、(12分,每空2分)
(1)电解池 (2)Cu2++2e﹣=Cu;0.65; (3) 2Cl-+2H2O2OH-+H2↑+Cl2↑;
(4)把C电极换成Ag电极,把NaCl溶液换为硝酸银溶液 (5)0.165
28、(12分,每空2分)
(1)D (2)B (3)大于 (4) 等于;0.36;减小
29、(12分,每空2分)
(1)+1098.7 (2)p(CO2)p(TiCl4)/p2(Cl2)
(3)①
②4×10-7;否;反应正反应为吸热反应,升高温度平衡正移,则n(NH3)应大于6.0×10-6mol