- 2021-04-27 发布 |
- 37.5 KB |
- 8页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
四川省南充市白塔中学2019-2020学年高二下学期开学考试化学试题
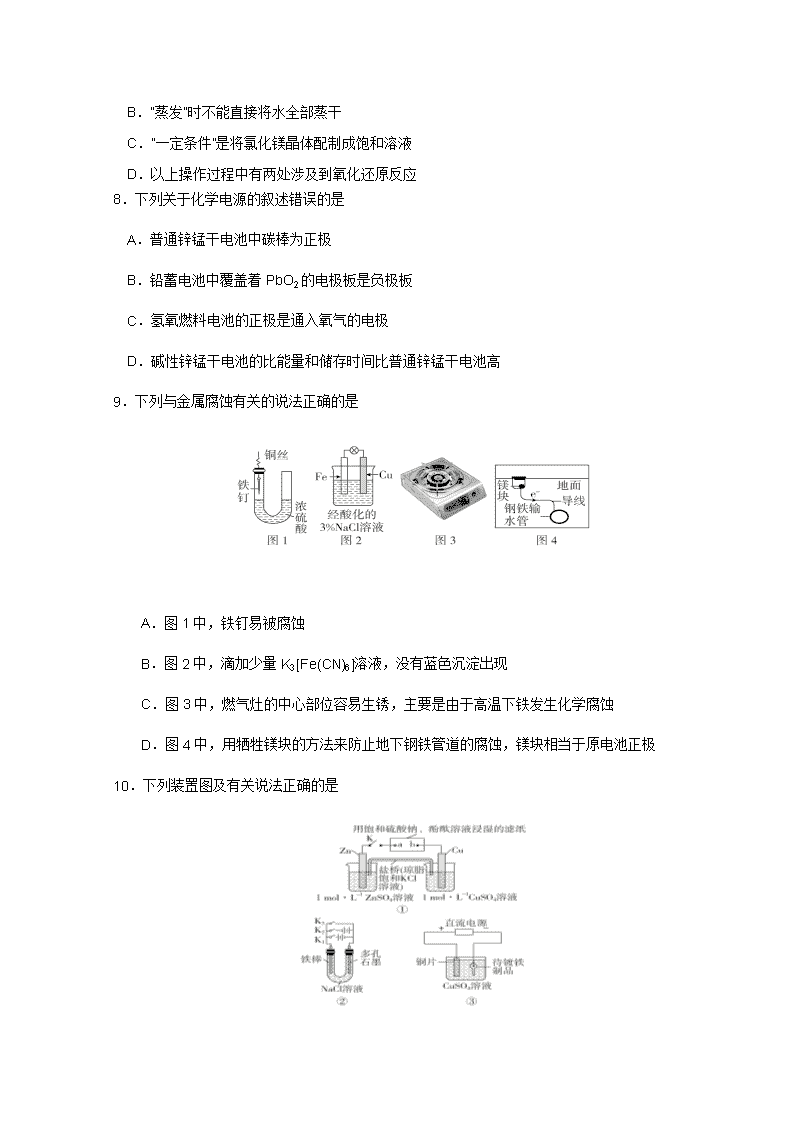
白塔中学高二下入学考试 化 学 试 题 (考试时间90分钟,满分100分) 本试卷分为试题卷和答题卡两部分,其中试题卷由第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)组成,共6页;答题卡共2页。 注意事项: 1. 答题前,考生务必将自己的学校、班级、姓名用0.5毫米黑色墨水签字笔填写清楚,同时用2B铅笔将考号准确填涂在“考号”栏目内。 2. 选择题使用2B铅笔填涂在答题卡对应题目标号的位置上,如需改动,用橡皮擦擦干净后再选涂其它答案;非选择题用0.5毫米黑色墨水签字笔书写在答题卡的对应框内,超出答题区域书写的答案无效;在草稿纸、试题卷上答题无效。 可能用到的相对原子质量:H-1 C-12 O-16 Mg-24 Al-27 P-31 S-32 Cu-64 第Ⅰ卷(选择题 共60分) 一、选择题(本题包括20小题,每题3分,共60分,每小题只有一个选项符合题意) 1. 冠状病毒对热敏感、对有机溶剂和消毒剂敏感,56℃下30分钟,75%乙醇、乙醚、氯仿、甲醛、含氯消毒剂、过氧乙酸和紫外线均可灭活病毒。下列说法正确的是 A.灭活病毒的主要原理是使病毒的蛋白质变性 B.高浓度酒精(95%)消毒杀菌效果更好 C.口罩主要是避免发生接触传播 D.氯仿是一种常见的有机溶剂;可通过甲烷和氯气的加成反应得到 2.下列关于有机化合物的说法正确的是 A.2甲基丙烷也叫异丁烷 B.蛋白质和糖类均为天然高分子化合物 C.乙烯和丙烯只能发生加成反应,不能发生取代反应 D.苯使溴水褪色的原因是发生加成反应 3.如图所示是常见四种有机物的比例模型示意图。下列说法不正确的是 A.甲不能使酸性高锰酸钾溶液褪色 B.乙可与溴的四氯化碳溶液发生加成反应使其褪色 C.丙中的碳碳键是一种介于碳碳单键和碳碳双键之间的独特的键 D.丁可由乙与水发生取代反应生成 4.下列除杂方法(括号内为杂质)正确的是 A.乙醇(水) 加新制的生石灰,过滤 B.乙烷(乙烯) 通过溴的四氯化碳溶液,洗气 C.溴苯(苯) 加水,振荡静置后分液 D.乙酸乙酯(乙酸) 加饱和Na2CO3溶液,振荡静置后分液 5.分枝酸可用于生化研究,其结构简式如下图所示。下列关于分枝酸的叙述正确的是 A.分子中含有2种官能团 B.可与乙醇、乙酸反应,且反应类型相同 C.1 mol分枝酸,最多可与3mol NaOH发生中和反应 D. 可使溴的四氯化碳溶液、酸性高锰酸钾溶液褪色,且原理相同 6.加碘盐中碘元素可来自于海带,下列说法正确的是 A.加碘盐中的碘以KI的形式存在 B.在实验室里,可将干海带置于蒸发皿中灼烧,再加水溶解并过滤以分离出I- C.可用双氧水将I-氧化为单质碘 D.可用酒精萃取碘单质以制备“碘酒” 7.工业中从海水提取镁的流程如下图所示: 下列说法错误的是 A.石灰乳可由贝壳制得 B.“蒸发”时不能直接将水全部蒸干 C.“一定条件”是将氯化镁晶体配制成饱和溶液 D.以上操作过程中有两处涉及到氧化还原反应 8.下列关于化学电源的叙述错误的是 A.普通锌锰干电池中碳棒为正极 B.铅蓄电池中覆盖着PbO2的电极板是负极板 C.氢氧燃料电池的正极是通入氧气的电极 D.碱性锌锰干电池的比能量和储存时间比普通锌锰干电池高 9.下列与金属腐蚀有关的说法正确的是 A.图1中,铁钉易被腐蚀 B.图2中,滴加少量K3[Fe(CN)6]溶液,没有蓝色沉淀出现 C.图3中,燃气灶的中心部位容易生锈,主要是由于高温下铁发生化学腐蚀 D.图4中,用牺牲镁块的方法来防止地下钢铁管道的腐蚀,镁块相当于原电池正极 10.下列装置图及有关说法正确的是 A.装置①中K键闭合时,片刻后CuSO4溶液中c(Cl-)增大 B.装置①中K键闭合时,片刻后可观察到滤纸a点变红色 C.装置②中铁腐蚀的速率由大到小顺序是:只闭合K1>只闭合K3>只闭合K2>都断开 D.装置③中当铁制品上析出1.6 g铜时,电源负极输出的电子数为0.025NA 11.科研人员设想用右图所示装置生产硫酸,下列说法正确的是 A.a为正极,b为负极 B.生产过程中H+向a电极区域运动 C.电子从b极向a极移动 D.负极反应式为2H2O+SO2-2e-===SO+4H+ 12.市场上经常见到的标记为Li-ion的电池称为“锂离子电池”。它的负极材料是金属锂和碳的复合材料(碳作为金属锂的载体),电解质为一种能传导Li+的高分子材料。这种电池的电池反应式为:Li+2Li0.35NiO22Li0.85NiO2,下列说法不正确的是 A.放电时,负极的电极反应式:Li-e-===Li+ B.充电时,Li0.85NiO2既发生氧化反应又发生还原反应 C.该电池不能用水溶液作为电解质溶液 D.放电过程中Li+向负极移动 13.如图装置为某新型燃料电池的工作示意图,以HCl-NH4Cl溶液为电解质溶液。下列有关说法中正确的是 A.通入H2的电极为正极 B.该电池的负极反应式为:N2+6e-+8H+===2NH C.图中分离出的A物质为NH4Cl D.该电池工作一段时间后,溶液的pH减小 14.下列关于原子结构的表述中,正确的是 A.L能层含轨道数共有8个 B.在基态K原子中,核外电子占据最高能级符合为N C.电子云轮廓图半径随能层序数增加而增大 D.根据洪特规则每个轨道最多容纳2个自旋状态相反的电子 15.下列有关说法不正确的是 A.门捷列夫将元素按相对原子质量递增的顺序排列制作了第一张元素周期表 B.元素周期表共分为5个区,Zn位于ds区 C.因Li+的核电荷数大于H-故Li+半径小于H- D.在周期表中元素的电负性越大非金属性越强,第一电离能越小金属性越强 16.现有三种元素的基态原子的电子排布式如下:①1s22s22p63s23p4;②1s22s22p63s23p3; ③1s22s22p5。则下列有关比较中正确的是 A.简单氢化物的还原性:③>①>② B.电负性:③>①>② C.阴离子半径:①>②>③ D.最高价氧化物的水化物酸性:③>①>② 17.有关分子结构和性质的说法错误的是 A.因氢键存在,冰晶体中水分子的空间利用率不高 B.CS2 、BF3 均为极性键构成的非极性分子 C.HClO4酸性强于HClO是因为HClO4中含氧原子数较多 D.N2分子与CO分子中都含有1个δ键和2个π键 18.下列关于0.1 mol/L的醋酸说法正确的是 A.该溶液中存在两种分子、两种离子 B.该溶液中氢离子的数目小于0.1 NA C.升高温度,醋酸的电离平衡常数变大 D.向该醋酸中加水,醋酸的电离平衡正向移动,pH变小 19.已知某温度下,0.01 mol/L的氢氧化钠溶液pH =11,下列说法错误的是 A.此温度高于常温 B.此温度下该溶液中由水电离出的氢氧根离子浓度c(OH-)水=10 -11 C.此温度下取1 L该溶液能与等体积的pH=3的盐酸完全中和 D.此温度下0.01 mol/L 的氨水pH<11 20.一定温度下,向氨水中加入过量冰醋酸(整个过程中溶液体积不变),溶液导电性(A)随时间(T)的大致变化图像正确的是 A A A A T T T T A B C D 第II卷(非选择题 共40分) 注意事项: 必须使用0.5毫米黑色墨水签字笔书写在答题卡的对应框内,超出答题区域书写的答案无效;在草稿纸、试题卷上答题无效。 21.(7分)乙酸乙酯是中学化学中的重要物质。小明通过自主学习成功地制取并提纯了乙酸乙酯: 【小明的知识储备】 ①乙醇能和氯化钙形成CaCl2·6C2H5OH ②有关物质的沸点: 【制备过程】 装置如图所示,A中放有浓硫酸,B中放有10mL无水乙醇和5mL冰醋酸,D中放有滴有酚酞的饱和碳酸钠溶液。迅速升温到170℃进行反应。 1.请补充出乙酸与乙醇发生酯化反应的化学方程式 。 2.实验装置还缺少 。 3.实验过程中滴加大约3mL浓硫酸,B的容积最合适的是 。 (填字母) A.25mL B.50mL C.250mL D.500mL 4.小明在D中观察到了明显的的分层现象,其下层显 色.。 【产品提纯】 ①将D中混合物转入分液漏斗进行分液。②有机层用5mL饱和氯化钙溶液洗涤,最后用水洗涤。有机层倒入一干燥的烧瓶中,用无水硫酸镁干燥,得粗产物。③将粗产物蒸馏,收集馏分,得到纯净干燥的乙酸乙酯。 5.操作②的目的为洗去 ,操作③中,应收集 ℃馏分。 22.(14分)回答下列问题 I.利用含多糖淀粉的物质可以生产醋酸。下面是生产醋酸的流程,根据流程回答下列问题: ―→―→―→ B是日常生活中常见的有特殊香味的有机物,在有些饮料中含有B。 (1)写出淀粉的分子式 ,C中官能团的名称是 。 (2)B→C的反应类型是 填字母)。 A.取代反应 B.加成反应 C.氧化反应 D.还原反应 (3)写出C完全燃烧的化学方程式: 。 II .电化学在化学工业中有着广泛应用。根据图示电化学装置, ①甲池通入乙烷(C2H6)一极的电极反应式为 。 ②乙池中,若X、Y都是石墨,A是Na2SO4溶液,实验开始时,同时在两极附近溶液中各滴入几滴酚酞溶液,X极的电极反应式为 ;一段时间后,在Y极附近观察到的现象是 。 ③工业上通过电解浓NaOH溶液制备Na2FeO4,其工作原理如图所示,则阳极的电极反应式为_ _,阴极反应式为 。 23.(11分)新型冠状病毒来势汹汹,但是它依然可防可控。84消毒液具有强氧化性,可将冠状病毒外的包膜破坏后使RNA被降解,使病毒失活,以达到灭菌的效果。制取84消毒液的氯气可用加热浓盐酸和MnO2混合物来制取,也可用浓盐酸和KClO3直接混合来制取。回答下列问题: (1)在周期表中与Mn相邻且未成对电子数最多的原子的价电子排布式为: 。 (2)K和O第一电离能I1(K) I1(O)(填“大于”或“小于”)。原因是 。 (3)浓盐酸为HCl的水溶液,HCl极易溶于水的原因 ,HCl和H2O中沸点较高的是 ,其原因是 。 (4)KClO3晶体中,阴离子的空间构型为 ,Cl的 杂化轨道与O的2p轨道形 成 键。 (5)金属K晶体为体心立方堆积,K原子半径为r pm,摩尔质量为Mg.mol-1,阿伏伽德罗常数为NA,则晶体密度为 g﹒cm-3。(列出计算式) 24.(8分)酸碱中和滴定是中学化学的定量检测手段之一。小豆在学习相关内容后,发现一个问题:能不能检测出家用白醋中醋酸的浓度。于是他设计了以下步骤(假设白醋中只有醋酸能与氢氧化钠反应): (1)配置100mL 1mol/L氢氧化钠标准溶液,此过程中需要的玻璃仪器为 。 (2)将 (填仪器名称)用水洗净并用氢氧化钠标准溶液润洗后,加入氢氧化钠标准溶液至零刻度,固定在滴定管夹上,用 (填仪器名称)准确量取20.00 ml白醋置于锥形瓶中,并在锥形瓶中加入适量酚酞溶液。 (3)进行滴定。请写出滴定终点时的现象: 。 (4)多次测定后,平均消耗氢氧化钠的体积为16.00 mL,则白醋中醋酸浓度为 。查看更多