- 2021-04-26 发布 |
- 37.5 KB |
- 6页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2020高考化学冲刺核心素养微专题1化学计算中的数学思想练习含解析
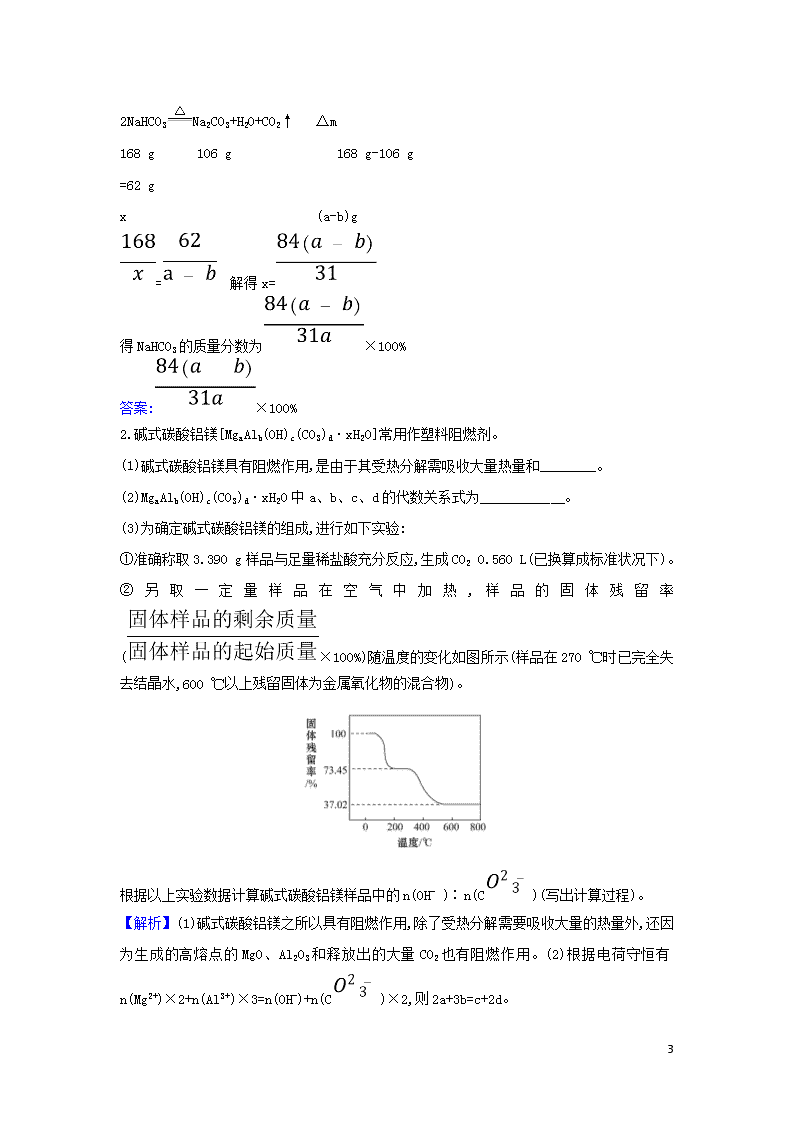
化学计算中的数学思想 1.关系式法 (1)原理及应用 多步反应计算的特征是化学反应原理中多个反应连续发生,起始物与目标物之间存在确定的量的关系。 (2)思维建模—答题三步骤 2.差量法 (1)差量法的应用原理 差量法是指根据化学反应前后物质的量发生的变化,找出“理论差量”。这种差量可以是质量、物质的量、气态物质的体积和压强、反应过程中的热量等。用差量法解题是先把化学方程式中的对应差量(理论差量)跟差量(实际差量)列成比例,然后求解。如: 6 (2)使用差量法的注意事项 ①所选用差值要与有关物质的数值成正比例或反比例关系。 ②有关物质的物理量及其单位都要正确地使用,即“上下一致,左右相当”。 【典例】(2018·全国卷Ⅲ节选)硫代硫酸钠晶体(Na2S2O3·5H2O,M=248 g·mol-1)可用作定影剂、还原剂。利用K2Cr2O7标准溶液定量测定硫代硫酸钠的纯度。测定步骤如下: (1)溶液配制:称取1.200 0 g某硫代硫酸钠晶体样品,用新煮沸并冷却的蒸馏水在________中溶解,完全溶解后,全部转移至100 mL的________中,加蒸馏水至________。 (2)滴定:取0.009 50 mol·L-1的K2Cr2O7标准溶液20.00 mL,硫酸酸化后加入过量KI,发生反应:Cr2+6I-+14H+3I2+2Cr3++7H2O。然后用硫代硫酸钠样品溶液滴定至淡黄绿色,发生反应: I2+2S2S4+2I-。加入淀粉溶液作为指示剂,继续滴定,当溶液________,即为终点。平行滴定3次,样品溶液的平均用量为24.80 mL,则样品纯度为________%(保留1位小数)。 【解析】(1)配制溶液时,先将固体在烧杯中溶解,冷却后转移至容量瓶中,最后加水定容至刻度线。 (2)淀粉遇I2变成蓝色,当Na2S2O3将I2消耗完后,溶液中的蓝色会褪去,即为反应终点。由反应关系: Cr2~3I2~6Na2S2O3,24.80 mL样品溶液中,硫代硫酸钠晶体的质量m(Na2S2O3·5H2O)=0.009 5 mol·L-1×20×10-3 L×6×248 g·mol-1= 0.282 72 g,由比例关系知,100 mL样品溶液中的Na2S2O3·5H2O质量为 0.282 72 g×=1.14 g,则样品中Na2S2O3·5H2O的纯度为×100%=95.0%。 答案:(1)烧杯 容量瓶 刻度线 (2)蓝色褪去 95.0 1.a g Na2CO3和NaHCO3混合物加热至质量减少到b g,则混合物中NaHCO3的质量分数为________。 【解析】设NaHCO3的质量为x 6 2NaHCO3Na2CO3+H2O+CO2↑ Δm 168 g 106 g 168 g-106 g =62 g x (a-b)g = 解得x= 得NaHCO3的质量分数为×100% 答案:×100% 2.碱式碳酸铝镁[MgaAlb(OH)c(CO3)d·xH2O]常用作塑料阻燃剂。 (1)碱式碳酸铝镁具有阻燃作用,是由于其受热分解需吸收大量热量和________。 (2)MgaAlb(OH)c(CO3)d·xH2O中a、b、c、d的代数关系式为__________ 。 (3)为确定碱式碳酸铝镁的组成,进行如下实验: ①准确称取3.390 g样品与足量稀盐酸充分反应,生成CO2 0.560 L(已换算成标准状况下)。 ②另取一定量样品在空气中加热,样品的固体残留率(×100%)随温度的变化如图所示(样品在270 ℃时已完全失去结晶水,600 ℃以上残留固体为金属氧化物的混合物)。 根据以上实验数据计算碱式碳酸铝镁样品中的n(OH- )∶n(C)(写出计算过程)。 【解析】(1)碱式碳酸铝镁之所以具有阻燃作用,除了受热分解需要吸收大量的热量外,还因为生成的高熔点的MgO、Al2O3和释放出的大量CO2也有阻燃作用。(2)根据电荷守恒有n(Mg2+)×2+n(Al3+)×3=n(OH-)+n(C)×2,则2a+3b=c+2d。 6 答案:(1)生成的产物具有阻燃作用 (2)2a+3b=c+2d (3)n(CO2)==2.50×10-2 mol m(CO2)=2.50×10-2 mol×44 g·mol-1=1.10 g 在270~600 ℃之间,失去结晶水后的样品进一步受热分解放出CO2和H2O, m(CO2)+m(H2O)=3.390 g×(0.734 5-0.370 2)=1.235 g m(H2O)=1.235 g-1.10 g=0.135 g n(H2O)==7.50×10-3 mol n(OH-)=7.50×10-3 mol×2=1.50×10-2 mol n(OH-)∶n(C)=(1.50×10-2 mol)∶(2.50×10-2 mol)=3∶5。 3.氯化亚铜(CuCl)是重要的化工原料。国家标准规定合格CuCl产品的主要质量指标为CuCl的质量分数大于96.50%。工业上常通过下列反应制备CuCl: 2CuSO4+Na2SO3+2NaCl+Na2CO32CuCl↓+3Na2SO4+CO2↑ (1)CuCl制备过程中需要质量分数为20.0%的CuSO4溶液,试计算配制该溶液所需的CuSO4·5H2O与H2O的质量之比。 (2)准确称取所制备的0.2500 g CuCl样品置于一定量的0.5 mol·L-1 FeCl3溶液中,待样品完全溶解后,加水20 mL,用0.100 0 mol·L-1的Ce(SO4)2溶液滴定到终点,消耗24.60 mL Ce(SO4)2溶液。有关化学反应为 Fe3++CuClFe2++Cu2++Cl- Ce4++Fe2+Fe3++Ce3+通过计算说明上述样品中CuCl的质量分数是否符合标准。 【解析】(1)设需要CuSO4·5H2O的质量为x,H2O的质量为y。CuSO4·5H2O的相对分子质量为250,CuSO4的相对分子质量为160,依题意有 =,x∶y=5∶11 (2)设样品中CuCl的质量为z。 6 由化学反应方程式可知:CuCl~Fe2+~Ce4+ = z=0.244 8 g CuCl的质量分数为×100%=97.92% 97.92%>96.50%,所以样品中的CuCl符合标准。 答案:(1)5∶11 (2)符合 【加固训练】 黄铁矿主要成分是FeS2。某硫酸厂在进行黄铁矿成分测定时,取0.1000 g样品在空气中充分燃烧,将生成的SO2气体与足量Fe2(SO4)3溶液完全反应后,用浓度为0.0200 0 mol·L-1的K2Cr2O7标准溶液滴定至终点,消耗K2Cr2O7溶液25.00 mL。 已知:SO2+2Fe3++2H2OS+2Fe2++4H+ Cr2+6Fe2++14H+2Cr3++6Fe3++7H2O (1) 样品中FeS2的质量分数是(假设杂质不参加反应)________。 (2) 若燃烧6 g FeS2产生的SO2全部转化为SO3气体时放出9.83 kJ热量,产生的SO3与水全部化合生成H2SO4,放出13.03 kJ热量,写出SO3气体转化为H2SO4的热化学方程式 ____________________________________ 。 (3)煅烧10 t上述黄铁矿,理论上产生SO2的体积(标准状况)为________L,制得98%的硫酸质量为________t,SO2全部转化为H2SO4时放出的热量是________kJ。 【解析】(1) 3FeS2 ~ 6SO2~ 12Fe2+ ~ 2Cr2 360 g 2 mol 0.1000 w 0.025 L×0.0200 0 mol·L-1 360 g∶0.1000 w=2 mol∶(0.025 L×0.0200 0 mol·L-1) w=90.00% (2)n(FeS2)= mol=0.05 mol,n(SO2)=n(SO3)=0.1 mol,则SO3生成1 mol H2SO4 6 放出热量为130.3 kJ,则热化学方程式可得,SO3(g)+H2O(l)H2SO4(l) ΔH =-130.3 kJ·mol-1 (3)FeS2 ~ 2SO2 ~ 2H2SO4 0.12 t 2×22.4 L 0.196 t 90%×10 t V(SO2) m(溶液)×98% 0.12 t∶(90%×10 t)=0.196 t∶[m(溶液)×98%] V(SO2)=3.36×106 L;m(溶液)=15 t;n(SO2)= n(SO3)==1.5×105 mol,放出热量为1.5×105 mol×(98.3+ 130.3) kJ·mol-1=3.43×107 kJ。 答案:(1)90.00%。 (2)SO3(g)+H2O(l)H2SO4(l) ΔH=-130.3 kJ·mol-1 (3)3.36×106 15 3.43×107 6查看更多