- 2021-04-26 发布 |
- 37.5 KB |
- 11页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2019-2020学年吉林省延边第二中学高二12月第二次阶段测试化学试题 Word版
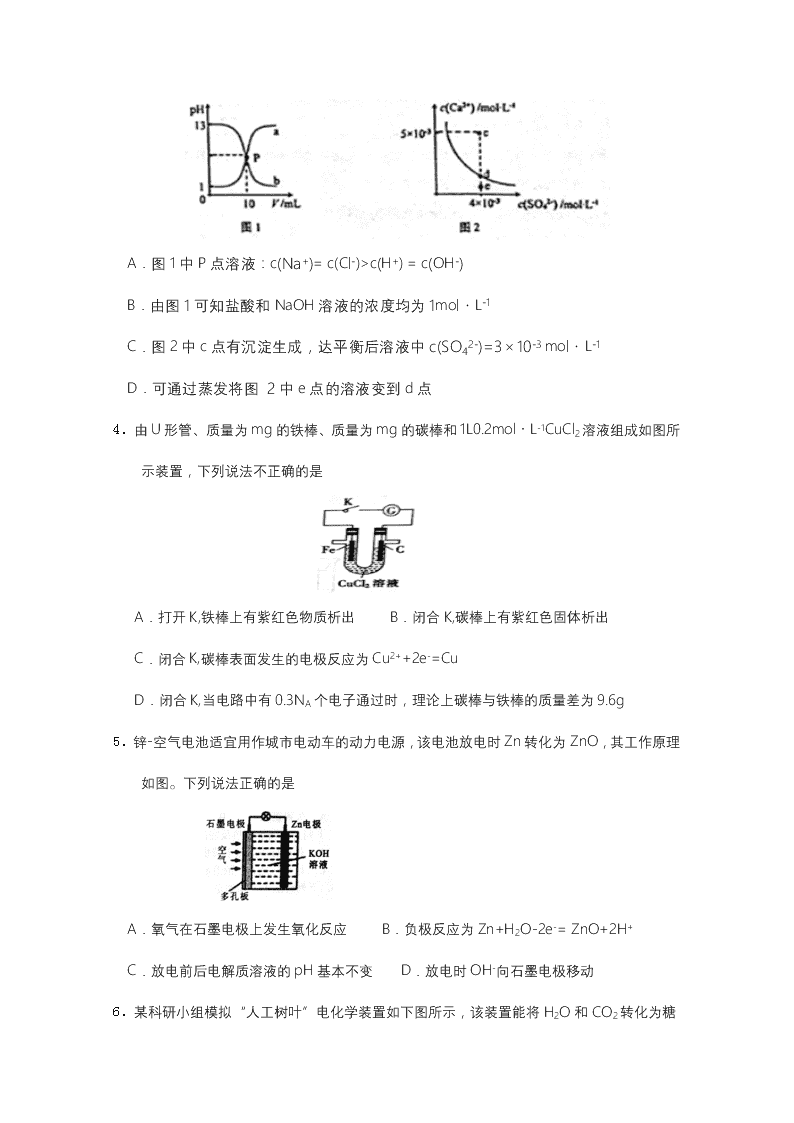
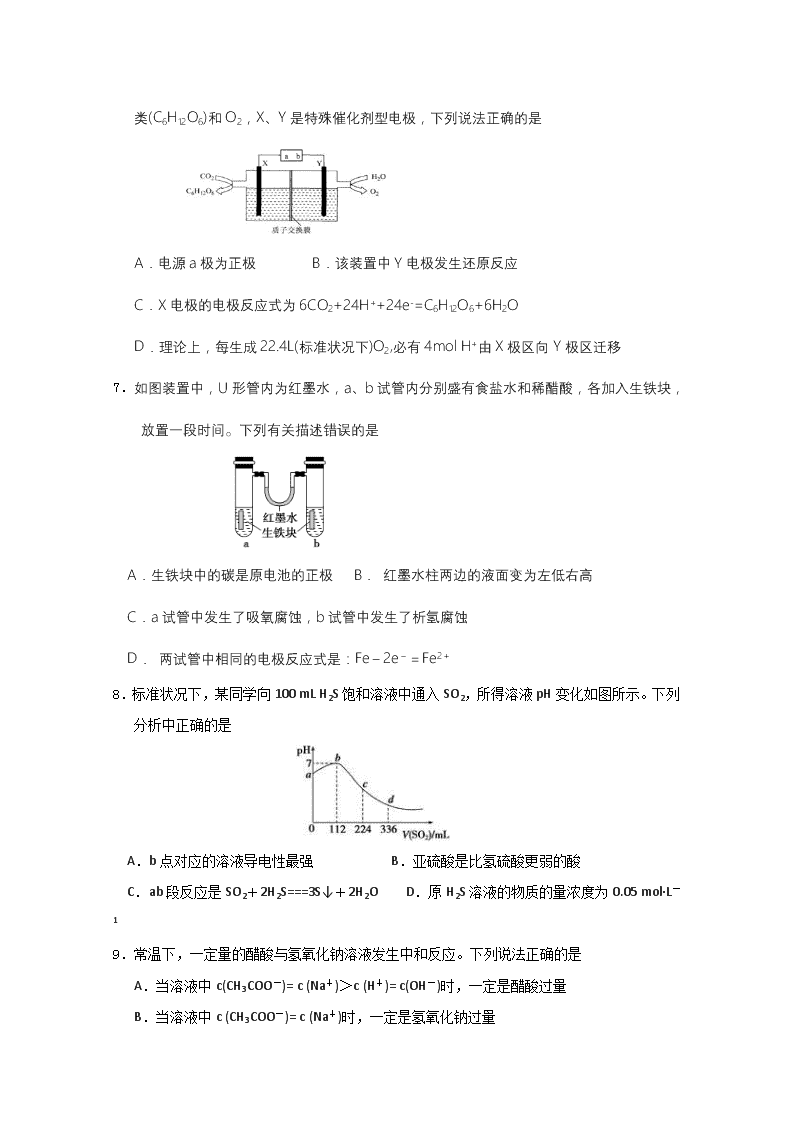
延边第二中学2019~2020学年度第一学期第二次阶段检测 高二年级化学学科试卷 试卷说明:试卷分为两部分,第一部分选择题共20题(共60分),第二部分为非选择题共40分 可能用到的相对原子量:H:1 N:14 O:16 S:32 C:12 Cl:35.5 Ag:108 Mg:24 Na:23 Cu:64 Al:27 Ⅰ部分(共60分) 一、选择题(单选题 每题3分 共60分) 1. 下列化学方程式中,属于水解反应的是 A.H2O+H2OH3O++OH- B.HCO3—+OH-H2O+CO32— C.CO2+H2OH2CO3 D.CO32—+H2O HCO3—+OH- 2.下列说法正确的是 A.Na+、Fe2+、Cl–、NO3–等离子能在甲基橙试液显红色的溶液中共存 B.K+、Mg2+、Cl–、I–等离子能在c(H+) = 10–12 mol·L–1的溶液中共存 C.NaHS水解的离子方程式为:HS–+H2O S2–+H3O+ D.NaHCO3的电离方程式为:NaHCO3=Na++HCO3–,HCO3– H++CO32– 3.己知:图1中a和b分别为常温下盐酸和NaOH溶液互滴的pH变化曲线;图2为常温下CaSO4在水中的沉淀溶解平衡曲线[Ksp(CaSO4)=9×10-6]。下列相关叙述正确的是 A.图1中P点溶液:c(Na+)= c(Cl-)>c(H+) = c(OH-) B.由图1可知盐酸和NaOH溶液的浓度均为1mol·L-1 C.图2中c点有沉淀生成,达平衡后溶液中c(SO42-)=3×10-3 mol·L-1 D.可通过蒸发将图 2中e点的溶液变到d点 4.由U形管、质量为mg的铁棒、质量为mg的碳棒和1L0.2mol·L-1CuCl2溶液组成如图所示装置,下列说法不正确的是 A.打开K,铁棒上有紫红色物质析出 B.闭合K,碳棒上有紫红色固体析出 C.闭合K,碳棒表面发生的电极反应为Cu2++2e-=Cu D.闭合K,当电路中有0.3NA个电子通过时,理论上碳棒与铁棒的质量差为9.6g 5.锌-空气电池适宜用作城市电动车的动力电源,该电池放电时Zn转化为ZnO,其工作原理如图。下列说法正确的是 A.氧气在石墨电极上发生氧化反应 B.负极反应为Zn+H2O-2e-= ZnO+2H+ C.放电前后电解质溶液的pH基本不变 D.放电时OH-向石墨电极移动 6.某科研小组模拟“人工树叶”电化学装置如下图所示,该装置能将H2O和CO2 转化为糖类(C6H12O6)和O2,X、Y是特殊催化剂型电极,下列说法正确的是 A.电源a极为正极 B.该装置中Y电极发生还原反应 C.X电极的电极反应式为6CO2+24H++24e-=C6H12O6+6H2O D.理论上,每生成22.4L(标准状况下)O2,必有4mol H+由X极区向Y极区迁移 7.如图装置中,U形管内为红墨水,a、b试管内分别盛有食盐水和稀醋酸,各加入生铁块,放置一段时间。下列有关描述错误的是 A.生铁块中的碳是原电池的正极 B. 红墨水柱两边的液面变为左低右高 C.a试管中发生了吸氧腐蚀,b试管中发生了析氢腐蚀 D. 两试管中相同的电极反应式是:Fe-2e-=Fe2+ 8.标准状况下,某同学向100 mL H2S饱和溶液中通入SO2,所得溶液pH变化如图所示。下列分析中正确的是 A.b点对应的溶液导电性最强 B.亚硫酸是比氢硫酸更弱的酸 C.ab段反应是SO2+2H2S===3S↓+2H2O D.原H2S溶液的物质的量浓度为0.05 mol·L-1 9.常温下,一定量的醋酸与氢氧化钠溶液发生中和反应。下列说法正确的是 A.当溶液中c(CH3COO-)= c (Na+)>c (H+)= c(OH-)时,一定是醋酸过量 B.当溶液中c (CH3COO-)= c (Na+)时,一定是氢氧化钠过量 C.当溶液中c (CH3COO-)= c (Na+)时,醋酸与氢氧化钠恰好完全反应 D.当溶液中c (Na+)>c (CH3COO-)>c (OH-)>c (H+)时,一定是氢氧化钠过量 10.在一定温度下,向一个容积为2 L的密闭容器内(预先加入催化剂)通入2 mol NH3,经过一段时间达平衡后,测得容器内的压强为起始时的1.2倍。则NH3的转化率为 A.20% B.80% C.10% D.25% 11.25℃时,下列有关溶液中微粒的物质的量浓度关系错误的是 A.0.1mol/L CH3COONa溶液与0.1mol/L HCl溶液等体积混合: c(Na+)=c(Cl-)>c(CH3COO-)>c(OH-) B.含等物质的量的NaX和弱酸HX的混合溶液中一定存在:c(Na+)>c(X-) C.0.1mol/L Na2CO3溶液与0.1mol/L NaHCO3溶液等体积混合: 2c(Na+)=3c(CO32-)+3c(HCO3-)+3c(H2CO3) D.Na2C2O4溶液与HCl溶液等体积混合(H2C2O4是二元弱酸): 2c(C2O42-)+c(HC2O4-)+c(OH-)+c(Cl-)=c(Na+)+c(H+) 12.某温度下,在一个2L的密闭容器中,加入4 molA和2molB进行如下反应: 3A(g)+2B(g)4C(s)+D(g),反应2 min后达到平衡,测得生成1.6 mol C,下列说法正确的是 A、前2min,D的平均反应速率为0.2mol/(L·min) B、此时,B的平衡转化率是40% C、增加B,平衡向右移动,B的平衡转化率增大 D、增大该体系的压强,平衡不移动 13.下列实验操作不能达到目的的是 A.用Na2S溶液和Al2(SO4)3溶液反应制取Al2S3固体 B.用加热蒸发K2CO3溶液的方法获得K2CO3晶体 C.用Na2S溶液和CuSO4溶液反应制取CuS固体 D.在通HCl气体的氛围中加热MgCl2溶液制取MgCl2固体 14.常温下,下列各组离子在指定溶液中一定能大量共存的是 ① 含有大量Fe3+的溶液: Na+、SCN-、Cl-、SO42- ② pH=11的溶液中: CO32-、Na+、NO3-、S2-、K+ ③ 水电离的H+浓度为10-12mol/L的溶液中: NH4+、Na+、SO42-、HCO3- ④ 加入Mg能放出H2的溶液中: Mg2+、NO3-、NH4+、K+、S2O32- ⑤ 澄清溶液中: Fe3+、NO3-、Na+、C1-、SO42- ⑥ c(H+)/c(OH-)=1×10-12的溶液中: K+、Na+、CO32-、NO3- ⑦ 使甲基橙变红的溶液中: Cu2+、SO42-、NH4+、NO3-、C1- A.① ③ ⑤ ⑦ B.① ④ ⑤ ⑥ C.② ④ ⑤ ⑥ D.② ⑤ ⑥ ⑦ 15.某温度下,和的电离常数分别为和。将和体积均相同的两种酸溶液分别稀释,其随加水体积的变化如图所示。下列叙述正确的是 A.曲线Ⅰ代表溶液 B.溶液中水的电离程度:b点>c点 C.相同体积a点的两溶液分别与恰好中和后,溶液中相同 D.从c点到d点,溶液中保持不变(其中、分别代表相应的酸和酸根离子) 16. 全固态锂硫电池能量密度高、成本低,其工作原理如图所示,其中电极a常用掺有石墨烯的S8材料,电池反应为:16Li+xS8=8Li2Sx(2≤x≤8)。下列说法错误的是 A.电池工作时,正极可发生反应:2Li2S6+2Li++2e-=3Li2S4 B.电池充电时间越长,电池中Li2S2的量越多 C.石墨烯的作用主要是提高电极a的导电性 D.电池工作时,外电路中流过0.02 mol电子,负极材料减重0.14 g 17.下列说法不正确的是 A.反应N2(g)+3H2(g)2NH3(g)的ΔH < 0,ΔS <0 B.地下钢铁管道用导线连接锌块可以减缓管道的腐蚀 C.常温下,Ksp=5.6×10−12,pH=10的含Mg2+溶液中,c(Mg2+)≤5.6×10−4 mol·L−1 D.常温常压下,锌与稀H2SO4反应生成11.2 L H2,反应中转移的电子数为6.02×1023 18、下列各组中的比值等于2∶1的是 A、pH都为12的烧碱溶液与Ba(OH)2溶液的物质的量浓度之比 B、K2S溶液中c(K+)与c(S2-)之比 C、相同温度下0.2mol/L醋酸溶液与0.1mol/L醋酸溶液中的c(H+)之比 D、10mL0.5mol/L的盐酸与5mL0.5mol/L的盐酸溶液中的c(H+)之比 19、化学与STSE(社会、科学、技术和环境)密切相关,下列说法不正确的是 A.铁表面镀锌可以增强其抗腐蚀性 B.寻找合适催化剂能使水转化为汽油 C.合理利用太阳能、风能和氢能等能源有利于实现“低碳经济” D.钢铁在潮湿的空气中更容易生锈,其主要原因是形成了原电池 20.用石墨电极完成下列电解实验。 实验一 实验二 装置 现象 a、d处试纸变蓝;b处变红,局部褪色;c处无明显变化 两个石墨电极附近有气泡产生;n处有气泡产生;…… 下列对实验现象的解释或推测不合理的是 A.b处:2Cl--2e-=Cl2↑ B.a、d处:2H2O+2e-=H2↑+2OH- C.c处发生了反应:Fe-2e-=Fe2+ D.根据实验一的原理,实验二中m处能析出铜 II部分(共40分) 二、填空题(共40分) 21、(每空2分 共8分)连二次硝酸(H2N2O2)是一种二元酸,可用于制N2O气体。 (1)常温下,用0.01mol·L-1的NaOH溶液滴定10mL0.01mol·L-1的H2N2O2溶液,测得溶 液pH与NaOH溶液体积的关系如图所示。 ①写出H2N2O2在水溶液中的电离方程式:______________。 ②b点时溶液中c(H2N2O2)_____ c(N2O22-)(填“>”、“<”或 “=”,下同)。 ③a点时溶液中c(Na+)____c(HN2O2-)+c(N2O22-)。 (2)硝酸银溶液和连二次硝酸钠溶液混合,可以得到黄色的连二次硝酸银沉淀,向该分散系中滴加硫酸钠溶液,当白色沉淀和黄色沉淀共存时,分散系中=__________。[已知Ksp(Ag2N2O2)=4.2×10-9,Ksp(Ag2SO4)=1.4×10-5] 22、(8分,每空2分)(1)某温度(t℃)时,水的KW=10-13,则该温度(填大于、等于或小于)______25℃,将此温度下pH=11的NaOH溶液aL与pH=1的H2SO4溶液bL混合, ①若所得混合溶液为中性,则a:b=_________; ②若所得混合溶液pH=2,则a:b=__________。 (2)把FeCl3溶液蒸干,灼烧,最后得到的主要固体产物是 23、(每空2分 共10分) (1)对金属制品进行防腐蚀处理,可延长其使用寿命。 以下为铝材表面处理的一种方法: ①碱洗的目的是除去铝材表面的自然氧化膜,碱洗衣时候常有气泡冒出,原因是:________ (用离子方程式表示)。 ②以铝材为阳极,在H2SO4溶液中电解,铝材表面形成氧化膜,阳极电极反应式为:_____。 取少量废电解液,加入NaHCO3溶液后产生气泡和白色沉淀,产生沉淀的原因是_________。 (用离子方程式表示) (2)如图2所示,组成一种原电池.试回答下列问题(灯泡功率合适): 图2 电解质溶液为NaOH溶液时,Al电极上发生反应的电极反应式为: ; (3)甲醇燃料电池(电解质为KOH溶液,惰性材料作电极)负极反应的电极反应式为: 。 (4) 在氯化铵溶液中,各离子浓度由大到小顺序为 24、(每空2分 共12分) 火力发电厂释放出大量的氮氧化物(NOx)、二氧化硫和二氧化碳等气体会对环境造成严重影响。对燃煤废气进行脱硝、脱硫和脱碳等处理,可实现绿色环保、节能减排、废物利用等目的。 (1)脱硝。利用甲烷催化还原NOx: CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H1=-574 kJ/mol CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) △H2=-1160 kJ/mol 则甲烷直接将NO2还原为N2的热化学方程式为______________。 (2)脱碳。将CO2转化为甲醇的热化学方程式为: CO2(g)+3H2(g)CH3OH(g)+H2O(g) △H3 ① 该反应的平衡常数表达式为_____________。 ②在一恒温恒容密闭容器中充入1 mol CO2和3 mol H2,进行上述反应。测得CO2和CH3OH(g)的浓度随时间变化如右图所示。 试回答:0~10 min内,氢气的平均反应速率为______________mol/(L·min)。 (3)脱硫。 ①有学者想利用如右图所示装置用原电池原理将SO2转化为重要的化工原料,A、B是惰性电极。 A极的电极反应式为_____________。 ②某种脱硫工艺中将废气处理后,与一定量的氨气、空气反应,生成硫酸铵和硝酸铵的混合物,可作为化肥。硫酸铵和硝酸铵的水溶液pH<7,常温下,向一定物质的量浓度的硝酸铵溶液中滴加适量的氨水溶液,使溶液中的NO3-和NH4+的物质的量浓度相等,则溶液的pH 7(填写“>”“=”或“<”)。 (4)金属冶炼和金属化合物处理常涉及氧化还原反应。 若用惰性电极电解饱和NaCl溶液一段时间当阳极产生56 mL(标准状况下)气体,电解后溶液体积为500 mL时,求所得溶液在25℃时的pH =__________。 高二年级化学学科答案 1-5 DDADC 6-10 CBCAA 11-15 BBADD 16-20 BDABD 21.(8分) (1) ①H2N2O2 ⇌ HN2O2—+H+ (HN2O2— ⇌ N2O22— +H+) ②> ③>; (2)3.0×10—4. 22、 (8分) 大于 10:1 9:2 Fe2O3 23. (12分) (1) 2Al + 2OH-+ 4H2O=2Al(OH)4-+ 3H2↑ 2Al + 3H2O -6e-=Al2O3+6H+ Al3++ 3HCO3-==Al(OH)3↓+3CO2↑ (2) Al – 3e- + 4OH- =AlO2- + 2H2O。 (3) CH3OH – 6e- + 8OH- = CO32- + 6H2O (4) c(Cl-)>c(NH4+)>c(H+)>c(OH-) 24.(12分) (1)CH4(g)+2NO2(g)=CO2(g)+2H2O(g)+N2(g)ΔH=-867 kJ/mol; (2)①K=; ② 0.225; (3)SO2-2e-+2H2O=SO42-+4H+ ; =; (4) 12查看更多