2018届二轮复习化学常用计量学案(全国通用)
化学常用计量
考纲:
1.了解相对原子质量、相对分子质量的定义,并能进行有关计算。
2.理解物质的量的含义,并能用于进行简单的化学计算。
3.了解物质的量的单位——摩尔(mol)、摩尔质量、气体摩尔体积,物质的量浓度、阿伏加德罗常数的含义。
4.根据物质的量与微粒(原子、分子、离子等)数目、气体体积(标准状况下)之间的相互关系进行有关计算。
5.能运用化学方程式和离子方程式进行有关计算。
6.了解溶液的组成。理解溶液中溶质的质量分数的概念,并能进行有关计算。
7.能根据要求配制一定溶质质量分数、物质的量浓度的溶液。
考点
一、阿伏加德罗常数的应用
阿伏加德罗常数的常见考查内容和设错形式:
对阿伏加德罗常数的考查往往以选择题的形式,渗透于高中各个知识点中进行考查,试题的知识覆盖面较大,但难度较小,该类试题的特点就是“容易忽视”,即容易落入命题者设置的“陷阱”中,因此明确命题者的考查方向和设错方式有利于我们快速、准确地作出选择。同时要求同学们在解决该类试题时一定要细心、仔细。
1.考查气体体积与物质的量、微粒数目等关系时,故意忽略标准状况条件或给出常温常压条件。
2.物质状态问题。考查气体摩尔体积时,常常用标准状况下非气态的物质来迷惑考生,如水、三氧化硫、己烷、三氯甲烷等。
3.结合氧化还原反应考查电子转移的数目问题,特别是歧化反应的电子转移数目,如过氧化钠与水反应、氯气与水的反应等。
4.结合物质结构的有关知识考查物质的微粒数目(如分子、原子、质子、中子、电子等)、化学键数目等。此处常常涉及的物质有稀有气体(单原子分子)、Na2O2(阴阳离子个数比)、SiO2、Si、P4、CO2(化学键数目)、特殊物质的质量与微粒数间的关系,如D2O、18O2等。
5.考查溶液中离子数目时故意忽视盐类的水解,弱电解质的电离等。
6.结合化学平衡考查时,故意忽视可逆反应不能进行到底的特点。
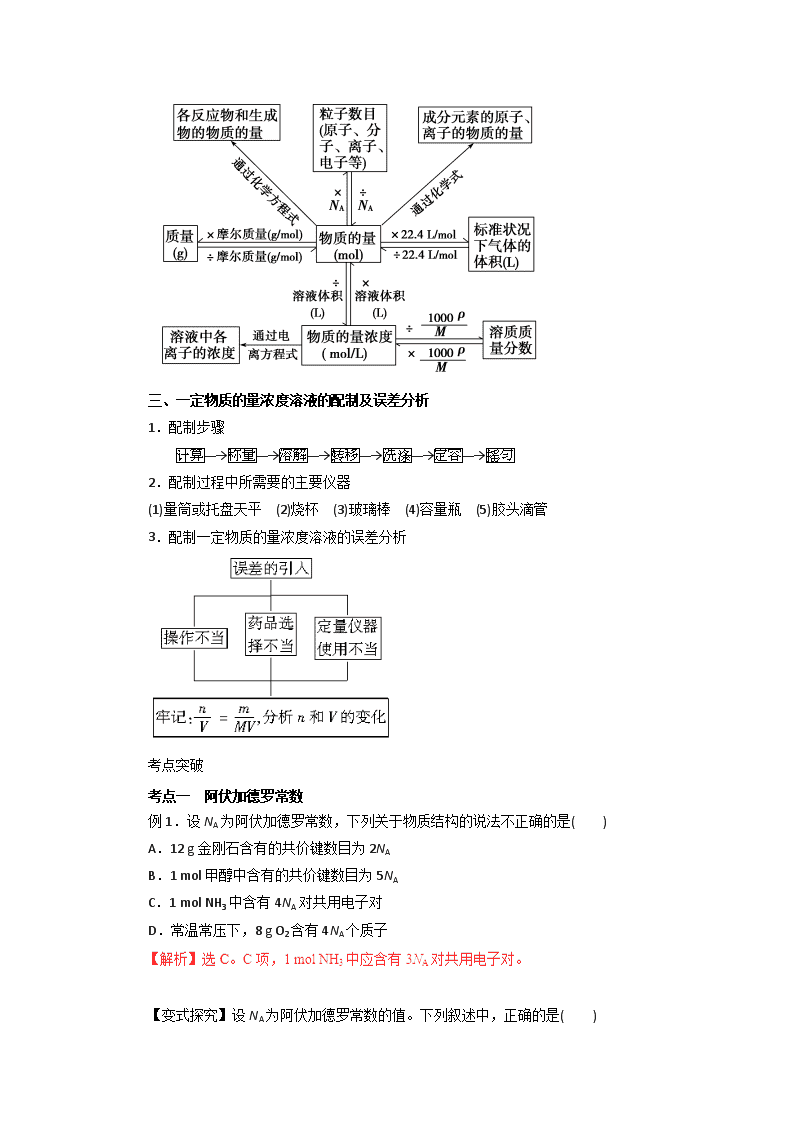
二、以物质的量为中心的有关计算
三、一定物质的量浓度溶液的配制及误差分析
1.配制步骤
―→―→―→―→―→―→
2.配制过程中所需要的主要仪器
(1)量筒或托盘天平 (2)烧杯 (3)玻璃棒 (4)容量瓶 (5)胶头滴管
3.配制一定物质的量浓度溶液的误差分析
考点突破
考点一 阿伏加德罗常数
例1.设NA为阿伏加德罗常数,下列关于物质结构的说法不正确的是( )
A.12 g金刚石含有的共价键数目为2NA
B.1 mol甲醇中含有的共价键数目为5NA
C.1 mol NH3中含有4NA对共用电子对
D.常温常压下,8 g O2含有4NA个质子
【变式探究】设NA为阿伏加德罗常数的值。下列叙述中,正确的是( )
A.12.0 g NaHSO4晶体中阳离子和阴离子的总数为0.3NA
B.14 g分子式为CnH2n的链烃中含有的碳碳双键的数目一定为NA/n
C.标准状况下,1 L液态水中含有的H+数目为10-7NA
D.足量Zn与一定量的浓硫酸反应,产生22.4 L气体时,转移的电子数为2NA
【解析】选B。A项,1个NaHSO4中含有一个Na+和1个HSO,所以12.0 g NaHSO4晶体中阴、阳离子总数应为0.2NA。B项,CnH2n为单烯烃,所以14 g分子式为CnH2n的链烃中,含有的碳碳双键的数目为×NA=。C项,标况下,H2O中H+浓度小于10-7 mol·L-1。D项,没有指明气体所处的状况。
考点二 阿伏加德罗定律
例2.在甲、乙两个体积不同的密闭容器中,分别充入质量相同的CO、CO2气体时,两容器的温度和压强均相同,则下列说法正确的是( )
A.充入的CO分子数比CO2分子数少
B.甲容器的体积比乙容器的体积小
C.CO的摩尔体积比CO2的摩尔体积小
D.甲中CO的密度比乙中CO2的密度小
【变式探究】在两个密闭容器中,分别充有质量相同的甲、乙两种气体,若它们的温度和密度均相同,试根据甲、乙的摩尔质量(M)关系,判断下列说法正确的是( )
A.若M(甲)>M(乙),则气体体积:甲<乙
B.若M(甲)
乙
C.若M(甲)>M(乙),则气体的摩尔体积:甲<乙
D.若M(甲)乙,根据阿伏加德罗定律可知,体积相同时压强与物质的量成正比,故气体的压强:甲>乙,B正确;根据n=m/M,若M(甲)>M(乙),气体的物质的量:甲<乙,根据Vm=可知,气体的摩尔体积:甲>乙,故C错误;根据n=m/M,若M(甲)n(乙)
,气体的分子数:甲>乙,故D错误。
考点三 一定物质的量浓度溶液的配制
力3.体积为V、密度为ρ的某溶液中,含有摩尔质量为M的溶质m g。若此溶液中溶质的物质的量浓度为c,溶质的质量分数为w,则下列各表示式中正确的是( )
A.c= B.m=Vρw
C.w= D.ρ=
【解析】选A。已知:c=1 000或c=。
A项,c=,正确;B项,=,m=1 000ρwV,错误;C项,w=,错误;D项,ρ=,注意w与w%的区别,错误。
【变式探究】实验室常用98%(ρ=1.84 g·mL-1)的浓H2SO4配制1∶4 的稀H2SO4,此稀H2SO4的密度为1.23 g·mL-1,其物质的量浓度为( )
A.4.6 mol·L-1 B.5.7 mol·L-1
C.3.88 mol·L-1 D.18.4 mol·L-1
考点巩固
1、CO2是重要的化工原料,也是应用广发的化工产品。CO2与过氧化钠或超氧化钾反应可产生氧气。
完成下列计算:
(1)CO2通入氨水生成NH4HCO3,NH4HCO3很容易分解。2.00 mol NH4HCO3完全分解,分解产物经干燥后的体积为_________L(标准状况)。
(2)某H2中含有2.40 molCO2,该混合气体通入2.00 L NaOH溶液中,CO2被完全吸收。如果NaOH完全反应,该NaOH溶液的浓度为_______。
(3)CO2和KO2有下列反应:
4KO2+2CO2→2K2CO3+3O2
4KO2+4CO2+2H2O→4KHCO3+3O2
若9 mol CO2在密封舱内和KO2反应后生成9 mol O2,则反应前密封舱内H2O
的量应该是多少?列式计算。
(4)甲烷和水蒸气反应的产物是合成甲醇的原料:CH4+H2OCO+3H2
已知:CO+2H2CH3OH CO2+3H2CH3OH+H2O
300 mol CH4完全反应后的产物中,加入100 mol CO2后合成甲醇。若获得甲醇350 mol,残留氢气120 mol,计算CO2的转化率。
【答案】(本题共14分)
(1)89.6
(2)2.4 mol/L≥c≥1.2 mol/L
(3)
n(H2O)=(9/6)×2=3(mol)
(4)300 mol CH4完全反应产生H2 900mol
设CO2转化率为α,CO转化率为β
300β+100α=350 600β+300α=900-120
α=80%
或设CO2转化率为α 900−350×2−100α=120 α=80/100=80%
(3)法一:
依题意,9 mol CO2在密封舱内和KO2反应后生成9 mol O2,即n(CO2)∶n(O2)=1∶1,通过观察题给两个方程式可知,当把两个方程式相加时正好符合题目要求:
8KO2+6CO2+2H2O→2K2CO3+4KHCO3+6O2
所以有n(H2O)=n(CO2)=×9mol=3mol,即反应前密封舱内H2O的物质的量为3mol。
法二:
设反应前密封舱内H2O的物质的量为n
4KO2 + 4CO2 + 2H2O → 4KHCO3 + 3O2
2nn 1.5n
4KO2 + 2CO2 → 2K2CO3 + 3O2
9-2n 1.5(9-2n)
根据题意生成氧气9mol,所以有1.5n+ 1.5(9-2n)=9mol,解得n=3mol,即反应前密封舱内
H2O的物质的量为3mol。
(4)法一:
CH4+ H2OCO + 3H2
300mol 300mol 900mol
设CO2的转化率为α,CO的转化率为β
CO + 2H2CH3OH CO2 + 3H2CH3OH + H2O
300βmol 600βmol 300βmol 100αmol 300αmol 100αmol
根据题意,共生成350mol甲醇,所以有300βmol+100αmol=350mol-------①式
根据题意,反应后残留氢气120mol,则实际参加反应的氢气为900mol-120 mol,所以有
600βmol+300αmol=900mol-120 mol--------②式
由①②式可得α=0.8,即CO2的转化率为80%。
2.设NA为阿伏伽德罗常数的数值。下列说法正确的是
A.1mol甲苯含有6NA个C-H键
B.18gH2O含有10NA个质子
C.标准状况下,22.4L氨水含有NA个NH3分子
D.56g铁片投入足量浓硫酸中生成NA个SO2分子
【答案】B
【解析】 A、根据甲苯的结构简式判断1mol甲苯含有8NA个C-H键,错误;B、1个水分子中含有10个质子,18g水的物质的量是1mol,所以18gH2O含有10mol即10NA个质子,正确;C、标准状况下氨水不是气体,所以不能计算其物质的量,错误;D、铁在常温下与浓硫酸发生钝化,加热可使反应继续进行,但56g即1molFe与足量浓硫酸发生氧化还原反应时,生成铁离子,转移电子3mol,所以应生成1.5mol的二氧化硫即1.5NA个SO2分子,错误,答案选B。
【考点定位】考查阿伏伽德罗常数的应用
【考点定位】考查化学常用计量(阿伏加德罗常数)。
3.(2014·高考上海卷第16题)含有砒霜(As2O3)的试样和锌、盐酸混合反应,生成的砷化氢(AsH3)在热玻璃管中完全分解成单质砷和氢气。若砷的质量为1.50mg,则
A.被氧化的砒霜为1.98mg
B.分解产生的氢气为0.672ml
C.和砒霜反应的锌为3.90mg
D.转移的电子总数为6×10―5NA
【答案】C
【考点定位】考查氧化还原反应的有关判断与计算