2020届高考化学一轮复习(浙江)化学反应的方向与限度作业
第二单元 化学反应的方向与限度
1.(2018浙江11月选考,14,2分)已知X(g)+Y(g) 2W(g)+M(g) ΔH=a kJ·mol-1(a>0)。一定温度下,在体积恒定的密闭容器中,加入1 mol X(g)与1 mol Y(g),下列说法正确的是( )
A.充分反应后,放出热量为a kJ
B.当反应达到平衡状态时,X与W的物质的量浓度之比一定为1∶2
C.当X的物质的量分数不再改变,表明该反应已达平衡
D.若增大Y的浓度,正反应速率增大,逆反应速率减小
答案 C A项,由题意知a>0,反应吸热,由于X(g)+Y(g) 2W(g)+M(g)属于可逆反应,1 mol X(g)与1 mol Y(g)充分反应后不可能完全转化为W(g)和M(g),吸收热量小于a kJ,故A错误;B项,当反应达到平衡状态时,正反应速率和逆反应速率相等,反应混合物中各组分的浓度保持不变,但X与W的物质的量浓度之比不一定为1∶2,故B错误;C项,当X的物质的量分数不再改变,说明正反应速率和逆反应速率相等,表明该反应已达平衡,故C正确;D项,若增大Y的浓度,正反应速率增大,逆反应速率也应该增大,故D错误。
2.一定温度下,在2 L的密闭容器中发生反应:xA(g)+B(g) 2C(g) ΔH<0,A、C的物质的量随时间变化的关系如图所示。下列有关说法正确的是 ( )
A.x=1
B.反应进行到1 min时,反应体系达到化学平衡状态
C.2 min后,A的正反应速率一定等于C的逆反应速率
D.2 min后,容器中A与B的物质的量之比一定为2∶1
答案 C 由题图知,x∶2=(0.3 mol-0.1 mol)∶0.2 mol,故x=2,A错误;反应进行到2 min时,A、C的物质的量不再发生变化,反应达到化学平衡,B错误;2 min后反应处于平衡状态,因x=2,v(A)正=v(C)正=v(C)逆,C正确;若起始时A与B的物质的量之比不是2∶1,则平衡时A与B的物质的量之比不是2∶1,D错误。
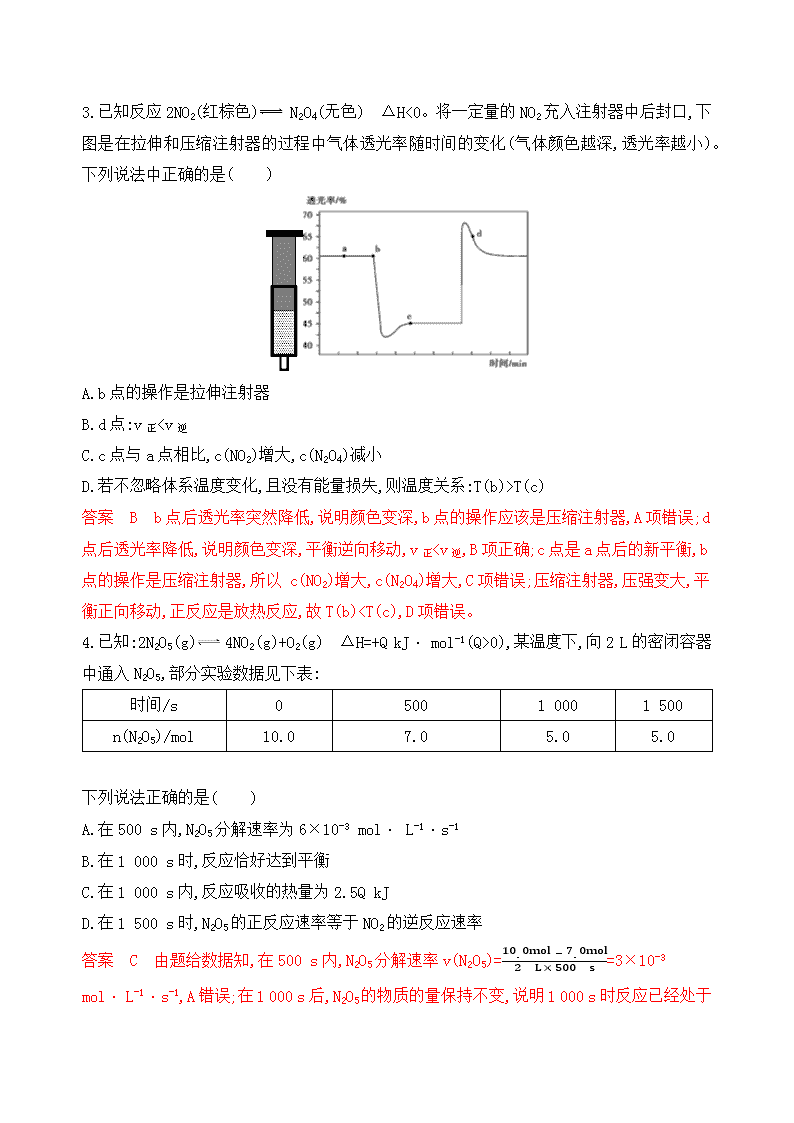
3.已知反应2NO2(红棕色) N2O4(无色) ΔH<0。将一定量的NO2充入注射器中后封口,下图是在拉伸和压缩注射器的过程中气体透光率随时间的变化(气体颜色越深,透光率越小)。下列说法中正确的是( )
A.b点的操作是拉伸注射器
B.d点:v正
T(c)
答案 B b点后透光率突然降低,说明颜色变深,b点的操作应该是压缩注射器,A项错误;d 点后透光率降低,说明颜色变深,平衡逆向移动,v正0),某温度下,向2 L的密闭容器中通入N2O5,部分实验数据见下表:
时间/s
0
500
1 000
1 500
n(N2O5)/mol
10.0
7.0
5.0
5.0
下列说法正确的是( )
A.在500 s内,N2O5分解速率为6×10-3 mol· L-1·s-1
B.在1 000 s时,反应恰好达到平衡
C.在1 000 s内,反应吸收的热量为2.5Q kJ
D.在1 500 s时,N2O5的正反应速率等于NO2的逆反应速率
答案 C 由题给数据知,在500 s内,N2O5分解速率v(N2O5)=10.0mol-7.0mol2 L×500 s=3×10-3 mol· L-1·s-1,A错误;在1 000 s后,N2O5的物质的量保持不变,说明1 000 s时反应已经处
于平衡状态,但不知何时反应恰好达到平衡,B错误;由热化学方程式知,在1 000 s内,反应吸收的热量为(10.0 mol-5.0 mol)×Q2 kJ· mol-1=2.5Q kJ,C正确;在1 500 s时,反应处于平衡状态,v(NO2)逆=2v(N2O5)正,D错误。
5.在恒容密闭容器中,可以作为2NO2(g) 2NO(g)+O2(g)达到平衡状态标志的是( )
①单位时间内生成n mol O2的同时生成2n mol NO2
②单位时间内生成n mol O2的同时生成2n mol NO
③混合气体的颜色不再改变
④混合气体的密度不再改变
⑤混合气体的平均相对分子质量不再改变
⑥混合气体中NO与O2的物质的量之比保持恒定
⑦混合气体的总压强保持恒定
A.①③⑤⑦ B.②④⑤
C.①③④ D.①②③④⑤
答案 A ①单位时间内生成n mol O2的同时生成2n mol NO2,证明正、逆反应速率相等,反应达到平衡,正确;②O2和NO均为正反应产物,②中所述不能证明反应达到平衡,错误;③混合气体的颜色不再改变,证明NO2的浓度不随时间的变化而变化,证明反应达到了平衡,正确;④化学反应前后质量守恒,容器容积不变,混合气体的密度始终不变,错误;⑤化学反应前后物质的量变化,质量守恒,所以混合气体的平均相对分子质量不再变化即可证明反应达到了平衡状态,正确;⑥NO和O2均为正反应产物,二者物质的量之比保持恒定,不能作为反应达到平衡的依据,错误;⑦混合气体的总压强不再改变,证明生成物和反应物的物质的量不再变化,反应达到平衡,正确。
6.一定温度下,可逆反应A(g)+3B(g)2C(g)在定容密闭容器中进行,下列能说明该反应达到平衡状态的是( )
A.单位时间内有a mol A生成,同时生成3a mol B
B.混合气体的总压强不再变化
C.用A、B、C的物质的量浓度变化表示的反应速率之比为1∶3∶2
D.混合气体的密度不再变化
答案 B 生成A和生成B都是说的逆反应,不能说明反应达到平衡,故A错误;因为反应前后气体总体积改变,当总压强不变时,说明反应达到平衡状态,故B正确;C选项中没有说明
反应速率表示的方向,不能说明反应达到平衡状态,故C错误;因为总质量不变,容器的体积不变,所以密度始终不变,故D错误。
7.对可逆反应2SO2(g)+O2(g)2SO3(g),下列判断正确的是( )
A.若单位时间内生成x mol SO3的同时,消耗x mol SO2,则反应达到平衡状态
B.达到化学平衡时,2v正(O2)=v逆(SO3)
C.平衡时,SO2的浓度必定等于O2浓度的2倍
D.达到化学平衡时,若增大容器体积,则正反应速率减小,逆反应速率增大
答案 B 本题考查到达化学平衡状态的标志。A项从物质的生成和消耗的角度分析,应该是单位时间内生成x mol SO3的同时,生成x mol SO2,则反应达到平衡状态。B项从反应速率的角度分析,不同种物质表示的平均反应速率和化学计量数成正比关系,2v正(O2)=v逆(SO3),说明v逆(SO3)=v正(SO3),所以达到平衡。C项说法不一定,平衡时物质的浓度和起始加入的量有关。D项增大容器体积,即容器内压强减小,正、逆反应速率都减小,只是减小的程度不一样。
8.某温度下,在一固定容积的容器中进行反应:3A(g)+B(g)2C(g)+2D(g),下列情况一定能说明反应已达到平衡状态的是( )
A.压强不再随时间而改变时
B.气体的总质量不再改变时
C.混合气体中各组成成分的含量不再改变时
D.单位时间内每消耗1 mol B,同时有2 mol C生成时
答案 C 判断一反应是否达到平衡状态,从宏观上看各种成分的量是否发生改变,从微观上看正、逆反应速率是否相等。因为此反应中各成分均为气体且反应前后气体的总体积相等,所以无论是否达到平衡,压强和质量都不发生改变,故A、B两项不正确;混合气体中各组成成分的含量不再改变时表明正反应速率与逆反应速率相等,说明反应已达到平衡状态,,故C正确;消耗1 mol B同时有2 mol C生成均为正反应方向,D项不能证明正反应速率与逆反应速率相等,故D不正确。
9.一定条件下,在密闭容器里进行反应:S2Cl2(l)+Cl2(g)2SCl2(l) ΔH=-61.16 kJ·mol-1。下列说法不正确的是( )
A.达到平衡时单位时间内生成n mol Cl2的同时生成2n mol SCl2
B.1 mol Cl2与足量S2Cl2充分反应放出的热量为61.16 kJ
C.达到平衡时,单位时间内消耗n mol S2Cl2的同时生成n mol Cl2
D.升高温度,正反应速率加快,逆反应速率也加快
答案 B 由于题述可逆反应为平衡状态,所以单位时间内生成n mol Cl2的同时生成2n mol SCl2,故A正确;由于可逆反应不可能进行到底,所以1 mol Cl2与足量S2Cl2充分反应不可能完全转化为SCl2,放出的总热量小于61.16 kJ,故B不正确;C选项能表示出正、逆反应速率相等,故C正确;升高温度对任何化学反应的速率都起加快作用,所以正反应速率加快,逆反应速率也加快,故D正确。
10.(2017浙江4月选考,30,10分)以氧化铝为原料,通过碳热还原法可合成氮化铝(AlN);通过电解法可制取铝。电解铝时阳极产生的CO2可通过二氧化碳甲烷化再利用。
请回答:
(1)已知:2Al2O3(s) 4Al(g)+3O2(g) ΔH1=3 351 kJ·mol-1
2C(s)+O2(g) 2CO(g) ΔH2=-221 kJ·mol-1
2Al(g)+N2(g) 2AlN(s) ΔH3=-318 kJ·mol-1
碳热还原Al2O3合成AlN的总热化学方程式是 ,
该反应自发进行的条件 。
(2) 在常压、Ru/TiO2催化下,CO2和H2混合气体(体积比1∶4,总物质的量a mol)进行反应,测得CO2转化率、CH4和CO选择性随温度变化情况分别如图1和图2所示(选择性:转化的CO2中生成CH4或CO的百分比)。
反应Ⅰ
CO2(g)+4H2(g) CH4(g)+2H2O(g) ΔH4
反应Ⅱ
CO2(g)+H2(g) CO(g)+H2O(g) ΔH5
图1
图2
①下列说法不正确的是 。
A.ΔH4小于零
B.温度可影响产物的选择性
C.CO2平衡转化率随温度升高先增大后减少
D.其他条件不变,将CO2和H2的初始体积比改变为1∶3,可提高CO2平衡转化率
②350 ℃时,反应Ⅰ在t1时刻达到平衡,平衡时容器体积为V L,该温度下反应Ⅰ的平衡常数为 (用a、V表示)。
③350 ℃下CH4物质的量随时间的变化曲线如图3所示。画出400 ℃下0~t1时刻CH4物质的量随时间的变化曲线。
图3
(3) 据文献报道,CO2可以在碱性水溶液中电解生成甲烷,生成甲烷的电极反应式是 。
答案 (1)Al2O3(s)+3C(s)+N2(g) 2AlN(s)+3CO(g) ΔH=1 026 kJ·mol-1 高温
(2)①CD ②625V2a2
③
(3)CO2+6H2O+8e- CH4+8OH-
解析 (1)将题给热化学方程式依次标记为①、②、③,则①+②×3+③×2即得:2Al2O3(s)+6C(s)+2N2(g) 4AlN(s)+6CO(g) ΔH=ΔH1+3ΔH2+2ΔH3=3 351 kJ·mol-1+3×(-221 kJ·mol-1)+2×(-318 kJ·mol̄1)=2 052 kJ·mol-1,即:Al2O3(s)+3C(s)+N2(g) 2AlN(s)+3CO(g) ΔH=1 026 kJ·mol-1;因该反应的ΔH>0,ΔS>0,反应自发进行需ΔH-TΔS<0,故条件是高温。
(2)①根据图2可知当温度从150 ℃升至400 ℃时,只发生反应Ⅰ;由图1可知温度低于340 ℃时,反应未达到平衡,CO2转化率增大,温度从340 ℃升至400 ℃,CO2转化率减小,平衡逆向移动,说明反应Ⅰ是放热反应,ΔH4<0,A正确。由图2可知,温度高于400 ℃,随温度升高,CH4的选择性下降,CO的选择性升高,说明温度可影响产物的选择性,B正确。由图1可知CO2转化率随温度升高先增大后减小,但温度低于340 ℃时反应未达到平衡,不是平衡转化率,C错误。其他条件不变,将CO2和H2的初始体积比由1∶4改变为1∶3,CO2平衡转化率会降低,D错误。②由图2可知在350 ℃时只发生反应Ⅰ,由图1可知350 ℃时CO2的平衡转化率为80%。
CO2(g) + 4H2(g) CH4(g) + 2H2O(g)
n(起始)/mol 0.2a 0.8a 0 0
n(变化)/mol 0.2a×80% 4×0.2a×80% 0.2a×80% 2×0.2a×80%
n(平衡)/mol 0.04a 0.16a 0.16a 0.32a
该温度下反应Ⅰ的平衡常数K=c(CH4)·c2(H2O)c(CO2)·c4(H2)=0.16aV·0.32aV20.04aV·0.16aV4=625V2a2。③根据图1可知400 ℃时CO2转化率为72%,故平衡时CH4的物质的量为0.144a mol;另外,温度升高,反应速率加快,达到平衡所需的时间缩短,曲线比350 ℃时先出现拐点,依此可画出400 ℃下0~t1时刻CH4的物质的量随时间的变化曲线。
(3)CO2转化成CH4,碳元素化合价从+4价降低到-4价,考虑到电解质溶液呈碱性,可写出电解时生成甲烷的电极反应式CO2+6H2O+8e- CH4+8OH-。
11.氯及其化合物在生活和生产中应用广泛。
(1)已知:900 K时,4HCl(g)+O2(g) 2Cl2(g)+2H2O(g),反应自发。
①该反应是放热还是吸热,判断并说明理由 。
②900 K时,体积比为4∶1的HCl和O2在恒温恒容的密闭容器中发生反应,HCl的平衡转化率α(HCl)随压强(p)变化曲线如图。保持其他条件不变,升温到T K(假定反应历程不变),请画出压强在1.5×105~4.5×105 Pa范围内,HCl的平衡转化率α(HCl)随压强(p)变化曲线示意图。
(2)已知:Cl2(g)+2NaOH(aq) NaCl(aq)+NaClO(aq)+H2O(l) ΔH1=-102 kJ·mol-1
3Cl2(g)+6NaOH(aq) 5NaCl(aq)+NaClO3(aq)+3H2O(l) ΔH2=-422 kJ·mol-1
①写出在溶液中NaClO分解生成NaClO3的热化学方程式: 。
②用过量的冷NaOH溶液吸收氯气,制得NaClO溶液(不含NaClO3),此时ClO-的浓度为c0 mol·L-1;加热时NaClO转化为NaClO3,测得t时刻溶液中ClO-浓度为ct mol·L-1,写出该时刻溶液中Cl-浓度的表达式:c(Cl-)= mol·L-1(用c0、ct表示)。
③有研究表明,生成NaClO3的反应分两步进行:
Ⅰ.2ClO- ClO2-+Cl-
Ⅱ.ClO2-+ClO- ClO3-+Cl-
常温下,反应Ⅱ能快速进行,但氯气与NaOH溶液反应很难得到NaClO3,试用碰撞理论解释其原因: 。
(3)电解NaClO3水溶液可制备NaClO4。在电解过程中由于阴极上吸附氢气,会使电解电压升高,电解效率下降。为抑制氢气的产生,可选择合适的物质(不引入杂质),写出该电解的总化学方程式 。
答案 (1)①放热反应,ΔS<0且反应自发
②
(2)①3NaClO(aq) 2NaCl(aq)+NaClO3(aq)
ΔH=-116 kJ·mol-1
②c0+2(c0-ct)3或5c0-2ct3
③反应Ⅰ的活化能高,活化分子百分数低,不利于ClO-向ClO3-转化
(3)2NaClO3+O2 2NaClO4
解析 (1)①由题给信息可知ΔS<0,又知该反应自发,则ΔH-TΔS<0,可得ΔH<0,故该反应放热。
②由①可知该反应放热,所以随温度上升,平衡左移,氯化氢的平衡转化率降低。
(2)①由盖斯定律可得3NaClO(aq) 2NaCl(aq)+NaClO3(aq)
ΔH=ΔH2-3ΔH1=[(-422)-3×(-102)]kJ·mol-1=-116 kJ·mol-1。
②根据题意,溶液中的氯离子由两部分组成,一部分是Cl2与冷NaOH溶液反应产生的,浓度为c0 mol·L-1,另一部分来自次氯酸钠转化为氯酸钠时的副产物氯化钠。
3NaClO ~ 2NaCl
3 2
c0-ct x
计算得到x=2(c0-ct)/3,则c(Cl-)=[c0+2(c0-ct)3]mol·L-1。
(3)题目中要求不产生氢气,我们可以引入氧气,总化学方程式为2NaClO3+O2 2NaClO4,此反应无副产物产生,且反应物易得。