2020届高考化学二轮复习工艺流程题作业
题型专练(八) 工艺流程题
A组
1.(2019·宁夏银川一中二模)某工厂用软锰矿(主要成分是MnO2,含少量Al2O3和SiO2)和闪锌矿(主要成分是ZnS,含少量FeS、CuS等杂质)为原料制备MnO2和Zn(干电池原料),其简化流程如下:
已知:反应Ⅰ中所有金属元素均以离子形式存在。回答下列问题:
(1)滤渣1中除了SiO2以外,还有一种淡黄色物质,该物质是由MnO2、CuS与硫酸共热时产生的,请写出该反应还原产物的化学式 。
(2)反应Ⅱ中加入适量金属锌的目的是为了回收某种金属,请写出该反应的离子方程式 。
(3)反应Ⅲ中X可以是 (填字母代号)。它的作用是 。
a.MgO b.Zn(OH)2
c.Cu2(OH)2CO3 d.MnCO3
(4)反应Ⅳ中电极均是惰性电极,写出阴极电极反应式 。
(5)已知:H2S的电离常数K1=1.0×10-7,K2=7.0×10-15。0.1 mol·L-1 NaHS的pH 7(填“>”“=”或“<”),理由是 。
(6)在废水处理领域中常用H2S将Mn2+转化为MnS而除去,向含有0.020 mol·L-1 Mn2+废水中通入一定量的H2S气体,调节溶液的pH=a,当HS-浓度为1.0×10-4 mol·L-1时,Mn2+开始沉淀,则a= [已知:Ksp(MnS)=1.4×10-15]。
答案(1)MnSO4
(2)Cu2++ZnCu+Zn2+
(3)bd 增大溶液的pH,使Fe3+和Al3+转化成氢氧化物沉淀
(4)Zn2++2e-Zn
(5)> HS-的水解常数Kh=KWK1=1×10-141×10-7=10-7,由于10-7>7.0×10-15,故HS-的水解程度大于其电离程度,溶液显碱性
(6)5
解析(1)MnO2、CuS与硫酸共热发生氧化还原反应生成MnSO4、CuSO4、S和H2O,CuS中硫元素化合价升高,氧化产物是S单质,锰元素由+4价降低为+2价,还原产物是MnSO4;
(2)根据流程图,反应Ⅱ中加入适量金属锌可以置换出金属铜,反应的离子方程式是Cu2++ZnCu+Zn2+;
(3)根据流程图,反应Ⅲ中加入X的目的是增大溶液的pH使Fe3+和Al3+转化为氢氧化物沉淀;加入MgO会引入杂质Mg2+,故不选a;若加入Zn(OH)2,能调节pH且不引入杂质;加入Cu2(OH)2CO3会引入杂质Cu2+,故不选c;若加入MnCO3,能调节pH且不引入杂质,故选bd。
(4)反应Ⅳ中,阴极发生还原反应生成金属锌,阴极电极反应式是Zn2++2e-Zn;
(5)NaHS溶液中HS-既能水解又能电离,HS-的电离常数是7.0×10-15,HS-的水解常数是KWK1=10-141.0×10-7=1.0×10-7>K2=7.0×10-15,即HS-在溶液中水解大于电离,溶液呈碱性,pH>7;
(6)向含有0.020 mol·L-1 Mn2+废水通入H2S,Mn2+开始沉淀时,c(S2-)=Ksp(MnS)c(Mn2+)=1.4×10-150.02 mol·L-1=7×10-14 mol·L-1,此时HS-浓度为1.0×10-4 mol·L-1,根据K2=c(H+)c(S2-)c(HS-)=7.0×10-15,c(H+)=7.0×10-15×1×10-47×10-14 mol·L-1=1×10-5 mol·L-1,所以a=5。
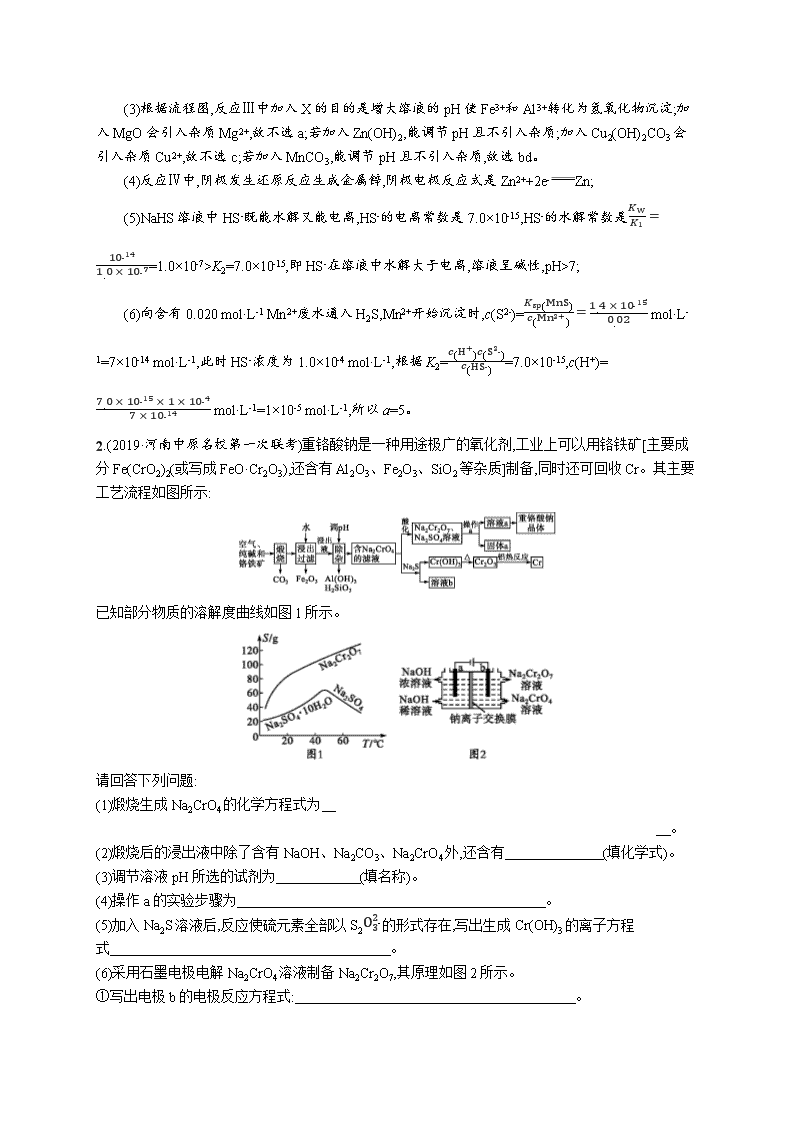
2.(2019·河南中原名校第一次联考)重铬酸钠是一种用途极广的氧化剂,工业上可以用铬铁矿[主要成分Fe(CrO2)2(或写成FeO·Cr2O3),还含有Al2O3、Fe2O3、SiO2等杂质]制备,同时还可回收Cr。其主要工艺流程如图所示:
已知部分物质的溶解度曲线如图1所示。
请回答下列问题:
(1)煅烧生成Na2CrO4的化学方程式为
。
(2)煅烧后的浸出液中除了含有NaOH、Na2CO3、Na2CrO4外,还含有 (填化学式)。
(3)调节溶液pH所选的试剂为 (填名称)。
(4)操作a的实验步骤为 。
(5)加入Na2S溶液后,反应使硫元素全部以S2O32-的形式存在,写出生成Cr(OH)3的离子方程式 。
(6)采用石墨电极电解Na2CrO4溶液制备Na2Cr2O7,其原理如图2所示。
①写出电极b的电极反应方程式: 。
②测定阳极液中Na元素和Cr元素的含量,若Na元素与Cr元素的物质的量之比为n,则此时Na2CrO4的转化率为 。
(7)根据有关国家标准,含CrO42-的废水要经化学处理使其浓度降至5.0×10-7 mol·L-1以下才能排放。可采用加入可溶性钡盐生成BaCrO4沉淀[Ksp(BaCrO4)=1.2×10-10],再加入硫酸处理多余的Ba2+的方法处理废水。加入可溶性钡盐后,废水中Ba2+的浓度应不小于 mol·L-1,废水处理后方能达到国家排放标准。
答案(1)4Fe(CrO2)2+7O2+8Na2CO32Fe2O3+8Na2CrO4+8CO2
(2)Na2SiO3、NaAlO2
(3)稀硫酸
(4)蒸发浓缩、冷却结晶、过滤
(5)23H2O+6S2-+8CrO42-8Cr(OH)3↓+3S2O32-+22OH-
(6)①2H2O-4e-O2↑+4H+ ②(2-n)×100%
(7)2.4×10-4
解析(1)铬铁矿主要成分Fe(CrO2)2,还含有Al2O3、Fe2O3、SiO2等杂质,加入纯碱和空气高温煅烧生成Na2CrO4的化学方程式为:4Fe(CrO2)2+7O2+8Na2CO32Fe2O3+8Na2CrO4+8CO2。
(2)根据调节pH后产生滤渣Al(OH)3和H2SiO3可知,加入纯碱和空气高温煅烧后再加水过滤,浸出液中除了含有NaOH、Na2CO3、Na2CrO4外应该还含有Na2SiO3、NaAlO2。
(3)根据酸化后的产物中有Na2SO4,可知调节溶液pH所选的试剂为稀硫酸。
(4)溶液通过操作a后分离为溶液a和固体a两部分,从溶液a可以提取重铬酸钠晶体,则固体a为硫酸钠晶体。根据溶解度曲线,硫酸钠的溶解度在较高温度下较小,在较低温度下也较小,故可以蒸发浓缩得到硫酸钠的饱和溶液,再降温结晶析出硫酸钠晶体,所以操作a为蒸发浓缩、冷却结晶、过滤。
(5)含Na2CrO4的滤液加入Na2S溶液后,硫元素全部以S2O32-的形式存在,CrO42-转化成Cr(OH)3,反应的离子方程式为23H2O+6S2-+8CrO42-8Cr(OH)3↓+3S2O32-+22OH-。
(6)①根据电池的正负极确定电解池b为阳极,电极反应式为:2H2O-4e-O2↑+4H+。
②电解制备Na2Cr2O7过程的总反应方程式为2Na2CrO4+3H2ONa2Cr2O7+2NaOH+2H2↑+O2↑,设加入反应容器内的Na2CrO4为1 mol,反应过程中有x mol Na2CrO4转化为Na2Cr2O7,则阳极区剩余Na2CrO4为(1-x) mol,对应的n(Na)=2(1-x) mol,生成的Na2Cr2O7为x2 mol,对应的n(Na)=x mol,n(Cr)=x mol,根据:Na与Cr的物质的量之比为n,计算得出x=(2-n) mol,转化率为2-n1×100%=(2-n)×100%;
(7)国家标准含CrO42-的废水要经化学处理,使其浓度降至5.0×10-7 mol·L-1以下才能排放,所以c(Ba2+)=Ksp(BaCrO4)c(CrO42-)=1.2×10-105.0×10-7 mol·L-1=2.4×10-4 mol·L-1。
3.(2019·广东揭阳二模)无水氯化铝在生产、生活中应用广泛。
(1)氯化铝水溶液呈 性,原因是(用离子方程式表示) ;把AlCl3溶液蒸干,灼烧,最后得到的主要固体产物是 。
(2)工业上用铝土矿(主要成分为Al2O3,含有Fe2O3、SiO2等杂质)制取无水氯化铝的一种工艺流程示意如下:
已知:
物质
SiCl4
AlCl3
FeCl3
FeCl2
沸点/℃
57.6
180(升华)
300(升华)
1 023
①步骤Ⅰ中焙烧使固体中水分挥发、气孔数目增多,其作用是 (只要求写出一种)。
②步骤Ⅱ中若不通入氯气和氧气,则反应生成相对原子质量比硅大的单质是 。
③已知:
Al2O3(s)+3C(s)2Al(s)+3CO(g)
ΔH1=+1 344.1 kJ· mol-1
2AlCl3(g)2Al(s)+3Cl2(g)
ΔH2=+1 169.2 kJ· mol-1
由Al2O3、C和Cl2反应生成AlCl3的热化学方程式为 。
④步骤Ⅲ经冷却至室温后,气体用足量的NaOH冷溶液吸收,生成的盐主要有3种,其化学式分别为 、 、 。
⑤结合流程及相关数据分析,步骤Ⅴ中加入铝粉的目的是 。
答案(1)酸 Al3++3H2OAl(OH)3+3H+ Al2O3
(2)①防止后续步骤生成的AlCl3水解或增大与Cl2、O2的接触面积,增大反应速率 ②Fe或铁 ③Al2O3(s)+3C(s)+3Cl2(g)2AlCl3(g)+3CO(g) ΔH=+174.9 kJ· mol-1 ④NaCl NaClO Na2CO3 ⑤除去FeCl3,提高AlCl3纯度
解析(1)AlCl3为强酸弱碱盐,Al3+水解使溶液呈酸性,水解离子方程式为Al3++3H2OAl(OH)3+3H+。将AlCl3溶液蒸干,由于HCl具有挥发性,从溶液中逸出,促进Al3+的水解,最终Al3+完全水解生成Al(OH)3,经过蒸干、灼烧,Al(OH)3分解生成Al2O3。
(2)①步骤Ⅰ中焙烧使固体水分挥发、物质中没有水,可以防止后续步骤生成的AlCl3水解;同时使固体中气孔数目增多,使得固体物质表面积增大,增大后续化学反应速率。
②步骤Ⅱ如果不通入氯气和氧气,铝土矿粉中的Al2O3、Fe2O3、SiO2会与C发生置换反应,得到Al、Fe、Si,相对原子质量比硅大的单质是Fe。
③将两个反应编号为反应①、反应②,应用盖斯定律,将反应①-反应②,可以得到目标热化学方程式Al2O3(s)+3C(s)+3Cl2(g)2AlCl3(g)+3CO(g) ΔH=+1 344.1 kJ· mol-1-(+1 169.2 kJ· mol-1)=+174.9 kJ· mol-1。则热化学方程式为Al2O3(s)+3C(s)+3Cl2(g)2AlCl3(g)+3CO(g) ΔH=+174.9 kJ· mol-1。
④尾气中含Cl2、O2、CO2、SiCl4等,冷却至室温后的气体中含Cl2、O2、CO2,气体用足量NaOH冷溶液吸收,氯气与足量的NaOH冷溶液的反应为:Cl2+2NaOHNaCl+NaClO+H2O,CO2与足量的NaOH冷溶液的反应为:CO2+2NaOHNa2CO3+H2O,所以3种钠盐分别为NaCl、NaClO、Na2CO3。
⑤步骤Ⅱ中生成了FeCl3,根据表中的数据,在氯化铝的粗品中含有FeCl3杂质,加入Al可以与FeCl3反应置换出铁,生成AlCl3,提高AlCl3的纯度。
4.(2019·山东泰安二模)六水合高氯酸铜[Cu(ClO4)2·6H2O]是一种易溶于水的蓝色晶体,常用作助燃剂。以食盐等为原料制备高氯酸铜晶体的一种工艺流程如下:
回答下列问题:
(1)Cu2(OH)2CO3在物质类别上属于 (填序号)。
A.碱
B.盐
C.碱性氧化物
(2)发生“电解Ⅰ”时所用的是 (填“阳离子”或“阴离子”)交换膜。
(3)歧化反应是同一种物质中同种元素自身的氧化还原反应,已知上述工艺流程中“歧化反应”的产物之一为NaClO3。该反应的化学方程式为 。
(4)“电解Ⅱ”的阳极产物为 (填离子符号)。
(5)操作a的名称是 ,该流程中可循环利用的物质是 (填化学式)。
(6)“反应Ⅱ”的离子方程式为
。
答案(1)B (2)阳离子
(3)3Na2CO3+3Cl25NaCl+NaClO3+3CO2
(4)ClO4- (5)蒸发浓缩 NaCl
(6)Cu2(OH)2CO3+4H+2Cu2++CO2↑+3H2O
解析根据流程图,电解氯化钠溶液生成氢氧化钠、氢气和氯气,生成的氯气与碳酸钠发生歧化反应生成氯化钠和NaClO3,同时生成二氧化碳,生成的NaClO3通过电解Ⅱ生成高氯酸钠和氢气,用盐酸酸化,过滤除去氯化钠晶体,蒸发浓缩得到60%以上的高氯酸溶液。在高氯酸溶液中加入碱式碳酸铜,反应生成高氯酸铜溶液,蒸发浓缩、冷却结晶得到高氯酸铜晶体。
(1)Cu2(OH)2CO3中含有金属阳离子和酸根阴离子,属于盐。
(2)“电解Ⅰ”所发生的反应是电解氯化钠溶液生成氢氧化钠、氢气和氯气,需要防止氢氧根离子与氯气反应,所以用的交换膜是阳离子交换膜。
(3)“歧化反应”是氯气与碳酸钠反应生成氯化钠和NaClO3,氯元素从0价变为-1价和+5价,同时生成二氧化碳,反应的化学方程式为3Na2CO3+3Cl25NaCl+NaClO3+3CO2。
(4)通过电解Ⅱ,溶液中氯酸根离子在阳极失电子发生氧化反应生成高氯酸根离子,“电解Ⅱ”的阳极产物为ClO4-。
(5)加入盐酸,过滤除去氯化钠晶体,滤液通过蒸发浓缩即可得到60%以上的高氯酸;从流程图可以看出,可循环利用的物质是NaCl。
(6)“反应Ⅱ”中高氯酸与碱式碳酸铜反应生成高氯酸铜,二氧化碳和水,碱式碳酸铜不溶于水,高氯酸为强酸,反应的离子方程式为Cu2(OH)2CO3+4H+2Cu2++CO2↑+3H2O。
5.(2019·湘赣十四校第一次联考)银铜合金广泛应用于航空工业,从银铜合金的切割废料中回收银并制备铜产品的工艺如下:
已知:Al(OH)3和Cu(OH)2开始分解的温度分别为450 ℃和80 ℃。
(1)电解精炼银时,粗银作 极,另一电极上的电极反应式为 。
(2)加快渣料(含少量银)溶于稀硫酸的措施有 、 (写出两种)。
(3)滤渣A与稀硝酸反应,产生的气体在空气中迅速变为红棕色,滤渣A与稀硝酸反应的离子方程式为 。
(4)煮沸CuSO4混合溶液的过程中,得到固体B,则固体B的组成为 ;在生成固体B的过程中,需控制NaOH的加入量,若NaOH过量,则因过量引起的反应的离子方程式为 。
(5)硫酸铜溶液可用于浸取硫铁矿中的铁元素,浸取时发生复杂的氧化还原反应。反应体系中除CuSO4和FeS2外,还有H2SO4、Cu2S、FeSO4和H2O,下列对该反应的分析正确的是 (填字母代号)。
A.氧化剂为CuSO4和FeS2
B.反应后溶液的pH降低
C.被氧化的FeS2占总量的30%
D.每转移2 mol电子消耗3 mol CuSO4
答案(1)阳 Ag++e-Ag
(2)适当增大硫酸浓度 升高温度、粉碎渣料或搅拌等
(3)3Ag+4H++NO3-3Ag++NO↑+2H2O
(4)Al(OH)3和CuO Al(OH)3+OH-AlO2-+2H2O
(5)ABC
解析由工艺流程图可知,废料在空气中熔炼时,Cu被氧化,滤渣中含有CuO及少量Ag,向滤渣中加入硫酸进行酸浸,CuO与硫酸反应,过滤得到硫酸铜溶液(含有硫酸),滤渣A为Ag;向滤液中加入硫酸铝、氢氧化钠,煮沸后过滤得到的固体B为氢氧化铝、氧化铜,煅烧中二者反应得到CuAlO2。
(1)电镀法精炼银时,粗银作阳极,纯银作阴极,阳极上银失电子变成银离子进入溶液:Ag-e-Ag+,阴极上银离子得到电子形成单质银:Ag++e-Ag。
(2)增大渣料(含少量银)溶于稀硫酸的速率,可采用适当增大硫酸浓度、升高反应温度、粉碎渣料增大固体表面积或搅拌等措施。
(3)滤渣A的主要成分是Ag,稀硝酸是氧化性酸,能与银反应生成硝酸银、一氧化氮气体和水,反应的化学方程式为3Ag+4HNO3(稀)3AgNO3+NO↑+2H2O,据此可进一步写出离子方程式。
(4)CuSO4溶液中加入硫酸铝溶液和氢氧化钠溶液得到Cu(OH)2沉淀和Al(OH)3沉淀,由Al(OH)3和Cu(OH)2的分解温度可知,煮沸后Cu(OH)2分解产生氧化铜,则固体B的组成为Al(OH)3和CuO;氢氧化铝是两性氢氧化物,如果NaOH过量,Al(OH)3会与氢氧化钠溶液反应生成偏铝酸钠和水,反应的化学方程式为:Al(OH)3+NaOHNaAlO2+2H2O。
(5)由反应体系中元素化合价的变化可知,反应物为CuSO4、FeS2和H2O,生成物为Cu2S、FeSO4和H2SO4,反应的化学方程式为14CuSO4+5FeS2+12H2O7Cu2S+5FeSO4+12H2SO4。反应中,Cu元素的化合价由+2降低为+1,一部分S元素的化合价由-1降低到-2,另一部分S元素的化合价由-1升高到+6价,则CuSO4是氧化剂,FeS2既是氧化剂,又是还原剂,A正确;由反应的化学方程式为14CuSO4+5FeS2+12H2O7Cu2S+5FeSO4+12H2SO4可知,反应中有硫酸生成,反应后溶液的pH降低,B正确;由反应的化学方程式可知,10个S原子中,有3个S原子失去电子,7个S原子得到电子,则被氧化的FeS2占总量的30%,C正确;由反应的化学方程式可知,14 mol硫酸铜参加反应,转移21 mol电子,则转移2 mol电子消耗43 mol CuSO4,D错误。
6.(2019·山东济南一模)工业上,从精制黑钨矿(FeWO4、MnWO4)中提取金属钨的一种流程如下图所示,该流程同时获取副产物Fe2O3和MnCl2。
已知:Ⅰ.过程①~④中,钨的化合价均不变;
Ⅱ.常温下钨酸难溶于水;
Ⅲ.25 ℃时,Ksp[Fe(OH)3]=1.0×10-38,Ksp[Mn(OH)2]=4.0×10-14
回答下列问题:
(1)上述流程中的“滤渣1”除MnO2外还有 ,“气体”除水蒸气、HCl外还有 (均填化学式);
(2)过程①中MnWO4参与反应的化学方程式为 ;FeWO4参与的反应中氧化剂与还原剂的物质的量之比为 ;
(3)已知WO3(s)+3H2(g)W(s)+3H2O(g) ΔH=a kJ· mol-1
WO3(s)WO3(g) ΔH=b kJ· mol-1
写出WO3(g)与H2(g)反应生成W(s)的热化学方程式: ;
(4)过程⑦在25 ℃时调pH,至少应调至 (当离子浓度等于1.0×10-5 mol·L-1时,可认为其已沉淀完全);
(5)过程⑧要获得MnCl2固体,在加热时必须同时采取的一项措施是 ;
(6)钠钨青铜是一类特殊的非化学计量比化合物,其通式为NaxWO3,其中0
mol·L-1;反应MgF2(s)+Ca2+CaF2(s)+Mg2+的平衡常数K= 。
(4)步骤Ⅴ沉锰时,在60 ℃按投料比n[(NH4)2CO3]n(Mn2+)=2,溶液的pH对MnCO3产率的影响如图1所示;pH=7,按投料比n[(NH4)2CO3]n(Mn2+)=2,反应温度对MnCO3产率的影响如图2所示。
图1
①图1中,在pH<7.0时,pH越小产率 (填“越高”或“越低”);在pH>7.0时,pH越大产率越低且纯度也降低,其原因是 。
图2
②图2中,温度高于60 ℃时,温度越高产率越低且纯度也越低,主要原因是 。
答案(1)SiO2
(2)2Fe2++H2O2+2H+2Fe3++2H2O 5.2~8.3
(3)0.08 160
(4)①越低 部分MnCO3转化为溶解度更小的Mn(OH)2 ②温度越高MnCO3水解程度越大[或温度升高,(NH4)2CO3和MnCO3受热分解]
解析由流程图可知,向钢铁厂烟灰中加入浓硫酸并加热,烟灰中Fe、Mn、Al2O3、CaO及MgO溶解,酸性氧化物SiO2不溶解,过滤得到浸液和浸渣;向浸液中加入H2O2溶液,亚铁离子被氧化为铁离子;加入氨水调节溶液pH,铁离子和铝离子转化为氢氧化铁和氢氧化铝沉淀;加入氟化钾溶液,将钙离子和镁离子转化为氟化钙和氟化镁沉淀;过滤得到滤渣和含锰离子的滤液;向含锰离子的滤液中加入碳酸铵溶液,锰离子转化为碳酸锰沉淀,过滤、洗涤、干燥得到碳酸锰产品。
(1)步骤(Ⅰ)浸渣的主要成分是不与浓硫酸反应的酸性氧化物二氧化硅。
(2)步骤(Ⅱ)加H2O2溶液时,H2O2将溶液中的亚铁离子氧化为铁离子,反应的离子方程式为2Fe2++H2O2+2H+2Fe3++2H2O;加入氨水的目的是调节溶液pH,使溶液中铁离子和铝离子转化为氢氧化铁和氢氧化铝沉淀而除去,此时锰离子不沉淀,由题给表格数据可知,应调节的pH适宜范围为5.2~8.3。
(3)用KF溶液沉钙、镁时,先生成溶解度小的CaF2沉淀,后生成MgF2沉淀,则c(Mg2+)小于1×10-6 mol·L-1时,溶液中c(F-)>Kspc(Mg2+)=6.4×10-91×10-6 mol·L-1=0.08 mol·L-1;反应MgF2(s)+Ca2+CaF2(s)+Mg2+的平衡常数K=c(Mg2+)c(Ca2+)=Ksp(MgF2)Ksp(CaF2)=6.4×10-94.0×10-11=160。
(4)①由图1可知,在60 ℃按投料比n[(NH4)2CO3]n(Mn2+)=2时,在pH<7.0时,pH越小MnCO3产率越小;由表格所给溶度积可知,pH>7.0时,溶液碱性增强,部分MnCO3会转化为溶解度更小的Mn(OH)2,导致产率和纯度降低。
②由图2可知,60 ℃时,MnCO3产率最大,温度高于60 ℃时,温度升高MnCO3水解程度越大,(NH4)2CO3和MnCO3也会热分解,导致产率和纯度降低。
C组
1.(2019·四川成都七中模拟)NiCO3常用于催化剂、电镀、陶瓷等工业。现用某含镍电镀废渣(含Cu、Zn、Fe、Cr等杂质)制取NiCO3的过程如图所示:
(1)流程中的试剂X(某钠盐)的化学式是 。
(2)“氧化”时需保持滤液在40 ℃左右,用6%的H2O2溶液氧化。控制温度不超过40 ℃的原因是 (用化学方程式表示)。
(3)Fe2+也可以用NaClO3氧化,生成的Fe3+在较小pH条件下水解,最终形成黄钠铁矾[Na2Fe6(SO4)4(OH)12]沉淀而被除去,如图是pH-温度关系图,图中阴影部分为黄钠铁矾稳定存在的区域,下列说法不正确的是 (填字母)。
a.黄钠铁矾[Na2Fe6(SO4)4(OH)12]中铁为+2价
b.pH过低或过高均不利于生成黄钠铁矾,其原因相同
c.氯酸钠在氧化Fe2+时,1 mol NaClO3得到的电子数为6NA
d.工业生产中温度常保持在85~95 ℃,加入Na2SO4后生成黄钠铁矾,此时溶液的pH约为1.2~1.8。
(4)加入Na2CO3溶液时,确认Ni2+已经完全沉淀的实验方法是 。
(5)某小组利用NiCO3制取镍氢电池的正极材料碱式氧化镍(NiOOH),过程如图:
①已知25 ℃时,Ksp[Ni(OH)2]=2×10-15,当调节pH≥9时,溶液中残留的c(Ni2+) mol·L-1。
②写出在空气中加热Ni(OH)2制取NiOOH的化学方程式
。
③镍氢电池电解液为30%的KOH溶液,负极为MH(即吸氢材料M吸附氢原子)。充电时也可实现Ni(OH)2转化为NiOOH。请写出放电时该电池的总反应式 。
答案(1)Na2S (2)2H2O22H2O+O2↑
(3)ab
(4)静置,取少量上层清液继续滴加1~2滴Na2CO3溶液,无沉淀生成
(5)①≤2×10-5 ②4Ni(OH)2+O24NiOOH+2H2O ③NiOOH+MHM+Ni(OH)2
解析根据流程图,该含镍电镀废渣(含Cu、Zn、Fe、Cr等杂质)用过量的酸溶解,其中的金属转化为金属阳离子,再加入适量X试剂,将铜离子和锌离子转化为硫化物沉淀除去,滤液中含有镍、铁、铬等金属离子。根据(2)可知,保持滤液在40 ℃左右,用6%的H2O2溶液氧化Fe2+,再在95 ℃加入NaOH调节pH,除去Fe(OH)3和Cr(OH)3,在过滤后的滤液中加入碳酸钠得到NiCO3。
(1)根据流程图,加入试剂X后生成了硫化铜和硫化锌沉淀,因此试剂X(某钠盐)为Na2S;
(2)由于过氧化氢受热容易分解,因此“氧化”时需保持滤液温度不超过40 ℃;
(3)黄钠铁矾[Na2Fe6(SO4)4(OH)12]中钠为+1价,硫酸根为-2价,氢氧根为-1价,根据各元素正负化合价代数和为0可知铁为+3价,故a错误。pH过低,[Na2Fe6(SO4)4(OH)12]能够被酸溶解;pH过高,铁离子容易水解生成氢氧化铁或FeOOH沉淀,均不利于生成黄钠铁矾,原因不相同,故b错误。用氯酸钠在酸性条件下氧化Fe2+的离子方程式为6Fe2++ClO3-+6H+6Fe3++Cl-+3H2O,1 mol NaClO3得到的电子数为6NA,故c正确;由图像可知,85~95 ℃条件下生成黄钠铁矾的合适pH约为1.2~1.8,故d正确。
(4)确认Ni2+已经完全沉淀的具体操作步骤为:静置,在上层清液中继续滴加1~2滴Na2CO3溶液,无沉淀生成。
(5)①已知Ksp[Ni(OH)2]=2×10-15,当调节pH≥9时,c(H+)≤10-9 mol·L-1,则c(OH-)≥10-1410-9 mol·L-1=10-5 mol·L-1,c(Ni2+)≤Ksp[Ni(OH)2]c2(OH-)=2×10-15(10-5)2 mol·L-1=2×10-5 mol·L-1;
②在空气中加热Ni(OH)2,Ni(OH)2与空气中的氧气反应生成NiOOH和水,反应的化学方程式为:4Ni(OH)2+O24NiOOH+2H2O;
③镍氢电池电解液为30%的KOH溶液,负极为MH(即吸氢材料M吸附氢原子)。充电时也可实现Ni(OH)2转化为NiOOH,则放电时NiOOH在正极发生还原反应生成Ni(OH)2,电池的总反应为MH与NiOOH反应生成Ni(OH)2和M,反应方程式为NiOOH+MHM+Ni(OH)2。
2.(2019·四川成都七中模拟)硫酸铜是一种常见的无机化合物,可形成CuSO4·5H2O、CuSO4·H2O等多种结晶水合物,它可用作杀菌剂,还可用于电镀和电解精炼铜。回答下列问题:
(1)CuSO4·5H2O的俗名是 。
(2)工业利用“冶炼硫酸铜”(主要成分CuSO4含少量Fe2+、AsO2-、Ca2+等杂质)提纯制备“电镀硫酸铜”(CuSO4·H2O)的生产流程如下:
溶解所用的酸最适宜的是 ;氧化产物中有H3AsO4和 ;调节pH时生成固体的主要成分除FeAsO4、Fe(OH)3外还有 ,反应生成FeAsO4的离子方程式是 ,操作a需经过蒸发浓缩、 、过滤、洗涤、干燥等步骤,其中洗涤的过程中常用无水乙醇,其作用是 。
(3)用CuSO4溶液电解精炼铜的装置如上图所示,粗铜中含锌、银、铂杂质,阳极电极反应式为 ;目前,科研机构正大力开展用Cu+
的络合物作电解质溶液制备纯铜的研究,电解Cu+的络合物与电解CuSO4溶液相比较,优点是 。
答案(1)胆矾或蓝矾
(2)硫酸 Fe2(SO4)3 CaCO3 2H3AsO4+2Fe3++3CO32-2FeAsO4↓+3H2O+3CO2↑ 冷却结晶 迅速除去晶体表面的水,防止与表面的水形成CuSO4·5H2O
(3)Zn-2e-Zn2+,Cu-2e-Cu2+ 理论上制备相同质量的铜可以节省一半的电能
解析(1)CuSO4·5H2O的俗名为胆矾或蓝矾。
(2)因为最后制取的电镀硫酸铜为CuSO4·H2O,所以加入的酸最好为硫酸;亚铁离子能被过氧化氢氧化,所以产物中含有硫酸铁。调节pH时加入的试剂为碳酸钠,所以溶液中的钙离子与碳酸钠反应生成碳酸钙沉淀。调节pH时生成固体的主要成分含FeAsO4,说明铁离子和H3AsO4在碳酸根离子存在时反应生成FeAsO4,同时产生二氧化碳,离子方程式为:2H3AsO4+2Fe3++3CO32-2FeAsO4↓+3H2O+3CO2↑。因为要制备的是电镀硫酸铜,电镀硫酸铜含有一定量的结晶水,故操作a是蒸发浓缩、冷却结晶,过滤、洗涤、干燥。洗涤过程使用无水乙醇,利用乙醇和水任意比互溶,其作用是迅速除去晶体表面的水,防止CuSO4·H2O与表面的水形成CuSO4·5H2O。
(3)电解精炼铜时粗铜在阳极反应,粗铜中含锌、银、铂杂质,最活泼的为锌,其次为铜,故电极反应为:Zn-2e-Zn2+,Cu-2e-Cu2+;电解Cu+的络合物与电解CuSO4溶液相比较,Cu+得到电子生成铜,与Cu2+得到电子生成铜相比较,理论上制备相同质量的铜可以节省一半的电能。
3.(2019·河北衡水中学二模)镍钴锰酸锂电池是一种高功率动力电池。采用废旧锂离子电池回收工艺制备镍钴锰酸锂三元正极材料(铝电极表面涂有LiNi(1-x-y)CoxMnyO2)的工艺流程如图所示:
回答下列问题:
(1)废旧锂离子电池拆解前进行“放电处理”有利于锂在正极的回收,其原因是 。
(2)能够提高“碱浸”效率的方法有 (至少写两种)。
(3)“碱浸”过程中,铝溶解的离子方程式为 。
(4)实验室模拟“碱浸”后过滤的操作,需用到的玻璃仪器有 ;过滤后需洗涤,简述洗涤的操作过程: 。
(5)LiCoO2参与“还原”反应的离子方程式为 。
(6)溶液温度和浸渍时间对钴的浸出率影响如图所示:
则浸出过程的最佳条件是 。
(7)已知溶液中Co2+的浓度为1.0 mol·L-1,缓慢通入氨气,使其产生Co(OH)2沉淀,则Co2+沉淀完全时溶液的最小pH为 (已知:离子沉淀完全时c(Co2+)≤1.0×10-5 mol·L-1,Ksp[Co(OH)2]=4.0×10-15,lg2=0.3,溶液体积变化忽略不计)。
(8)写出“高温烧结固相合成”过程的化学方程式: 。
答案(1)放电有利于Li+向正极移动并进入正极材料
(2)粉碎原料、适当增大NaOH溶液的浓度、适当升高温度等
(3)2Al+2H2O+2OH-2AlO2-+3H2↑
(4)漏斗、烧杯、玻璃棒 沿玻璃棒向过滤器中加水至浸没沉淀,待水滤出后重复操作2~3次
(5)2LiCoO2+6H++H2O22Li++2Co2++4H2O+O2↑
(6)75 ℃,30 min (7)9.3
(8)(4-4x-4y)Ni(OH)2+4xCo(OH)2+4yMn(OH)2+2Li2CO3+O24LiNi(1-x-y)CoxMnyO2+2CO2↑+4H2O
解析(1)放电时,负极上生成锂离子,锂离子向正极移动并进入正极材料中,所以“放电处理”有利于锂在正极的回收;
(2)提高浸出率的方法有粉碎原料、适当增大NaOH溶液的浓度、适当升高温度等;
(3)“碱浸”过程中,铝与氢氧化钠溶液反应生成偏铝酸钠和氢气,离子方程式为2Al+2H2O+2OH-2AlO2-+3H2↑;
(4)过滤需要用到的玻璃仪器有漏斗、烧杯、玻璃棒;洗涤沉淀在过滤器中进行,其操作为:沿玻璃棒向过滤器中加水至浸没沉淀,待水滤出后重复操作2~3次;
(5)LiCoO2中Li元素为+1价,O元素为-2价,故Co元素化合价为+3价,LiCoO2为难溶物,H2SO4为电解质,H2O2还原LiCoO2中+3价Co元素,反应的离子方程式为2LiCoO2+6H++H2O22Li++2Co2++4H2O+O2↑;
(6)由图像可知,在75 ℃,30 min条件下钴的浸出率最高;
(7)Ksp[Co(OH)2]=4.0×10-15,沉淀完全时c(OH-)=Ksp[Co(OH)2]c(Co2+)=4.0×10-151.0×10-5 mol·L-1=2×10-5 mol·L-1,c(H+)=KWc(OH-)=10-142×10-5 mol·L-1=5×10-10 mol·L-1,pH=-lgc(H+)=-lg(5×10-10)=9.3;
(8)Ni2+、Co2+、Mn2+与NH3·H2O反应生成Ni(OH)2、Co(OH)2、Mn(OH)2,在高温烧结固相合成阶段与Li2CO3反应生成目标产物,根据原子守恒可得到化学方程式为(4-4x-4y)Ni(OH)2+4xCo(OH)2+4yMn(OH)2+2Li2CO3+O24LiNi(1-x-y)CoxMnyO2+2CO2↑+4H2O。
4.(2019·河南顶级名校第四次联考)一种利用化肥生产中的废催化剂(含CoO、Co、Al2O3及少量FeO)制取明矾和CoSO4粗产品的工艺流程如下:
已知:(ⅰ)相关金属离子形成氢氧化物沉淀的pH范围如下表所示:
Al3+
Fe3+
Fe2+
Co2+
开始沉淀的pH
3.5
1.6
6.3
6.6
完全沉淀的pH
5.4
2.8
8.3
9.2
(ⅱ)Al(OH)3在碱性条件下开始溶解时的pH为7.8,完全溶解时的pH为11。
回答下列问题:
(1)写出H2O2的电子式: 。
(2)下列措施一定能提高步骤Ⅰ中Al3+和Co2+的浸取率的是 (填标号)。
a.将废催化剂研磨为细颗粒
b.步骤Ⅰ中的硫酸采用98%的浓硫酸
c.适当提高浸取时的温度
(3)步骤Ⅱ中,写出“氧化”过程中Fe2+被氧化的离子方程式: ,若“氧化”后再“调节pH=3”,造成的后果是 。
(4)步骤Ⅲ中加K2CO3应控制的pH范围为 。
(5)测定CoSO4粗产品中钴的质量分数的步骤如下:准确称取a g产品,先经预处理,然后加入过量的冰乙酸,在加热煮沸条件下,缓慢滴加KNO2溶液直至过量,生成不溶于乙酸的K3[Co(NO2)6],再经过滤、洗涤及干燥,称量沉淀的质量为b g。
①KNO2溶液氧化并沉淀Co2+的离子方程式为 (已知KNO2被还原为NO)。
②粗产品中钴元素的质量分数为 (Mr{K3[Co(NO2)6]}=452,列出计算式)。
答案(1)H··O······O······H
(2)ac (3)2Fe2++H2O2+4H2O2Fe(OH)3↓+4H+ Fe3+对双氧水的分解有催化作用,造成H2O2利用率降低
(4)pH≥11
(5)①Co2++3K++7NO2-+2CH3COOH
K3[Co(NO2)6]↓+NO↑+H2O+2CH3COO- ②59b452a×100%
解析废催化剂(含CoO、Co、Al2O3及少量FeO)加入硫酸酸浸后得到的浸取液中主要含有Co2+、Al3+、Fe2+、H+和SO42-等离子,调节溶液pH=3,再加入H2O2,Fe2+被氧化为Fe3+并产生Fe(OH)3沉淀。
过滤后,滤液中加入K2CO3调节pH,生成Co(OH)2沉淀和KAlO2溶液,经过滤分离,Co(OH)2沉淀加硫酸溶解经后续处理得到粗产品CoSO4,滤液加硫酸酸化得到硫酸铝钾溶液,经结晶得到明矾。
(1)H2O2为共价化合物,两个氧原子共用一对电子,电子式为:H··O······O······H。
(2)将废催化剂研磨为细颗粒,可增大固体反应物的接触面积,能提高浸取率,故a正确;该反应为H+参加的离子反应,98%的浓硫酸中的氢离子浓度极小,不利于酸浸,故b错误;升高温度可以增大化学反应速率,适当提高浸取时的温度,能提高浸取率,故c正确。
(3)Fe2+被氧化为Fe3+,pH=3时产生Fe(OH)3沉淀,离子方程式为:2Fe2++H2O2+4H2O2Fe(OH)3↓+4H+;Fe3+对双氧水的分解有催化作用,若“氧化”后再“调节pH=3”,会造成H2O2利用率降低。
(4)由已知(ⅰ)可知,Co2+沉淀完全的pH为9.2,由已知(ⅱ)可知,Al(OH)3完全溶解时的pH为11,所以要分离出Al3+,应控制的pH范围为pH≥11。
(5)①KNO2将Co2+氧化为Co3+,并生成K3[Co(NO2)6]沉淀,NO2-被还原为NO,根据得失电子守恒、电荷守恒及原子守恒,离子方程式为Co2++3K++7NO2-+2CH3COOHK3[Co(NO2)6]↓+NO↑+H2O+2CH3COO-。
②b g K3[Co(NO2)6]中含Co元素的质量为b g×59452,则粗产品中钴元素的质量分数为59b452a×100%。
5.(2019·吉林实验中学模拟)碱性锌锰电池的工作原理为Zn+2MnO2+2H2O2MnO(OH)+Zn(OH)2,其中的电解质溶液是KOH溶液。某课题组用废旧铁壳无汞碱性锌锰电池为原料,制备一种新型材料——MnxZn(1-x)Fe2O4,其工艺流程如图所示:
(1)已知MnxZn(1-x)Fe2O4中锰元素的化合价与实验室用二氧化锰制取氯气时还原产物中的锰相同,则铁元素的化合价为 。
(2)“溶渣”工序中稀硫酸与铁反应生成的硫酸亚铁可将+3价锰的化合物全部还原成Mn2+,写出该反应的离子方程式: 。
(3)“调铁”工序的目的是调整滤液中铁离子的总浓度,使其中金属元素的物质的量之比与产品的化学式MnxZn(1-x)Fe2O4相符合。
①写出“调铁”工序中发生反应的离子方程式: 、 。
②若测得滤液的成分为c(Mn2+)+c(Zn2+)=a mol·L-1,c(Fe2+)+c(Fe3+)=b mol·L-1,滤液体积为1 m3,“调铁”工序中,需加入的铁粉质量为 kg(忽略溶液体积变化,用含a、b的代数式表示)。
(4)在“氧化”工序中,加入双氧水的目的是把Fe2+氧化为Fe3+;生产过程中发现实际消耗双氧水的量大于理论值,其可能原因除温度外,主要是 。
(5)用氨水“调pH”后,经“结晶”“过滤”可得到产品和滤液C,从滤液C中还可分离出一种氮肥,该氮肥的溶液中离子浓度由大到小的顺序为 。
答案(1)+3
(2)MnO(OH)+Fe2++3H+Mn2++Fe3++2H2O
(3)①Fe+2Fe3+3Fe2+ Fe+2H+Fe2++H2↑ ②(112a-56b)
(4)生成的Fe3+催化了双氧水的分解
(5)c(NH4+)>c(SO42-)>c(H+)>c(OH-)
解析由流程图可知,向用水洗涤的废旧电池滤渣中加入稀硫酸,滤渣中的Fe和Zn(OH)2溶于稀硫酸,反应生成的硫酸亚铁在酸性条件下,与MnO(OH)发生氧化还原反应生成硫酸铁、硫酸锰,过滤得到含有硫酸锌、硫酸铁和硫酸锰的酸性滤液;向滤液中加入铁粉调整滤液中铁离子的总浓度,使其中金属元素的物质的量之比与产品的化学式MnxZn(1-x)Fe2O4相符合,再加入双氧水将Fe2+氧化为Fe3+,用氨水调pH后,经结晶、过滤得到产品MnxZn(1-x)Fe2O4。
(1)由题意可知,MnxZn(1-x)Fe2O4中锰元素的化合价为+2价,设铁元素化合价为+a,由化合价代数和为零可得:(+2)×x+(+2)×(1-x)+(+a)×2+(-2)×4=0,解得a=3。
(2)由题意可知,硫酸亚铁与MnO(OH)在酸性条件下发生氧化还原反应,硫酸亚铁被氧化生成硫酸铁,MnO(OH)被还原为硫酸锰,反应的离子方程式为MnO(OH)+Fe2++3H+Mn2++Fe3++2H2O。
(3)①“调铁”工序中,加入的铁粉与溶液中的Fe3+和H+反应,反应时,氧化性较强的Fe3+与Fe反应生成Fe2+,Fe3+完全反应后,H+与Fe反应生成Fe2+和H2,反应的离子方程式为Fe+2Fe3+3Fe2+和Fe+2H+Fe2++H2↑。
②由化学式MnxZn(1-x)Fe2O4可知,n(Mn2++Zn2+)∶n(Fe3+)=1∶2,设加入铁粉物质的量为y,依据题意可得(a mol·L-1×103 L)∶(b mol·L-1×103 L+y)=1∶2,解得y=(2a-b)×103 mol,则加入的铁粉质量为(2a-b)×103 mol×56 g·mol-1=56(2a-b)×103 g=56(2a-b) kg。
(4)在“氧化”工序中,双氧水把Fe2+氧化为Fe3+,反应生成的Fe3+可以催化双氧水的分解,导致实际消耗双氧水的量大于理论值。
(5)由流程图可知,反应中加入了稀硫酸和氨水,滤液C中一定含有硫酸铵。由于铵根离子水解使溶液显酸性,故c(H+)>c(OH-);但是由于水解程度小,溶液中c(NH4+)>c(SO42-);则溶液中离子浓度由大到小的顺序为c(NH4+)>c(SO42-)>c(H+)>c(OH-)。
6.(2019·湖南娄底二模)硒(Se)和铜(Cu)在生产生活中有广泛的应用。硒可以用作光敏材料及电解锰行业的催化剂,还是动、植物必需的营养元素;氯化亚铜(CuCl)广泛应用于化工、印染、电镀等行业。CuCl难溶于醇和水,可溶于氯离子浓度较大的体系,在潮湿空气中易水解、氧化。以海绵铜(主要成分是Cu和少量CuO)为原料,采用硝酸铵氧化分解技术生产CuCl的工艺流程如下:
请回答下列问题:
(1)若步骤①中得到的氧化产物只有一种,则它的化学式是 。
(2)写出步骤③中主要反应的离子方程式: 。
(3)步骤⑤包括用pH=2的溶液酸洗、水洗两步操作,酸洗采用的酸是 (写酸的名称)。
(4)上述工艺中,步骤⑥和⑦的作用是 。
(5)Se为ⅥA族元素,用乙二胺四乙酸铜阴离子水溶液和硒代硫酸钠(Na2SeSO3)溶液反应可获得纳米硒化铜,硒代硫酸钠还可用于Se的精制。写出硒代硫酸钠(Na2SeSO3)与H2SO4溶液反应得到精硒的化学方程式: 。
(6)氯化亚铜产率与温度、溶液pH关系如下图所示。据图分析,流程化生产氯化亚铜的过程中,温度过低影响CuCl产率的原因是 ;温度过高、pH过大也会影响CuCl产率的原因是 。
(7)用NaHS作污水处理的沉淀剂,可以处理工业废水中的Cu2+。已知:25 ℃时,H2S的电离平衡常数Ka1=1.0×10-7,Ka2=7.0×10-15,CuS的溶度积为Ksp(CuS)=6.3×10-36。反应Cu2+(aq)+HS-(aq)CuS(s)+H+(aq)的平衡常数K= (结果保留1位小数)。
答案(1)CuSO4
(2)2Cu2++SO32-+2Cl-+H2O2CuCl↓+SO42-+2H+
(3)硫酸
(4)使CuCl干燥并防止其水解、氧化
(5)Na2SeSO3+H2SO4Na2SO4+Se↓+SO2↑+H2O
(6)温度过低反应速率小 温度过高、pH过大,容易向CuO和Cu2O转化或温度过高,铵盐(氯化铵、亚硫酸铵)易受热分解(任答一点即可)
(7)1.1×1021
解析酸性条件下硝酸根离子具有氧化性,可氧化海绵铜(主要成分是Cu和少量CuO)生成硫酸铜;过滤后在滤液中加入亚硫酸铵发生氧化还原反应生成CuCl,反应的离子方程式为2Cu2++SO32-+2Cl-+H2O2CuCl↓+SO42-+2H+;得到的CuCl经硫酸酸洗,水洗后再用乙醇洗涤,烘干得到氯化亚铜。
(1)酸性条件下硝酸根离子具有氧化性,可氧化Cu生成CuSO4。
(2)铜离子与亚硫酸铵发生氧化还原反应生成CuCl,步骤③中主要反应的离子方程式为2Cu2++SO32-+2Cl-+H2O2CuCl↓+SO42-+2H+。
(3)CuCl难溶于醇和水,可溶于氯离子浓度较大的体系,为防止CuCl溶解、氧化引入新杂质,所以应加入硫酸,不能加入硝酸等氧化性酸,也不能加入盐酸。
(4)步骤⑥为醇洗,步骤⑦为烘干,因CuCl难溶于醇且乙醇沸点低,易挥发,用乙醇洗涤,可快速除去固体表面的水分,防止CuCl水解、氧化。
(5)硒代硫酸钠(Na2SeSO3)与H2SO4溶液反应得到精硒,同时生成硫酸钠、二氧化硫和水,反应的化学方程式为:Na2SeSO3+H2SO4Na2SO4+Se↓+SO2↑+H2O;该反应方程式的书写可由Na2S2O3+H2SO4Na2SO4+S↓+SO2↑+H2O迁移获得。
(6)据图分析,流程化生产氯化亚铜的过程中,温度过低影响CuCl产率的原因是反应速率慢;温度过高、pH过大也会影响CuCl产率的原因是温度过高、pH过大,容易向CuO和Cu2O转化,且温度过高,铵盐(氯化铵、亚硫酸铵)易受热分解。
(7)反应Cu2+(aq)+HS-(aq)CuS(s)+H+(aq)的平衡常数K=c(H+)c(Cu2+)c(HS-)=c(H+)c(S2-)c(Cu2+)c(S2-)c(HS-)=Ka2(H2S)Ksp(CuS)=7.0×10-156.3×10-36=1.1×1021。