- 2021-04-25 发布 |
- 37.5 KB |
- 6页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
甘肃省永昌四中2020届高三上学期期末考试化学试卷
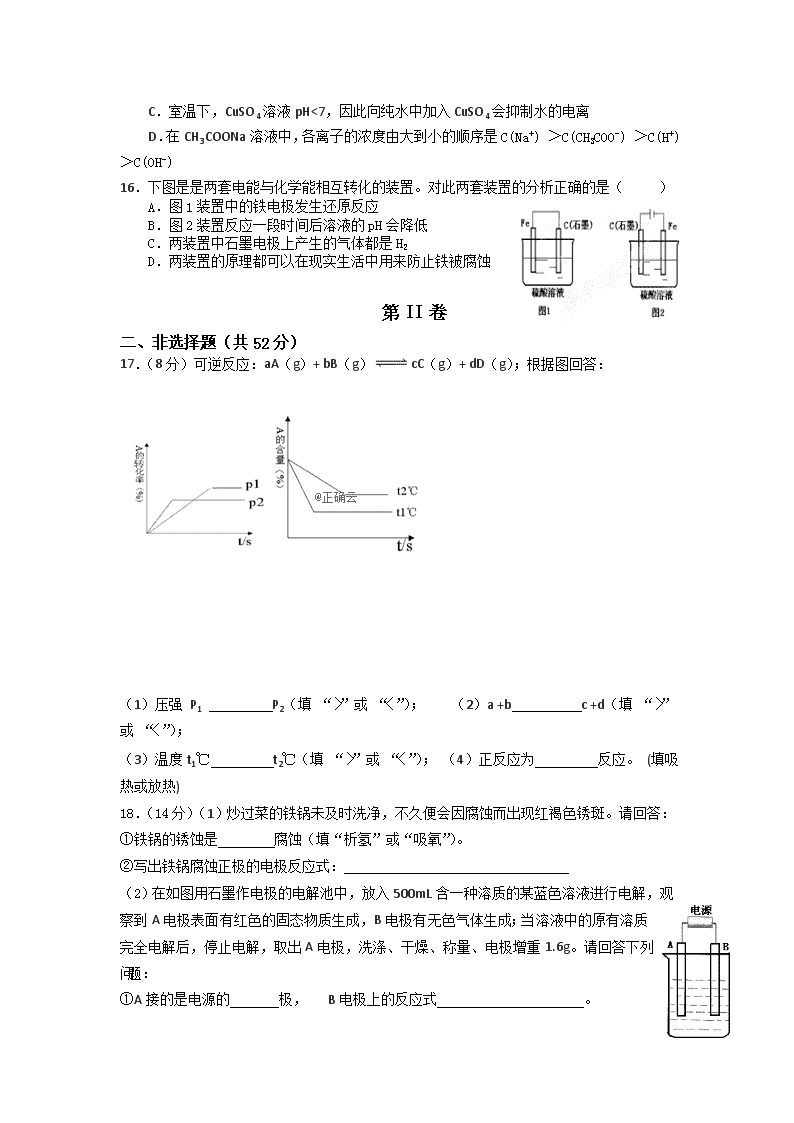
高三年级 化学 第 I 卷 可能用到的原子量:Cu 64 C 12 O 16 一、选择题(本题共 16 小题,每小题 3 分,共 48 分。) 1.“春蚕到死丝方尽,蜡炬成灰泪始干”是唐代诗人李商隐的著名诗句,下列关于该诗句中 所涉及物质的说 法错误的是 A.蚕丝的主要成分是蛋白质 B.蚕丝属于天然高分子材料 C.“蜡炬成灰”过程中发生了氧化反应 D.古代的蜡是高级脂肪酸酯,属于高分子聚合物 2.相同温度下等物质的量浓度的下列溶液中,pH 值最小的是 ( ) A. ClNH4 B. 34HCONH C. 44HSONH D. 424 SO)(NH 3.朱自清在《荷塘月色》中写道:“薄薄的青雾浮起在荷塘里……月光是隔了树照过来的, 高处丛生的灌木,落下参差的斑驳的黑影……”月光穿过薄雾形成的种种美景本质原因是 ( ) A.空气中的小水滴颗粒直径大小约为 1~100nm B.空气中的小水滴颗粒的布朗运动 C.雾是一种胶体,胶粒带相同电荷 D.发生丁达尔效应 4.已知某温度下纯水中的 ,对此下列说法正确的是( ) A.若向水中加入少量盐酸,则水的电离度减小 B.该温度低于 25℃ C.此温度下水的离子积为常温下的两倍 D.据此无法求算水中 c(OH-) 5.已知 NA 是阿伏加德罗常数的值,下列说法错误的是 A.3 g 3He 含有的中子数为 1NA B.1 L 0.1 mol·L−1 磷酸钠溶液含有的 PO43-数目为 0.1NA C.1 mol K2Cr2O7 被还原为 Cr3+转移的电子数为 6NA D.48 g 正丁烷和 10 g 异丁烷的混合物中共价键数目为 13NA 6.在下列各溶液中,离子一定能大量共存的是 ( ) A.强碱性溶液中: K+、Al3+、Cl-、SO4 2- B.由水电离产生的 H+浓度为 1×10-13mol·L-1 的溶液中,Na+、K+、Cl-、HCO3 - C.强碱性的溶液中:CO3 2-、Na+、AlO2 -、NO3 - D.酸性溶液中:Fe2+、Al3+、NO3 -、I- 7.类推的思维方法在化学学习与研究中常会产生错误的结论,因此类推的结论最终要经过 实 践 的 检 验 才 能 确 定 其 正 确 与 否 。 下 列 几 种 类 推 结 论 中 , 正 确 的 是 ( ) A.由 2Cu + O2 == 2CuO 可推出同族的硫也有 Cu + S == CuS B.Fe3O4 可表示为 FeO·Fe2O3,则 Pb3O4 可表示为 PbO·Pb2O3 C.Na 能与水反应生成 H2,K、Ca 也能与水反应生成 H2 D.CO2 与 Na2O2 反应只生成 Na2CO3 和 O2,故 SO2 与 Na2O2 反应只生成 Na2SO3 和 O2 8.当氢氧化镁固体在水中达到溶解平衡 Mg(OH)2(s) Mg2+(aq)+2OH-(aq)时,为使 Mg(OH)2 固体的量减少,须加入少量的( ) A.MgCl2 B.NaOH C.MgSO4 D. H2SO4 9.下列水解化学方程式或水解离子方程式正确的是 ( ) A.NH4+ + H2O = NH3·H2O + H+ B.CH3COO— + H2O CH3COOH + OH— C.CH3COOH + NaOH CH3COONa + H2O D.NaCl + H2O NaOH + HCl 10. X、Y、Z、W、M 均为短周期元素,X、Y 同主族,X 的氢化物和最高价氧化物的水化 物能反应生成一种离子化合物,其水溶液显酸性;Z、W、M 是第 3 周期连续的三种元 素,其中只有一种是非金属,且原子半径 Z>W>M。下列叙述准确的是 ( ) A. X、M 两元素氢化物的稳定性:X<M B. Z、W、M 的单质均能与稀硫酸反应制取氢气,但反应剧烈程度依次减弱 C. Z 是海水中含量最高的金属元素,W 是地壳中含量最多的金属元素 D. W 和 M 的氧化物均可做耐高温材料 11.在一密闭容器中,反应 aA(g) bB(g)达平衡后,保持温度不变,将容器体积增 加一倍, 当达到新的平衡时,A 的浓度变为原来的 40%,则 ( ) A. 物质 B 的质量分数减小了 B. 平衡向逆反应方向移动了 C. 平衡向正反应方向移动了 D. a>b 12.将 TiO2 转化为 TiCl4 是工业冶炼金属钛的主要反应之一。已知: TiO2(s) + 2Cl2(g) = TiCl4(l) + O2(g) △H = +140.5 kJ/mol C(s,石墨) + 1/2O2(g) = CO(g) △H = -110.5 kJ/mol 则反应 TiO2(s) + 2Cl2(g) + 2C(s,石墨) = TiCl4(l) + 2CO(g) 的△H 是( ) A.+80.5 kJ/mol B.+30.0 kJ/mol C.-30.0 kJ/mol D.-80.5 kJ/mol 13.将 pH 试纸用蒸馏水润湿后,去测定某溶液的 pH,该溶液的 pH 将会( ) A.偏高 B.偏低 C.不变 D.上述三种情况均有可能 14.下列化学方程式中,不能正确表达反应颜色变化的是 A.向 CuSO4 溶液中加入足量 Zn 粉,溶液蓝色消失:Zn+CuSO4=Cu+ZnSO4 B.澄清的石灰水久置后出现白色固体:Ca(OH)2+CO2=CaCO3↓+H2O C.Na2O2 在空气中放置后由淡黄色变为白色:2Na2O2 =2Na2O+O2↑° D . 向 Mg(OH)2 悬 浊 液 中 滴 加 足 量 FeCl3 溶 液 出 现 红 褐 色 沉 淀 : 3Mg(OH)2+2FeCl3=2Fe(OH)3+3MgCl 15.下列判断中,正确的是( ) A.升高温度,Al2(SO4)3 溶液的 pH 增大 B.在 Na2CO3 溶液中:c(OH-)- c(H+)= c(HCO3-) + 2c(H2CO3) C.室温下,CuSO4 溶液 pH<7,因此向纯水中加入 CuSO4 会抑制水的电离 D.在 CH3COONa 溶液中,各离子的浓度由大到小的顺序是 C(Na+) >C(CH3COO-) >C(H+) >C(OH-) 16.下图是是两套电能与化学能相互转化的装置。对此两套装置的分析正确的是( ) A.图 1 装置中的铁电极发生还原反应 B.图 2 装置反应一段时间后溶液的 pH 会降低 C.两装置中石墨电极上产生的气体都是 H2 D.两装置的原理都可以在现实生活中用来防止铁被腐蚀 第 II 卷 二、非选择题(共 52 分) 17.(8 分)可逆反应:aA(g)+ bB(g) cC(g)+ dD(g);根据图回答: (1)压强 P1 P2(填 “〉”或 “〈”); (2)a +b c +d(填 “〉” 或 “〈”); (3)温度 t1℃ t2℃(填 “〉”或 “〈”); (4)正反应为 反应。 (填吸 热或放热) 18.(14 分)(1)炒过菜的铁锅未及时洗净,不久便会因腐蚀而出现红褐色锈斑。请回答: ①铁锅的锈蚀是 腐蚀(填“析氢”或“吸氧”)。 ②写出铁锅腐蚀正极的电极反应式: (2)在如图用石墨作电极的电解池中,放入 500mL 含一种溶质的某蓝色溶液进行电解,观 察到 A 电极表面有红色的固态物质生成,B 电极有无色气体生成;当溶液中的原有溶质 完全电解后,停止电解,取出 A 电极,洗涤、干燥、称量、电极增重 1.6g。请回答下列 问题: ①A 接的是电源的 极, B 电极上的反应式 。 ②写出电解时反应的总离子方程式 ③电解后溶液的 pH 为 (假设电解前后溶液的体积不变); 要使电解后溶液恢复到电解前的状态,则需加入 。 19. (14 分)饮用水中 NO3- 达到一定浓度时会对人类健康产生危害,为了降低饮用水中 NO3 -的浓度,某兴趣小组提出如下方案: 请回答下列问题: (1)该方案中选用熟石灰调节 pH,理由是_____________、____________、______________, 在调节 pH 时,若 pH 过大或过小都会造成___________的利用率降低。 (2)已知过滤后得到的滤渣是 Al 和 Al(OH)3,则在溶液中铝粉和 NO3- 反应的离子方程式 为 ____________________________________ 。 (3)用 H2 催化还原法也可降低饮用水中 NO3- 的浓度,已知反应中的还原产物和氧化产物 均 可 参 与 大 气 循 环 , 则 催 化 还 原 法 的 离 子 方 程 式 为 ____________________________________ 。 (4)饮用水中的 NO3 - 主要来自于 NH4 + 。已知在微生物作用下,NH4 + 经过两步反应 被氧化 成 NO3 - 。两步反应的能量变化示意图如下: 试 写 出 1 mol NH4 + (aq) 全 部 氧 化 成 NO3 - (aq) 的 热 化 学 方 程 式 是 __________________________。 20.(16 分)对于甲、乙、丙、丁、戊五种溶液有如下信息: ①分别 NH4 +、Na+、Al3+、Ba2+、Ag+和 NO3 -、Cl-、SO4 2-、Br-、CO3 2-离子中的各一种组成(不 重复)。 ②其中甲、丙、戊三种溶液呈酸性,乙溶液呈碱性, ③甲、乙反应生成白色沉淀和气体,丁可分别与甲、乙、丙反应生成白色沉淀。 请回答下列问题: (1)用化学式表示出各物质:乙 、丁 。 ( 2 ) 请 用 离 子 方 程 式 表 示 戊 溶 液 呈 酸 性 的 原 因: 。 ( 3 ) 请 用 离 子 方 程 式 表 示 甲 与 乙 的 反 应: 。 (4)检验甲溶液中阴离子的方法是先加 试剂,再加 试剂,观察 到 。证明该阴离子存在。 (5)若丙、丁形成的白色沉淀的溶度积常数 Ksp=1.8×10-20,则将 1 L 1mol/L 的丙溶液与 1 L1 mol/L 的丁溶液混合充分反应后,不考虑溶液混合时的微小体积变化,形成沉淀的阳离 子的浓度约为 mol/L。 一、选择题(每小题只有一个选项, 每小题 3 分,共 48 分) 题 号 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 答 案 D C D A B C C D B D C D D C B B 二、非选择题(每空 2 分,共 52 分) 17.(1)P1 ﹤P2 (2)(a +b)﹤(c +d) (3)t1℃﹥t2℃ (4)吸热 18.(1)① 吸氧 ② 2H2O+O2+4e-=4OH- (2)① 阴极 4OH--4e-=2H2O+O2↑ ②2Cu2++2H2O 2Cu+O2↑+4H+ ③ 1;CuO 19.(14 分,每空 2 分) (1)引入的 Ca2+对人体无害 来源丰富 价格便宜(意思相近均给分) 铝(或 Al) (2)10Al+6NO3— +18H2O=10Al(OH)3↓+3N2↑+6OH— ( 3 ) 5H2+2NO3 — 催 化 剂 = N2↑+4H2O+2OH— ( 或 5H2+2NO3— + 2H + 催 化 剂 N2↑+6H2O) (4)NH4+ (aq)+2O2(g)=2H+(aq)+NO3- (aq)+H2O(l) △ H=-346 kJ· mol-1 20.(2)NH4++H2O NH3.H2O+H+; (3)2Al3++3CO3 2-+3H2O=2Al(OH)3↓+3CO2↑ (4)足量的盐酸, BaCl2, 白色沉淀 (5)3.6×10-20mol·L-1查看更多