- 2021-04-25 发布 |
- 37.5 KB |
- 5页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2021届高考化学一轮复习氧化还原反应作业(2)
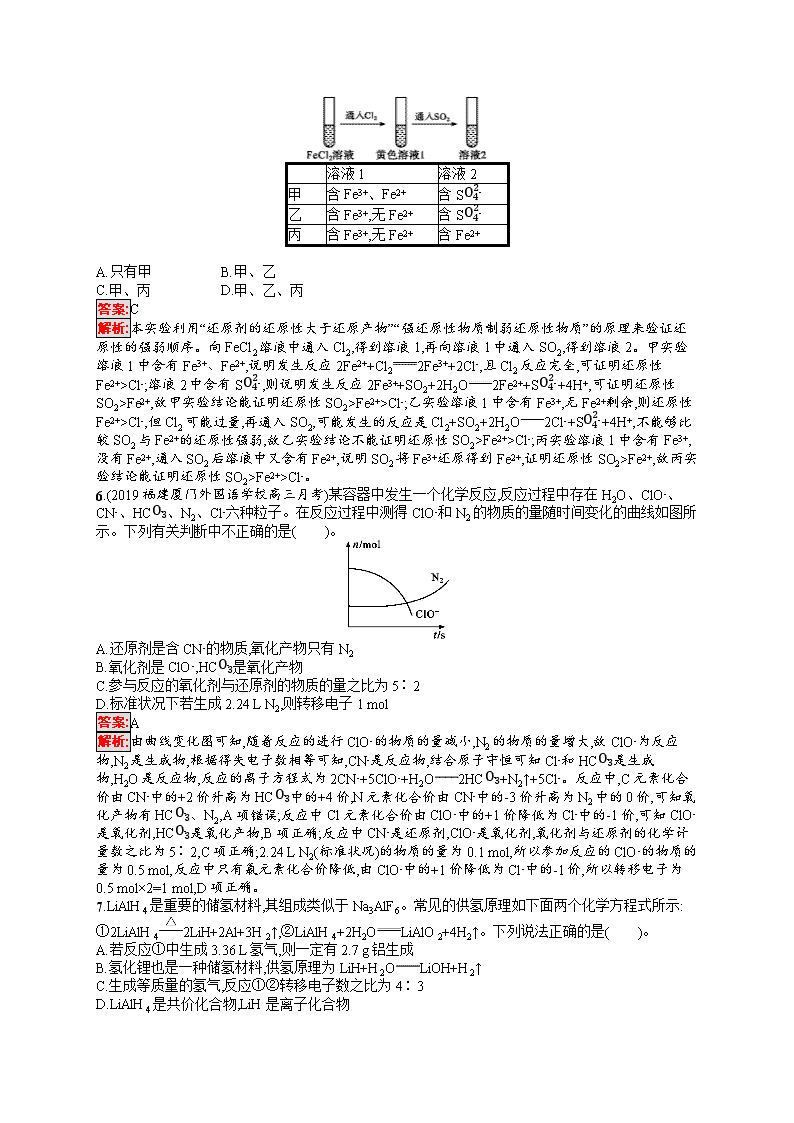
考点规范练5 氧化还原反应 (时间:45分钟 满分:100分) 考点规范练第10页 一、选择题(本题共10小题,每小题5分,共50分。每小题只有一个选项符合题目要求) 1.下列变化需要加入适当的氧化剂才能完成的是( )。 A.CuOCu B.H2SO4H2 C.FeFeCl2 D.HNO3N2 答案:C 解析:铜元素的化合价降低,则需要加入合适的还原剂来实现,如氢气,A项错误;氢元素的化合价降低,需要加入合适的还原剂来实现,如铁等,B项错误;铁元素的化合价升高,需要加入氧化剂才能实现,如盐酸,C项正确;氮元素的化合价降低,需要加入合适的还原剂来实现,D项错误。 2.用脱硫弧菌生物法净化硫化氢废气,是减小硫化氢对空气污染的一种方法。其反应原理为H2S+2HCO3-SO42-+CH3COOH,下列有关该反应的说法中正确的是( )。 A.反应过程中无能量变化 B.CH3COOH分子中只含有极性键 C.反应中HCO3-发生氧化反应 D.反应中生成1 mol CH3COOH转移电子为8 mol 答案:D 解析:任何化学反应均伴有能量变化,A项错误;CH3COOH中的碳氢键、碳氧单键、氧氢键、碳氧双键均为极性键,而碳碳单键为非极性键,B项错误;HCO3-中的碳元素为+4价,而CH3COOH中碳元素的平均化合价为0价,故发生了还原反应,C项错误;反应中生成1 mol CH3COOH转移8 mol电子,D项正确。 3.已知2Fe3++2I-2Fe2++I2,Br2+2Fe2+2Br-+2Fe3+。向含有FeBr2、FeI2的混合液中通入一定量的氯气后,再滴加少量KSCN溶液,溶液变为红色,则下列说法不正确的是( )。 A.按I-、Fe2+、Br-的顺序还原性逐渐减弱 B.通入氯气后原溶液中Fe2+一定被氧化 C.原溶液中Br-一定被氧化 D.不能确定通入氯气后的溶液中是否还存在Fe2+ 答案:C 解析:由2Fe3++2I-2Fe2++I2,Br2+2Fe2+2Br-+2Fe3+可知,还原性:I->Fe2+>Br-,A正确;加少量的KSCN溶液,溶液变为红色,可知通入氯气后原溶液中Fe2+一定被氧化,B正确;若通入氯气后Fe2+部分被氧化,则Br-没有被氧化,C错误;由上述实验不能确定通入氯气后的溶液中是否还存在Fe2+,D正确。 4.已知反应:①Cl2+2KBr2KCl+Br2,②KClO3+6HCl3Cl2↑+KCl+3H2O,③2KBrO3+Cl2Br2+2KClO3。 下列说法正确的是( )。 A.上述三个反应都有单质生成,所以都是置换反应 B.反应③中1 mol还原剂反应则氧化剂得到电子的物质的量为2 mol C.反应②中还原剂与氧化剂物质的量之比为6∶1 D.氧化性由强到弱顺序为KBrO3>KClO3>Cl2>Br2 答案:D 解析:反应②KClO3+6HCl3Cl2↑+KCl+3H2O,反应物中不存在单质,不属于置换反应,A错误;由电子守恒可知,反应③中1 mol还原剂(Cl2)反应,氧化剂得到电子的物质的量为1 mol×2×(5-0)=10 mol,B错误;反应②中还原剂为HCl,与氧化剂KClO3的物质的量之比为5∶1,有16HCl只表现酸性,C错误;由氧化剂的氧化性强于氧化产物的氧化性可知,氧化性由强到弱的顺序为KBrO3>KClO3>Cl2>Br2,D正确。 5.(2019天津静海第一中学高三质量检测)为验证还原性:SO2>Fe2+>Cl-,三组同学分别进行了下图实验,并对溶液1和溶液2中所含离子进行了检验,能证明上述还原性顺序的实验组有( )。 溶液1 溶液2 甲 含Fe3+、Fe2+ 含SO42- 乙 含Fe3+,无Fe2+ 含SO42- 丙 含Fe3+,无Fe2+ 含Fe2+ A.只有甲 B.甲、乙 C.甲、丙 D.甲、乙、丙 答案:C 解析:本实验利用“还原剂的还原性大于还原产物”“强还原性物质制弱还原性物质”的原理来验证还原性的强弱顺序。向FeCl2溶液中通入Cl2,得到溶液1,再向溶液1中通入SO2,得到溶液2。甲实验溶液1中含有Fe3+、Fe2+,说明发生反应2Fe2++Cl22Fe3++2Cl-,且Cl2反应完全,可证明还原性Fe2+>Cl-;溶液2中含有SO42-,则说明发生反应2Fe3++SO2+2H2O2Fe2++SO42-+4H+,可证明还原性SO2>Fe2+,故甲实验结论能证明还原性SO2>Fe2+>Cl-;乙实验溶液1中含有Fe3+,无Fe2+剩余,则还原性Fe2+>Cl-,但Cl2可能过量,再通入SO2,可能发生的反应是Cl2+SO2+2H2O2Cl-+SO42-+4H+,不能够比较SO2与Fe2+的还原性强弱,故乙实验结论不能证明还原性SO2>Fe2+>Cl-;丙实验溶液1中含有Fe3+,没有Fe2+,通入SO2后溶液中又含有Fe2+,说明SO2将Fe3+还原得到Fe2+,证明还原性SO2>Fe2+,故丙实验结论能证明还原性SO2>Fe2+>Cl-。 6.(2019福建厦门外国语学校高三月考)某容器中发生一个化学反应,反应过程中存在H2O、ClO-、CN-、HCO3-、N2、Cl-六种粒子。在反应过程中测得ClO-和N2的物质的量随时间变化的曲线如图所示。下列有关判断中不正确的是( )。 A.还原剂是含CN-的物质,氧化产物只有N2 B.氧化剂是ClO-,HCO3-是氧化产物 C.参与反应的氧化剂与还原剂的物质的量之比为5∶2 D.标准状况下若生成2.24 L N2,则转移电子1 mol 答案:A 解析:由曲线变化图可知,随着反应的进行ClO-的物质的量减小,N2的物质的量增大,故ClO-为反应物,N2是生成物,根据得失电子数相等可知,CN-是反应物,结合原子守恒可知Cl-和HCO3-是生成物,H2O是反应物,反应的离子方程式为2CN-+5ClO-+H2O2HCO3-+N2↑+5Cl-。反应中,C元素化合价由CN-中的+2价升高为HCO3-中的+4价,N元素化合价由CN-中的-3价升高为N2中的0价,可知氧化产物有HCO3-、N2,A项错误;反应中Cl元素化合价由ClO-中的+1价降低为Cl-中的-1价,可知ClO-是氧化剂,HCO3-是氧化产物,B项正确;反应中CN-是还原剂,ClO-是氧化剂,氧化剂与还原剂的化学计量数之比为5∶2,C项正确;2.24 L N2(标准状况)的物质的量为0.1 mol,所以参加反应的ClO-的物质的量为0.5 mol,反应中只有氯元素化合价降低,由ClO-中的+1价降低为Cl-中的-1价,所以转移电子为0.5 mol×2=1 mol,D项正确。 7.LiAlH4是重要的储氢材料,其组成类似于Na3AlF6。常见的供氢原理如下面两个化学方程式所示:①2LiAlH42LiH+2Al+3H2↑,②LiAlH4+2H2OLiAlO2+4H2↑。下列说法正确的是( )。 A.若反应①中生成3.36 L氢气,则一定有2.7 g铝生成 B.氢化锂也是一种储氢材料,供氢原理为LiH+H2OLiOH+H2↑ C.生成等质量的氢气,反应①②转移电子数之比为4∶3 D.LiAlH4是共价化合物,LiH是离子化合物 答案:B 解析:状态未知,无法由体积求物质的量,A项错误;氢化锂中的氢是-1价,与水发生归中反应,反应的化学方程式为LiH+H2OLiOH+H2↑,所以氢化锂也是一种储氢材料,B项正确;LiAlH4中的Li、Al都是主族金属元素,H是非金属元素,故Li为+1价、Al为+3价、H为-1价,受热分解时,根据Al元素的价态变化即可得出1 mol LiAlH4完全分解,转移3 mol电子,生成1.5 mol的氢气,而LiAlH4+2H2OLiAlO2+4H2↑生成4 mol氢气转移4 mol电子,所以生成1 mol的氢气转移电子分别为2 mol和1 mol,所以反应①②转移电子数之比为2∶1,C项错误;LiAlH4是离子化合物,LiH也是离子化合物,D项错误。 8.NaNO2是一种食品添加剂,能致癌。酸性KMnO4溶液与NaNO2反应的离子方程式是MnO4-+NO2-+ Mn2++NO3-+H2O(未配平),下列叙述中正确的是( )。 A.该反应中NO2-被还原 B.生成1 mol NaNO3需消耗0.4 mol KMnO4 C.反应过程中溶液的pH减小 D.横线上应填充的粒子是OH- 答案:B 解析:反应中Mn元素的化合价由+7价降低到+2价,所以MnO4-是氧化剂,NO2-作还原剂,NO2-中N失电子,N的化合价升高,在酸性条件下,生成NO3-,根据转移电子数相等和质量守恒配平方程式为2MnO4-+5NO2-+6H+2Mn2++5NO3-+3H2O。NO2-中N失电子,N的化合价升高,NO2-被氧化,A项错误;根据离子方程式知,生成1 mol NaNO3需消耗0.4 mol KMnO4,B项正确;该反应中H+参加反应,所以反应过程中H+浓度减小,溶液的pH增大,C项错误;通过以上分析知,横线上应填充的粒子为H+,D项错误。 9.将3.48 g四氧化三铁完全溶解在100 mL 1 mol·L-1的硫酸中,然后加入25 mL K2Cr2O7溶液,恰好使溶液中的Fe2+全部转化为Fe3+,Cr2O72-全部转化为Cr3+,则K2Cr2O7溶液的物质的量浓度是( )。 A.0.05 mol·L-1 B.0.1 mol·L-1 C.0.2 mol·L-1 D.0.3 mol·L-1 答案:B 解析:3.48 g四氧化三铁的物质的量是3.48 g232 g·mol-1=0.015 mol,与稀硫酸反应后溶液中Fe2+的物质的量是0.015 mol,与K2Cr2O7的反应中失去0.015 mol电子。在反应中Cr元素的化合价从+6价降低到+3价,依据得失电子数相等可知消耗K2Cr2O7的物质的量是0.015mol6=0.002 5 mol,则其浓度为0.002 5mol0.025 L=0.1 mol·L-1,B项正确。 10.Cu2S与一定浓度的HNO3反应,生成Cu(NO3)2、CuSO4、NO2、NO和H2O,当NO2和NO的体积相等时,实际参加反应的Cu2S与HNO3的物质的量之比为( )。 A.1∶7 B.1∶5 C.1∶9 D.2∶9 答案:A 解析:NO2和NO的体积相等,即物质的量相等,令物质的量均为1 mol,根据得失电子数目守恒,即有2n(Cu2S)×1+n(Cu2S)×8=1 mol×1+1 mol×3,解得n(Cu2S)=25 mol,参加反应的硝酸一部分作氧化剂,一部分表现酸性,因此n(Cu2S)∶n(HNO3)=25∶(2+45)=1∶7,A项正确。 二、非选择题(本题共4个小题,共50分) 11.(14分)Ⅰ.某实验小组为探究ClO-、I2、SO42-在酸性条件下的氧化性强弱,设计实验如下: 实验①:在淀粉-碘化钾溶液中加入少量次氯酸钠溶液,并加入少量的稀硫酸,溶液立即变蓝; 实验②:向实验①的溶液中加入4 mL 0.5 mol·L-1的亚硫酸钠溶液,蓝色恰好完全褪去。 (1)写出实验①中发生反应的离子方程式: 。 (2)实验②的化学反应中转移电子的物质的量是 。 (3)以上实验说明,在酸性条件下ClO-、I2、SO42-的氧化性由弱到强的顺序是 。 Ⅱ.(1)Cl2、H2O2、ClO2(还原产物为Cl-)、O3(1 mol O3转化为1 mol O2和1 mol H2O)等物质常被用作消毒剂。等物质的量的上述物质消毒效率最高的是 。 A.Cl2 B.H2O2 C.ClO2 D.O3 (2)“84”消毒液(有效成分是NaClO)和洁厕剂(主要成分是浓盐酸)不能混用,原因是 (用离子方程式表示)。 答案:Ⅰ.(1)ClO-+2I-+2H+I2+Cl-+H2O (2)0.004 mol (3)SO42-查看更多
相关文章
- 当前文档收益归属上传用户
- 下载本文档