- 2021-04-25 发布 |
- 37.5 KB |
- 27页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
【化学】安徽省枞阳县浮山中学2019-2020学年高二上学期期中考试(解析版)
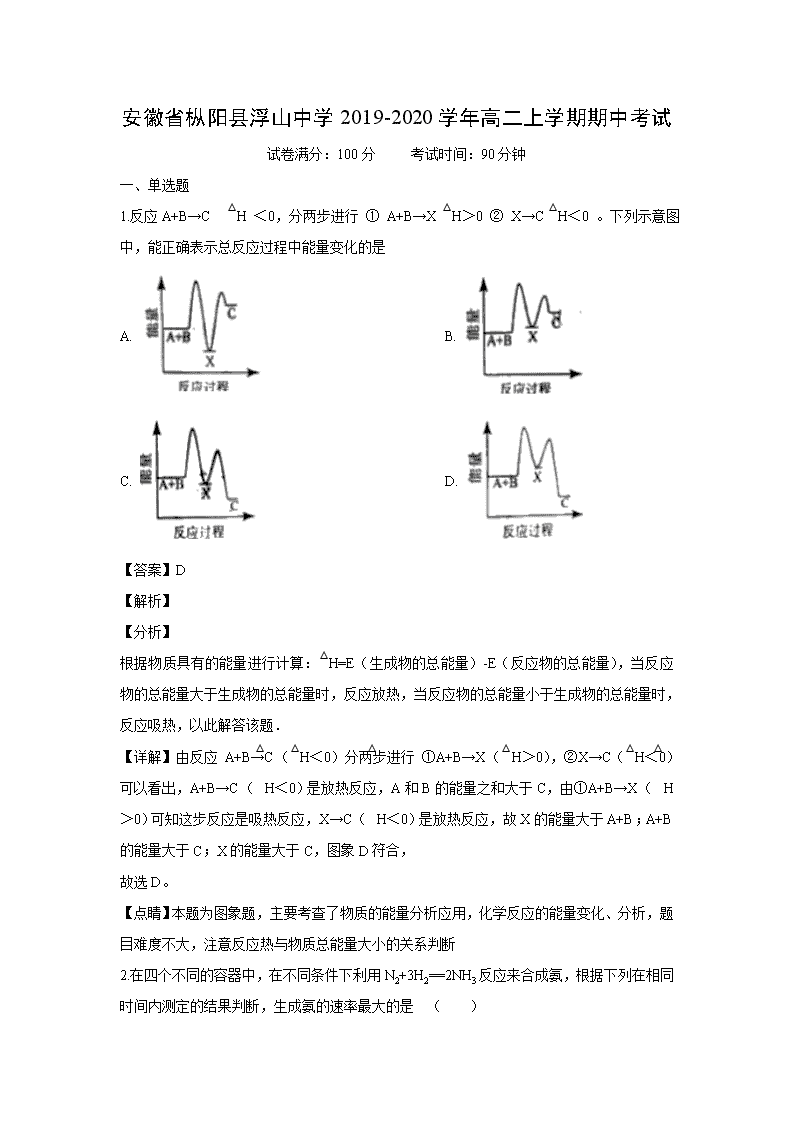
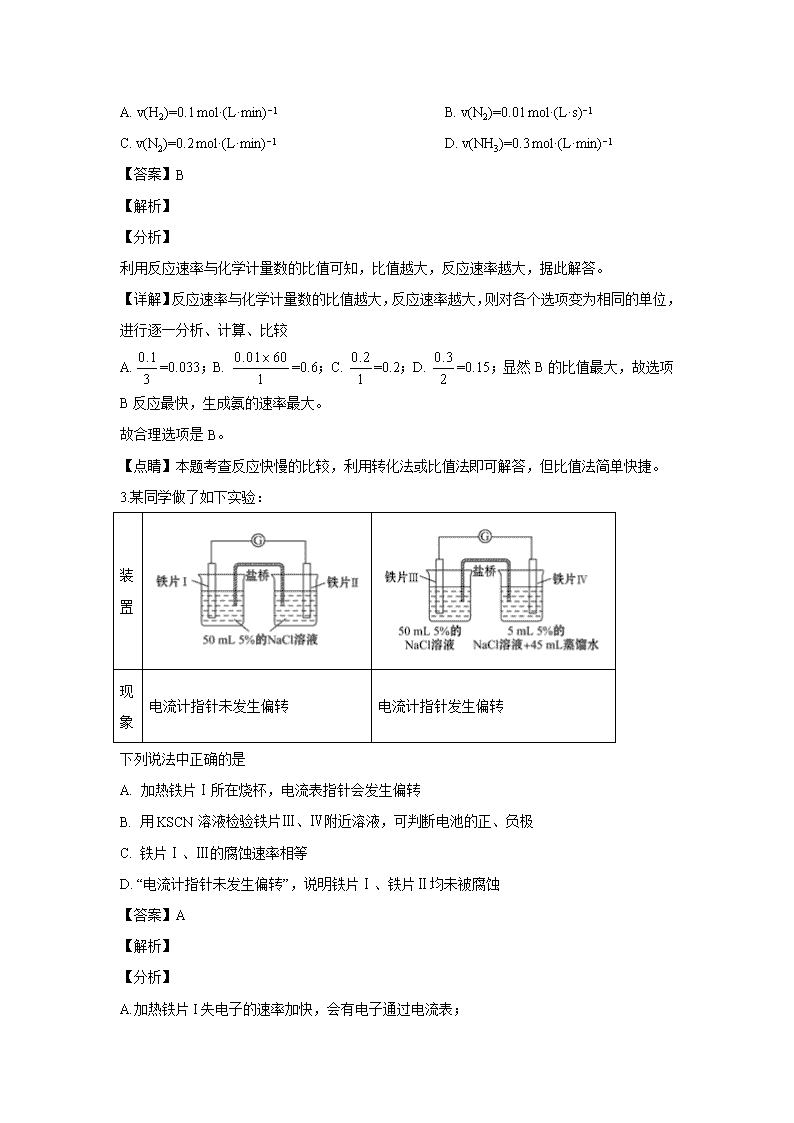
安徽省枞阳县浮山中学2019-2020学年高二上学期期中考试 试卷满分:100分 考试时间:90分钟 一、单选题 1.反应A+B→C △H <0,分两步进行 ① A+B→X △H>0 ② X→C △H<0 。下列示意图中,能正确表示总反应过程中能量变化的是 A. B. C. D. 【答案】D 【解析】 【分析】 根据物质具有的能量进行计算:△H=E(生成物的总能量)-E(反应物的总能量),当反应物的总能量大于生成物的总能量时,反应放热,当反应物的总能量小于生成物的总能量时,反应吸热,以此解答该题. 【详解】由反应 A+B→C(△H<0)分两步进行 ①A+B→X(△H>0),②X→C(△H<0)可以看出,A+B→C(△H<0)是放热反应,A和B的能量之和大于C,由①A+B→X(△H>0)可知这步反应是吸热反应,X→C(△H<0)是放热反应,故X的能量大于A+B;A+B的能量大于C;X的能量大于C,图象D符合, 故选D。 【点睛】本题为图象题,主要考查了物质的能量分析应用,化学反应的能量变化、分析,题目难度不大,注意反应热与物质总能量大小的关系判断 2.在四个不同的容器中,在不同条件下利用N2+3H2==2NH3反应来合成氨,根据下列在相同时间内测定的结果判断,生成氨的速率最大的是 ( ) A. v(H2)=0.1 mol·(L·min)−1 B. v(N2)=0.01 mol·(L·s)−1 C. v(N2)=0.2 mol·(L·min)−1 D. v(NH3)=0.3 mol·(L·min)−1 【答案】B 【解析】 【分析】 利用反应速率与化学计量数的比值可知,比值越大,反应速率越大,据此解答。 【详解】反应速率与化学计量数的比值越大,反应速率越大,则对各个选项变为相同的单位,进行逐一分析、计算、比较 A.=0.033;B.=0.6;C.=0.2;D.=0.15;显然B的比值最大,故选项B反应最快,生成氨的速率最大。 故合理选项是B。 【点睛】本题考查反应快慢的比较,利用转化法或比值法即可解答,但比值法简单快捷。 3.某同学做了如下实验: 装置 现象 电流计指针未发生偏转 电流计指针发生偏转 下列说法中正确的是 A. 加热铁片Ⅰ所在烧杯,电流表指针会发生偏转 B. 用KSCN溶液检验铁片Ⅲ、Ⅳ附近溶液,可判断电池的正、负极 C. 铁片Ⅰ、Ⅲ的腐蚀速率相等 D. “电流计指针未发生偏转”,说明铁片Ⅰ、铁片Ⅱ均未被腐蚀 【答案】A 【解析】 【分析】 A.加热铁片I失电子的速率加快,会有电子通过电流表; B.Fe在负极失电子生成亚铁离子; C.形成原电池会加快反应速率; D.铁片I、铁片Ⅱ都发生了腐蚀,但是腐蚀的速率相同 【详解】A.Fe在氯化钠溶液中发生腐蚀,加热后铁片I失电子的速率加快,会有电子通过电流表,电流表指针会发生偏转,A正确; B.Fe发生电化学腐蚀时,Fe在负极失电子生成亚铁离子,加KSCN溶液无现象,无法检验是否有亚铁离子生成,则不能判断正负极,B错误; C.形成原电池会加快反应速率,由于铁片III所处的电解质溶液浓度大,所以铁片Ⅲ的腐蚀速率比铁片I快,C错误; D.铁片I、铁片Ⅱ所处的化学环境相同,分别发生化学腐蚀,不能形成原电池,电路中没有电流通过,铁片I、II腐蚀的速率相同,,D错误; 故合理选项A。 【点睛】本题考查了原电池原理的应用的知识,注意把握原电池的原理、金属的电化学腐蚀、影响反应速率的因素,侧重于考查学生的分析能力和对基本原理的应用能力。 4.氢卤酸的能量关系如图所示下列说法正确的是 A. 已知HF气体溶于水放热,则HF的△H1<0 B. 相同条件下,HCl的△H2比HBr的小 C. 相同条件下,HCl的△H3+△H4比HI的大 D. 一定条件下,气态原子生成1molH-X键放出akJ能量,则该条件下△H2=+akJ/mol 【答案】D 【解析】 【分析】 A.根据△H1代表的是HX气体从溶液中逸出的过程分析判断; B.根据△H2代表的是HX的分解过程,结合HCl的HBr稳定性分析判断; C.根据△H3+△H4代表H(g)→H(aq)的焓变分析判断; D.一定条件下,气态原子生成1molH-X键放出akJ能量,则断开1molH-X键形成气态原子吸收akJ的能量,据此分析判断。 【详解】A.△H1代表的是HX气体从溶液中逸出的过程,因为HF气体溶于水放热,则HF气体溶于水的逆过程吸热,即HF的△H1>0,故A错误; B.由于HCl比HBr稳定,所以相同条件下HCl的△H2比HBr的大,故B错误; C.△H3+△H4代表H(g)→H(aq)的焓变,与是HCl的还是HI的无关,故C错误; D.一定条件下,气态原子生成1molH-X键放出akJ能量,则断开1molH-X键形成气态原子吸收akJ的能量,即为△H2=+akJ/mol,故D正确; 答案选D。 5.下列能用勒夏特列原理解释的是( ) A. H2、I2、HI平衡混合气加压后颜色变深 B. 工业上由氢气和氮气合成氨是在较高温度下进行的 C. Fe(SCN)3溶液中加入固体KSCN后颜色变深 D. SO2催化氧化成SO3的反应,往往需要使用催化剂 【答案】C 【解析】 【详解】A.可逆反应为H2(g)+I2(g)2HI(g),增大压强I2浓度增大,颜色加深,反应前后气体的体积不发生变化,增大压强平衡不移动,颜色加深是体积改变的原因,不能用用勒夏特列原理解释,故A不选; B.合成氨的正反应是放热反应,升高温度平衡逆向元素,不利于合成氨生产,但在较高温度下反应速率较大,则合成氨在较高温度下进行不能用平衡移动原理解释,故B不选; C.Fe(SCN)3溶液中存在Fe(SCN)3Fe3++3SCN-,加入固体KSCN,SCN-浓度增大,平衡逆向移动,颜色加深,能用勒夏特列原理解释,故选C; D.催化剂只改变反应速率不影响平衡移动,所以不能用平衡移动原理解释,故D不选; 故选A。 【点晴】使用勒夏特列原理时,必须注意研究对象必须为可逆反应,否则勒夏特列原理不适用,特别是改变平衡移动的因素不能用平衡移动原理解释,如催化剂的使用只能改变反应速率,不改变平衡移动,无法用勒夏特列原理解释。只有改变条件能影响平衡移动的可逆反应才能用平衡移动原理解释,易错选项是D。 6.可逆反应3H2(g) + N2(g)2NH3(g) △H〈0在一定条件下达到平衡状态,时间为t1时改变条件,化学反应速率与反应时间关系如图,下列说法中正确的是( ) A. 维持温度,反应体系体积不变,t1时充入NH3(g) B. 维持温度、压强不变,t1时充入NH3 C. 维持温度不变,t1时扩大反应体系体积 D. 维持压强不变,t1时升高反应体系温度 【答案】B 【解析】 【分析】 由图象可以看出,在t1时,逆反应速率增大,正反应速率减小,则该时刻反应物的浓度减小,生成物的浓度增大。 【详解】A、维持温度、反应体系体积不变,t1时充入NH3,此时逆反应速率增大,正反应速率不变,故A错误; B、维持温度、压强不变,t1时充入NH3,该时刻反应物的浓度减小,生成物的浓度增大,则逆反应速率增大,正反应速率减小,故B正确; C、维持温度不变,t1时扩大反应体系体积,反应物和生成物浓度都减小,正逆反应速率都减小,故C错误; D、维持压强不变,t1时升高反应体系温度,正逆反应速率都增大,不符合,故D错误。 答案选B。 【点睛】题考查考查化学反应速率和化学平衡图象,题目难度中等,注意分析图示中正逆反应速率的变化关系,结合影响反应速率的因素分析。 7.在某容积一定的密闭容器中,可逆反应:A(g)+B(g)xC(g),符合下列图象(Ⅰ)所示关系.由此推断对图(Ⅱ)的正确说法是 ( ). A. p3>p4,Y轴表示A的质量 B. p3<p4,Y轴表示B的百分含量 C. p3>p4,Y轴表示混合气体密度 D. p3>p4,Y轴表示混合气体平均摩尔质量 【答案】D 【解析】 【分析】 对图(I)用“先拐先平”法确定反应的特点,对图(II)用“定一议二”法分析。 【详解】对图(I),取曲线a、b,曲线b先出现拐点,T1、P2条件下反应速率比T1、P1条件下快,则P2P1,T1、P2条件下平衡时C%比T1、P1条件下大,增大压强平衡向正反应方向移动,则x=1;取曲线b、c,曲线b先出现拐点,T1、P2条件下反应速率比T2、P2条件下快,则T1T2,T1、P2条件下平衡时C%比T2、P2条件下小,升高温度平衡向逆反应方向移动,逆反应为吸热反应,则正反应为放热反应;反应A(g)+B(g)xC(g)的特点:正反应为气体分子数减小的放热反应。 A项,升高温度平衡向逆反应方向移动,A的质量增大,Y轴不能表示A的质量; B项,升高温度平衡向逆反应方向移动,B的百分含量增大,Y轴不能表示B的百分含量; C项,升高温度平衡向逆反应方向移动,因为A、B、C都是气体,气体的总质量始终不变,容器的容积一定,混合气体的密度不变,Y轴不能表示混合气体密度; D项,升高温度平衡向逆反应方向移动,气体分子物质的量增大,因为A、B、C都是气体,气体的总质量始终不变,混合气体的平均摩尔质量减小,P3P4时,增大压强平衡向正反应方向移动,气体分子物质的量减小,因为A、B、C都是气体,气体的总质量始终不变,混合气体的平均摩尔质量增大,Y轴可表示混合气体的平均摩尔质量; 答案选D。 【点睛】解答化学平衡图像题,首先分析图像中纵横坐标的含义、曲线的变化趋势,再结合温度、压强等外界因素对化学反应速率和化学平衡的影响作答。 8.一定条件下,在水溶液中1molCl-、ClOx-(x=1,2,3,4)的能量(kJ)相对大小如图所示。下列有关说法不正确的是( ) A. 这些离子中结合H+能力最强的是B B. A,B,C,D,E五种微粒中A最稳定 C. C→B+D的反应,反应物的总键能大于生成物的总键能 D. B→A+D是放热反应 【答案】C 【解析】 【分析】 酸性越弱的酸,其结合氢离子能力越强;能量越低越稳定;C→B+D,根据转移电子守恒得该反应方程式为2ClO2-=ClO3-+ClO-,反应热=(64kJ/mol+60kJ/mol)-2×100kJ/mol=-76kJ/mol,则该反应为放热;B→A+D,根据转移电子守恒得该反应方程式为3ClO-=ClO3-+2Cl-,反应热=(64kJ/mol+2×0kJ/mol)-3×60kJ/mol=-116kJ/mol。 【详解】A、酸性越弱的酸,其结合氢离子能力越强,次氯酸是最弱的酸,所以ClO-结合氢离子能力最强为B,故A正确; B、A、B、C、D、E中A能量最低,所以最稳定,故B正确; C、C→B+D,根据转移电子守恒得该反应方程式为2ClO2-=ClO3-+ClO-,反应热=(64kJ/mol+60kJ/mol)-2×100kJ/mol=-76kJ/mol,则该反应为放热,所以反应物的总键能小于生成物的总键能,故C错误; D、B→A+D,根据转移电子守恒得该反应方程式为3ClO-=ClO3-+2Cl-,反应热=(64kJ/mol+2×0kJ/mol)-3×60kJ/mol=-116kJ/mol,为放热反应,故D正确。 答案选C。 9.下列有关电化学知识的描述正确的是( ) A. 行人踩踏发电瓷砖(原理是利用行人踩踏地板产生的振动来发电)是将化学能转化为电能 B. 某原电池反应为Cu+2AgNO3===Cu(NO3)2+2Ag,装置中的盐桥可以装有含琼胶的KCl饱和溶液 C. 因为铁的活泼性强于铜,所以将铁、铜用导线连接后放入浓硝酸中,若能组成原电池,必是铁作负极、铜作正极 D. 理论上,任何能自发进行的且能放出能量的氧化还原反应都可设计成原电池 【答案】D 【解析】 【详解】A项、行人踩踏发电瓷砖是将动能转化为电能,故A错误; B项、KCl饱和溶液会与AgNO3溶液发生反应:KCl+AgNO3=AgCl↓+KNO3,反应生成AgCl沉淀会使盐桥中溶液的离子浓度减小,导电性减弱,所以不能使用KCl饱和溶液,可换成KNO3饱和溶液,故B错误; C项、铁遇到冷的浓硝酸会发生钝化,铁、铜在入浓硝酸中构成原电池时,铁作正极,铜作负极,故C错误; D项、构成原电池首要的条件是自发的发生氧化还原反应,所以理论上说,任何能自发进行的氧化还原反应都可设计成原电池,故D正确。 故选D 【点睛】本题考查了原电池原理,注意原电池的形成条件,知道原电池的反应特点,明确正负极的判断方法是解答关键。 10.在容积为1 L的恒容密闭容器中充入CO(g)和H2O(g),发生反应:CO(g) + H2O(g)CO2(g) + H2(g) ΔH<0,所得实验数据如下表: 实验 编号 温度/℃ 起始时物质的量/mol 平衡时物质的量/mol n(CO) n(H2O) n(CO2) ① 700 0.40 0.10 0.090 ② 800 0.10 0.40 0.080 ③ 800 0.20 0.30 a ④ 900 0.10 0.15 b 下列说法正确的是 A. 实验①中,若5 min时测得n (CO2) =0.050 mol,则0至5 min时间内,用H2表示的平均反应速率υ (H2) = 5.0×10-2 mol/(L·min) B. 实验②中,该条件下反应的平衡常数K =2.0 C. 实验③中,达到平衡时,CO的转化率为60% D. 实验④中,达到平衡时,b>0.060 【答案】C 【解析】 【详解】A.速率之比等于化学计量数之比,则v(H2)=v(CO2)== = 1.0×10-2mol/(L•min),A项错误; B.实验②中平衡时CO2为0.080 mol,则: 由于反应中气体的化学计量数相等,可以用物质的量代替浓度计算平衡常数,故实验②中,该反应的平衡常数K = = = 1,B项错误; C.温度不变,平衡常数不变,则K=1,因平衡时n(CO2) = a mol,则列三段式如下: 则K==1,解得a=0.12,实验③中CO的转化率=×100%=60%,C项正确; D.该反应为放热反应,则升高温度,平衡常数K减小,所以K(900℃)<K(800℃)<1,平衡时CO2为b mol,则: 则K=<1,解得b < 0.060,D项错误; 答案为C。 【点睛】化学平衡图表题,首先要搞变量间的关系,搞清楚变化趋势,确定平衡状态,再结合化学反应速率和影响平衡的因素进行分析,速率的计算一定要紧扣公式,搞清浓度的变化与所需要的时间;分析平衡的移动时要将反应原理与改变的条件相结合;至于平衡的计算可利用三段式进行计算,相对要容易得多,也不易出错。 11.利用如图所示装置(电极均为惰性电极)可吸收SO2,并用阴极排出的溶液吸收NO2。下列说法正确的是 A. a为直流电源的负极 B. 阴极的电极反应式为2HSO3-+2H++e-=S2O42-+2H2O C. 阳极的电极反应式为SO2+2H2O-2e-=SO42-+4H+ D. 电解时,H+由阴极室通过阳离子交换膜到阳极室 【答案】C 【解析】 【详解】A.在与a电极连接的电极上SO2失去电子,被氧化产生SO42-,所以阳极与电源正极a电极连接,A错误; B.根据选项A分析可知:a为正极,b为负极,所以阴极获得电子,发生还原反应,电极反应式为2HSO3-+2H++2e-=S2O42-+2H2O,B错误; C.在阳极SO2失去电子被氧化产生SO42-,阳极的电极反应式为SO2+2H2O-2e-=SO42-+4H+,C正确; D.阳离子交换膜只允许阳离子通过,电解时,阳离子移向阴极,所以H+由阳极室通过阳离子交换膜到阴极室,D错误; 故合理选项是C。 12.向1L的密闭容器中加入1molX、0.3molZ和一定量的Y三种气体。一定条件下发生反应,各物质的浓度随时间的变化如图甲所示。图乙为t2 时刻后改变反应条件,平衡体系中反应速率随时间变化的情况,且四个阶段都各改变一种不同的条件。下列说法不正确的是 A. Y的起始物质的量为0.5mol B. 该反应的化学方程式为2X(g)+Y(g)3Z(g) ΔH<0 C. 若t0 =0,t1=10s,则t0~t1阶段的平均反应速率为v(Z)=0.03mol·L-1·s-1 D. 反应物X的转化率t6点比t3点高 【答案】B 【解析】 【详解】A.从图甲可以看出,从t0到t1,X的物质的量(由于容器体积为1L,所以物质的量和物质的量浓度相等)从1.0mol减少到0.8mol,减少了0.2mol,Z的物质的量从0.3mol增加到0.6mol,增加了0.3mol。再根据图乙,四个阶段改变的条件不同,在t3时刻,平衡不移动,只是速率增大了,所以应该是使用了催化剂,在t4时刻,平衡仍然不移动,但速率都降低,应该是降低了压强,所以该反应中反应前后气体的化学计量数之和相等,从t0到t1,X的物质的量减少了0.2mol,Z的物质的量增加了0.3mol,所以Y的物质的量应该减少0.1mol,平衡时Y为0.4mol,所以开始时Y为0.5mol,故A不选; B. 从t0到t1,X的物质的量减少了0.2mol,Z的物质的量增加了0.3mol,Y的物质的量减少了0.1mol,所以在化学方程式里,X、Y、Z的化学计量数比为2:3:1,X和Y是反应物,Z是生成物,而且t1后,各物质的浓度不再变化,说明该反应是可逆反应,所以化学方程式为2X(g)+Y(g)3Z(g)。根据图乙,在t2时刻,只有正反应速率或逆反应速率增大了,说明增大了反应物或生成物的浓度,在t5时刻,正逆反应速率都增大了,说明升高了温度。升高温度,v正>v逆,平衡向正反应方向移动,所以该反应的正反应是吸热的,ΔH>0,故B选; C. t0~t1阶段的平均反应速率为v(Z)=0.3mol/L÷10s=0.03mol·L-1·s-1,故C不选; D. t3到t5,平衡没有移动,t5时升高温度,平衡正向移动,反应物的转化率提高,所以X的转化率t6点比t3点高,故D不选; 故选B。 【点睛】在浓度、温度、压强和催化剂这四种因素中,催化剂一定不能使平衡发生移动,对反应前后气体系数之和相等的反应,压强的改变也不能使平衡移动,但改变反应物或生成物的浓度和改变温度一定会使平衡移动。所以在图乙中,t3和t4时刻,一定分别是使用了催化剂和降低了压强。 13.可逆反应A2 + 3B2(?)2AB3(g)中,AB3的百分含量(w)与温度和压强的关系如图所示。下列说法正确的是( ) A. 该反应为吸热反应 B. 反应物B2为气体 C. 升高温度,逆反应速率减慢 D. 增大压强,A2转化率减小 【答案】B 【解析】 【分析】 采取定一议二方式解答,由图可知,温度一定时,压强越大,AB3的百分含量(w)越大,故增大压强平衡向正反应移动,故B一定为气体;压强一定时,温度越低,AB3的百分含量(w)越大,平衡正向移动,故该反应为放热反应。 【详解】A、压强一定时,温度越低,AB3的百分含量(w)越大,平衡正向移动,故该反应为放热反应,故A错误; B、由图可知,温度一定时,压强越大,AB3的百分含量(w)越大,故增大压强平衡向正反应移动,故B一定为气体,故B正确; C、升高温度,逆反应速率应该加快,故C错误; D、增大压强,平衡正向移动,A2转化率增大,故D错误。 答案选B。 【点睛】本题考查外界条件对化学反应速率、化学平衡移动影响、学生识图能力,难度不大,做题时注意分析图象曲线的变化特点,采取定一议二解答。 14.下列说法正确的是( ) A. 在合成氨工业中,移走NH3可增大正反应速率,提高原料转化率 B. 恒温下进行的反应2NO2(g)N2O4(g)达平衡时,缩小容器体积再达平衡时,气体的颜色比第一次平衡时的深,NO2的体积分数比原平衡大 C. 常温下,MgO(s)+C(s)=Mg(s)+CO(g)不能自发进行,则其△H>0 D. 对于反应3KSCN(aq)+FeCl3(aq)Fe(SCN)3(aq)+3KCl(aq),加入KCl固体,逆反应速率瞬时增大,随后正反应速率增大 【答案】C 【解析】 【详解】A、在合成氨工业中,移走NH3的时刻正反应速率不变,随即减小,平衡正向移动,提高原料转化率,故A错误; B、缩小容器体积再达平衡时,浓度增大,且压强增大平衡正向进行的程度小于浓度增大的程度,则气体的颜色比第一次平衡时的深,NO2的体积分数比原平衡小,故B错误; C、△H-T△S<0的反应可自发进行,常温下,MgO(s)+C(s)=Mg(s)+CO(g)△S>0,不能自发进行,则其△H>0,故C正确; D、氯离子不参与该离子反应,故加入氯化钾后平衡不移动,故D错误。 答案选C。 【点睛】本题考查了平衡移动原理,难度不大,注意使用勒夏特列原理的前提必须是可逆反应,易错点为D。 15.在潮湿的深层土壤中,钢管主要发生厌氧腐蚀,有关厌氧腐蚀的机理有多种,其中一种理论为厌氧细菌可促使SO42-与H2反应生成S2-,加速钢管的腐蚀,其反应原理如图所示。下列说法正确的是( ) A. 正极的电极反应式为:2H2O+O2+4e-=4OH- B. SO42-与H2的反应可表示为:4H2+SO42--8eS2-+4H2O C. 钢管腐蚀的直接产物中含有FeS、Fe(OH)2 D. 在钢管表面镀锌或铜可减缓钢管的腐蚀 【答案】C 【解析】 【详解】A.正极上水发生还原反应生成H2,电极反应式为2H2O +2e-=2OH-+H2,故A错误; B.SO42-与H2在厌氧细菌的催化作用下反应生成S2-和H2O,离子反应式为:4H2+SO42-S2-+4H2O,故B错误; C.钢管腐蚀的过程中,负极上Fe失电子发生氧化反应生成的Fe2+,与正极周围的S2-和OH-分别生成FeS的Fe(OH)2,故C正确; D.在钢管表面镀锌可减缓钢管的腐蚀,但镀铜破损后容易形成Fe-Cu原电池会加速铁的腐蚀,故D错误; 故答案为C。 16.已知在一定条件下2SO2(g)+O2(g)2SO3(g) ΔH=-QkJ·mol-1。向一密闭容器中加入2molSO2和1molO2,达平衡时SO2的转化率为90%,放出的热量为Q1;向另一相同容器中加入2molSO3,在相同条件下,达平衡时吸收的热量为Q2,则下列关系中正确的是( ) A. Q>Q1>Q2 B. Q2>Q>Q1 C. Q1>Q>Q2 D. Q>Q1=Q2 【答案】A 【解析】 【详解】两个容器中进行的反应为等效平衡,向密闭容器中加入2molSO2和1molO2,达平衡时SO2的转化率为90%,放出的热量为Q1=90%;向另一相同容器中加入2molSO3,反应从逆向开始,则转化率为1-90%=10%,Q2=10%Q,则 Q>Q1>Q2,故A正确; 答案:A 【点睛】根据热化学方程式的含义以及从正反应和逆反应方向建立的等效平衡,同种物质的转化率和生成率之和为100%来分析。 17.在容积一定的密闭容器中,置入一定量的NO(g)和足量C(s),发生反应C(s)+2NO(g) CO2(g)+N2(g),平衡状态时NO(g)的物质的量浓度[NO]与温度T的关系如图所示。则下列说法中正确的是( ) A. 该反应的ΔH>0 B. 若该反应在T1、T2时的平衡常数分别为K1、K2,则K1查看更多