- 2021-04-23 发布 |
- 37.5 KB |
- 4页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
化学中常用的物理量----物质的量(3) 教案
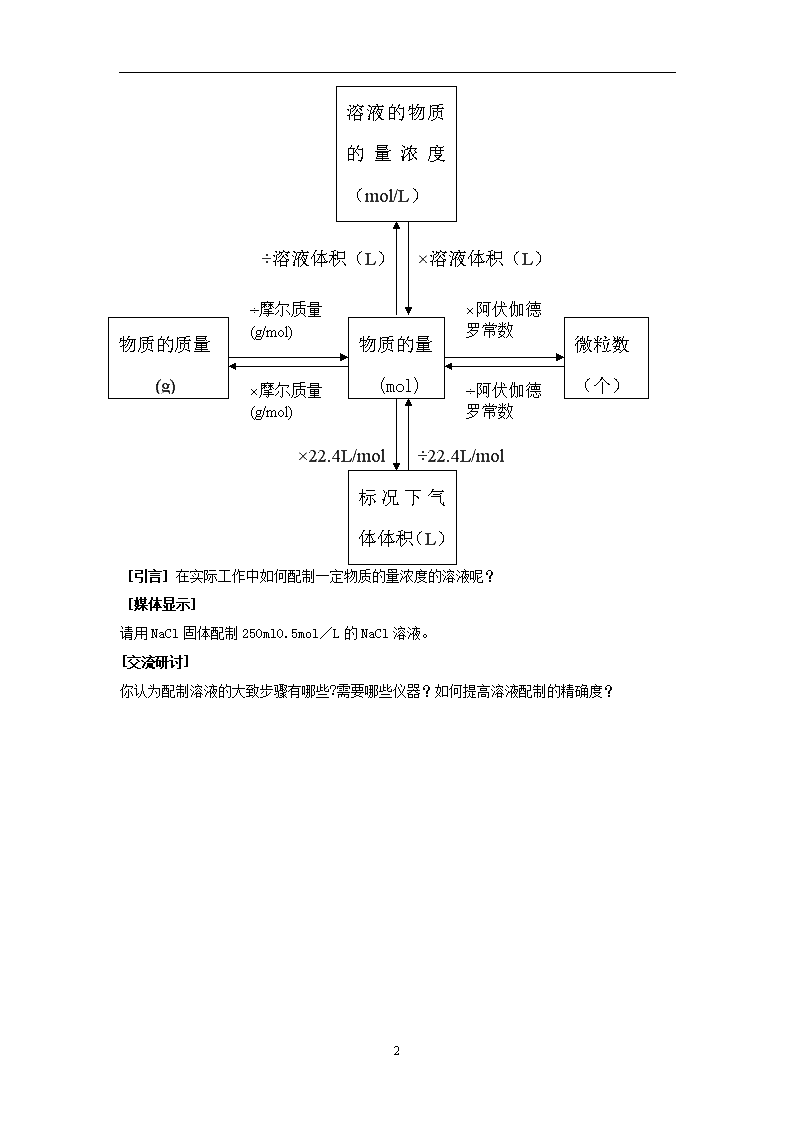
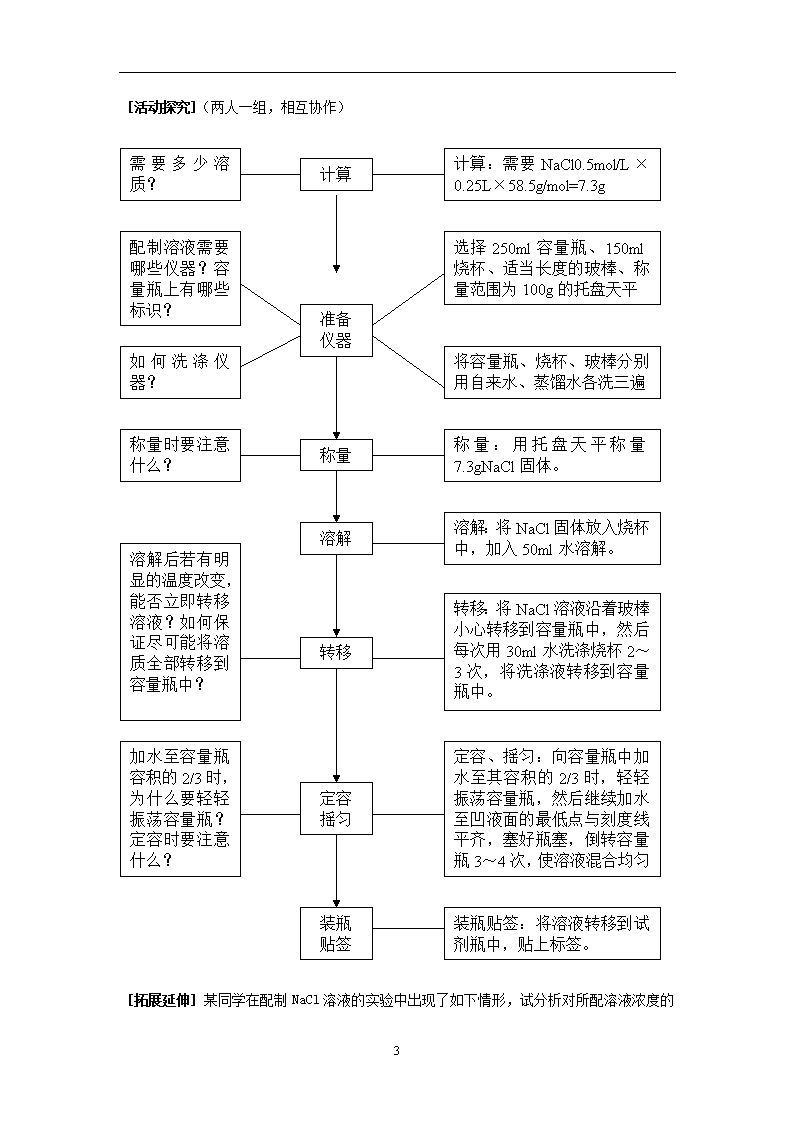
第1章第3节 化学中常用的物理量----物质的量 第 三 课 时 [引言]初中阶段,我们学习了用质量分数表示溶液的组成。通过质量分数,我们可以求出一定质量的溶液中含有多少溶质。但是,在化学计算中,我们更多的应用到物质的量,因此,我们需要用物质的量表示溶液的组成――物质的量浓度――以单位体积溶液所含溶质B的物质的量来表示溶液组成的物理量。 [讲述、媒体显示] 三、物质的量浓度 以单位体积溶液所含溶质B的物质的量来表示溶液组成的物理量,叫做溶质B的物质的量浓度(CB) CB=n/V n ――― 溶质B的物质的量(mol) V ―――溶液的体积(L或m3等) CB―――溶质B的物质的量浓度(mol/L、mol/m3等) [迁移、应用] 将53gNa2CO3固体溶于水配成0.5升溶液,所得Na2CO3溶液物质的量浓度是多少? 1mol/L的H2SO4溶液中CH+、CSO42-分别是多少?将1molNaCl、1molCaCl2溶于水配成1升溶液,所得溶液中各离子物质的量浓度是多少? [概括整合] (媒体显示) 4 ×溶液体积(L) ÷溶液体积(L) ÷22.4L/mol ×22.4L/mol 物质的质量 (g) 物质的量 (mol) 微粒数 (个) ÷摩尔质量 (g/mol) ×摩尔质量 (g/mol) ×阿伏伽德罗常数 ÷阿伏伽德罗常数 标况下气体体积(L) 溶液的物质的量浓度(mol/L) [引言]在实际工作中如何配制一定物质的量浓度的溶液呢? [媒体显示] 请用NaCl固体配制250ml0.5mol/L的NaCl溶液。 [交流研讨] 你认为配制溶液的大致步骤有哪些?需要哪些仪器?如何提高溶液配制的精确度? 4 计算:需要NaCl0.5mol/L×0.25L×58.5g/mol=7.3g 需要多少溶质? 计算 配制溶液需要哪些仪器?容量瓶上有哪些标识? 选择250ml容量瓶、150ml烧杯、适当长度的玻棒、称量范围为100g的托盘天平 将容量瓶、烧杯、玻棒分别用自来水、蒸馏水各洗三遍 如何洗涤仪器? 准备 仪器 称量:用托盘天平称量7.3gNaCl固体。 称量 称量时要注意什么? 溶解:将NaCl固体放入烧杯中,加入50ml水溶解。 溶解 转移:将NaCl溶液沿着玻棒小心转移到容量瓶中,然后每次用30ml水洗涤烧杯2~3次,将洗涤液转移到容量瓶中。 转移 溶解后若有明显的温度改变,能否立即转移溶液?如何保证尽可能将溶质全部转移到容量瓶中? 定容、摇匀:向容量瓶中加水至其容积的2/3时,轻轻振荡容量瓶,然后继续加水至凹液面的最低点与刻度线平齐,塞好瓶塞,倒转容量瓶3~4次,使溶液混合均匀 定容 摇匀 加水至容量瓶容积的2/3时,为什么要轻轻振荡容量瓶?定容时要注意什么? 装瓶贴签:将溶液转移到试剂瓶中,贴上标签。 装瓶 贴签 [活动探究](两人一组,相互协作) [拓展延伸] 4 某同学在配制NaCl溶液的实验中出现了如下情形,试分析对所配溶液浓度的影响 操 作 实 情 对溶液物质的量浓度的影响 称量前未调零点,天平指针偏向左边 要称取7.3gNaCl固体,将药品放在右边托盘上称量 容量瓶洗涤后未干燥 未洗涤溶解NaCl固体的烧杯 加水至容量瓶容积的2/3时,未轻轻振荡容量瓶 定容时眼睛处于仰视的位置 摇匀后发现凹液面的最低点低于刻度线,再加水至刻度线 第 四 课 时 [引言]引入物质的量后,不仅解决了一定量的宏观物质中含有多少微粒数的问题,而且也为根据化学反应计算带来极大的方便。 [讲述、媒体显示] 点燃 四、物质的量与化学反应 2H2 + O2 2H2O 从质量角度: 4g 32g 36g 从分子数角度: 2分子 1分子 2分子 从物质的量角度: 2mol 1mol 2mol 从标况下气体体积角度: 44.8L 22.4L 从任意相同条件气体体积角度: 2体积 1体积 [迁移应用] ▼分别从质量角度、微观粒子数角度、物质的量角度、从标况下气体体积角度、从任意相同条件气体体积角度分析化学反应2NO+O2===2NO2中各物质间的数量关系。 ▼P24交流研讨 ▼在标准状况下。CH4气体0.224升,充分燃烧时消耗O2多少摩尔?生成水多少克?如果将生成的CO2气体用2mol/L的NaOH溶液吸收,需要多少毫升的NaOH溶液? [拓展延伸] ▼如何用质量分数为98%,密度为1.84g/ml的浓硫酸配制250ml 2mol/L的稀硫酸? ▼试探讨溶液的质量分数与物质的量浓度的换算关系 4查看更多