- 2021-04-23 发布 |
- 37.5 KB |
- 13页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
山东省滨州市2020届高三三模考试化学试题
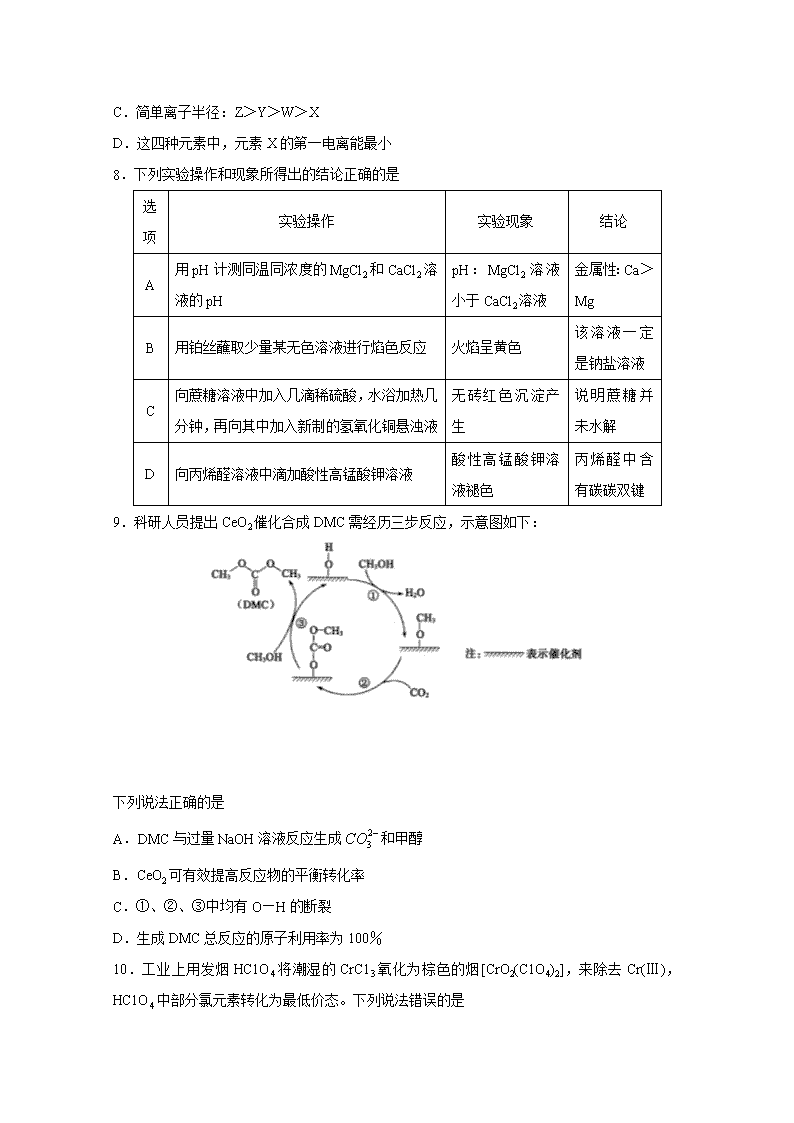
高 三 化 学 试 题 注意事项: 1答题前,考生先将自己的姓名、考生号、座号填写在相应位置,认真核对条形码上的姓名、考生号和座号,并将条形码粘贴在指定位置上。 2.选择题答案必须使用2B铅笔(按填涂样例)正确填涂;非选择题答案必须使用0.5毫米黑色签字笔书写,字体工整、笔迹清楚。 3.请按照题号在各题目的答题区域内作答,超出答题区域书写的答案无效;在草稿纸、试题卷上答题无效。保持卡面清洁,不折叠、不破损。 可能用到的相对原子质量: H 1 C 12 N 14 O 16 Na 23 C1 35.5 Fe 56 Ni 59 Cu 64 一、选择题:本题共10小题,每小题2分,共20分。每小题只有一个选项符合题意。 l.化学与生产、生活密切相关,下列有关说法错误的是 A.改变能源结构,开发利用清洁能源,可防治酸雨 B.“智慧海洋”引领我国海洋开发走向“深蓝”,大型舰船的底部常镶嵌锌块做负极,防止船底腐蚀 C.为增强杀菌消毒效果,可将“84消毒液”和酒精混合使用 D.维生素C具有还原性,食用维生素C含量较高的食物有利于人体对铁元素的吸收 2.下列实验操作中选用的部分仪器,不合理的是 A.配制100mL0.1mol·L-1NaC1溶液,选用③、⑤、⑥和⑧ B.盛放NaOH溶液,选用④ C.分离I2的四氯化碳溶液和水,选用②、③ D.从食盐水中获得食盐,选用①、⑥、⑦ 3.下列化学用语只能用来表示一种微粒的是 A.C B.CH4O C.2s22p6 D. 4.《内经》曰:“五谷为养,五果为助,五畜为益,五莱为充”。合理膳食,能提高免疫力。下列说法错误的是 A.蔗糖水解生成互为同分异构体的葡萄糖和果糖 B.食用油在酶作用下水解为高级脂肪酸和甘油 C.苹果中富含的苹果酸[HOOCCH(OH)CH2COOH]是乙二酸的同系物 D.天然蛋白质水解后可得到α-氨基酸,甘氨酸和丙氨酸两种分子间可生成两种二肽 5.NA表示阿伏加德罗常数的值,下列说法正确的是 A.0.5mol雄黄(As4S4,)中古有4NA个共价键 B.通过核反应生成2.88g镆(Mc),同时产生中子(n)数为0.3NA C.100g 3.4%的过氧化氢溶液中氧原子数为0.2NA D.常温常压下,2.8g由CO与N2组成的混合物中含有的质子总数为1.4NA 6.维纶(聚乙烯醇缩甲醛纤维)可用于生产服装、绳索等。其合成路线如下: 下列说法错误的是 A.反应①是加聚反应 B.高分子A的链节中只含有一种官能团 C.通过质谱法测定高分子B的平均相对分子质量,可得其聚合度 D.反应③的化学方程式为 7.已知W、X、Y,Z均为短周期元素,常温下,它们的最高价氧化物对应的水化物溶液(浓度均为0.01mol·L-1)的pH和原子半径、原子序数的关系如图所示。下列说法正确的是 A.化合物X2Y2中含有极性共价键和非极性共价键 B.简单气态氢化物的热稳定性:Y>W C.简单离子半径:Z>Y>W>X D.这四种元素中,元素X的第一电离能最小 8.下列实验操作和现象所得出的结论正确的是 选项 实验操作 实验现象 结论 A 用pH计测同温同浓度的MgCl2和CaCl2溶液的pH pH:MgCl2溶液小于CaCl2溶液 金属性:Ca>Mg B 用铂丝蘸取少量某无色溶液进行焰色反应 火焰呈黄色 该溶液一定是钠盐溶液 C 向蔗糖溶液中加入几滴稀硫酸,水浴加热几分钟,再向其中加入新制的氢氧化铜悬浊液 无砖红色沉淀产生 说明蔗糖并未水解 D 向丙烯醛溶液中滴加酸性高锰酸钾溶液 酸性高锰酸钾溶液褪色 丙烯醛中含有碳碳双键 9.科研人员提出CeO2催化合成DMC需经历三步反应,示意图如下: 下列说法正确的是 A.DMC与过量NaOH溶液反应生成和甲醇 B.CeO2可有效提高反应物的平衡转化率 C.①、②、③中均有O—H的断裂 D.生成DMC总反应的原子利用率为100% 10.工业上用发烟HC1O4将潮湿的CrC13氧化为棕色的烟[CrO2(C1O4)2],来除去Cr(Ⅲ),HC1O4中部分氯元素转化为最低价态。下列说法错误的是 A.CrO2(C1O4)2中Cr元素显+6价 B.HC1O4属于强酸,该反应还生成了另一种强酸 C.该反应中,参加反应的氧化剂与氧化产物的物质的量之比为3:8 D.该反应离子方程式为19+8Cr3++8OH-=8CrO2(ClO4)2+3C1-+4H2O 二、选择题:本题共5小题,每小题4分,共20分。每小题有一个或两个选项符合题意,全部选对得4分,选对但不全的得2分,有选错的得0分。 11.潮湿环境、C1-、溶解氧是造成青铜器锈蚀的主要环境因素,腐蚀严重的青铜器表面大多存在起催化作用的多孔催化层。下图为青铜器发生电化学腐蚀的原理示意图,下列说法正确的是 A.腐蚀过程中,青铜基体是正极 B.若有64g Cu腐蚀,理论上消耗氧气的体积为11.2L(标准状况) C.多孔催化层的形成加速了青铜器的腐蚀速率,是因为改变了反应的焓变 D.环境中的C1-、正负极产物作用生成多孔粉状锈,其离子方程式为 2Cu2++3OH-+C1-=Cu2(OH)3C1↓ 12.一种制氢技术原理如下图所示,下列说法正确的是 A.向容器Ⅰ中加入CaO能有效实现H2与CO2的分离 B.因为容器Ⅰ中还有剩余的煤,可以判断煤和H2O的反应为可逆反应 C.剩余的煤进入容器Ⅱ,可利用其与O2反应放出的热量分解CaCO3 D.煤中含有的硫元素在容器Ⅱ中最终转化为CaSO3进入炉渣 13.常温下,向1mol·L-1NH4C1溶液中加入足量的镁条,该体系pH随时间变化的曲线如图所示。实验观察到b点开始溶液中有白色沉淀生成。下列说法错误的是(已知Ksp[Mg(OH)2]=1.8×10-11) A.a点溶液中,c()+c(H+)<c(C1-)+c(OH-) B.b点时,溶液中c(Mg2+)=0.18mol·L-1 C.体系中,水的电离程度大小关系为a>c>b D.常温下,NH4C1的水解平衡常数数量级为10-10 14.我国科研团队成功研究出高比能量、低成本的钠离子二次电池,其工作原理如图所示。已知电池反应:。下列说法正确的是 A.电池放电过程中,NaMnO2/A1上的电势低于石墨烯/A1上的电势 B.电池放电时,正极可发生反应Na1-xMnO2+xNa++xe-=NaMnO2 C.电池充电时,外接电源的负极连接NaMnO2/A1电极 D.电池充电时,Na+由NaMnO2/A1电极移向石墨烯/A1电极 15.工业上联合生产碳酸氢钠和氯代烃的工艺流程如图所示,在生产NaHCO3的过程中完成乙烯氯化,下列叙述错误的是 A.过程Ⅰ中的TBA替代了侯德榜制碱法中的氨气 催化剂 B.在过程Ⅱ中实现了TBA、CuCl2的再生 C.过程Ⅲ中的反应方程式为C2H4+2CuCl2 C2H4C12+2CuC1 D.理论上每生成1molNaHCO3,可得到1molC2H4C12 三、非选择题:本题共5小题,共60分。 16.(12分)铜及其化合物在生产生活中有着广泛的应用。请回答下列问题: (1)铜元素位于元素周期表中___________区,基态Cu原子有_______种不同能级的电子。 (2)铜合金可用于制造航母螺旋桨。制造过程中产生的含铜废液可利用铜萃取剂M,通过如下反应实现铜离子的富集回收。 ①M所含元素的电负性由大到小的顺序为_____________________(用元素符号表示)。 ②X中采用sp3杂化的非金属原子有_____________(填元素名称)。 (3)在较低温度下CuFeS2与浓硫酸作用时,有少量臭鸡蛋气味的气体Y产生。Y分子的立体构型是____________,Y的沸点比水低的主要原因是___________________。 (4)向蓝色{[Cu(H2O)4]2+}硫酸铜溶液中加入稍过量的氨水,溶液变为深蓝色{[Cu(NH3)4]2+}。通过上述实验现象可知,与Cu2+的配位能力:H2O___________NH3(填“大于”或“小于”)。 (5)CuCl2和CuC1是铜的两种氯化物。 ①上图表示的是_____________(填“CuC12”或“CuC1”)的晶胞。 ②原子坐标参数可用来表示晶胞内各原子的相对位置,图中各原子坐标参数A为(0,0,0);B为(0,1,1);C为(1,0,0);则D原子的坐标参数为________________. ③晶胞中C、D两原子核间距为298pm,阿伏加德罗常数的值为NA,则该晶体密度为________________g·cm-3(列出计算式即可)。 17.(13分)氯化亚铁是重要的还原剂,常用于检测硒、生产聚合氯化铝铁絮凝剂。制备FeCl2 的方法有多种。请回答下列问题: Ⅰ.结晶法制取FeCl2 在一定浓度的盐酸中,逐渐加入过量的铁屑,充分反应后,蒸发至出现晶膜,___________,______________,固液分离,洗涤,快速干燥制得。 Ⅱ.氯苯还原无水FeC13制取FeC12 无水FeCl3与氯苯反应的化学方程式为: (1)右图是用干燥的C12和铁粉制取无水FeC13的装置。硬质玻璃管和收集器用大口管连接的原因是______________________________________。 (2)利用下图装置制备无水FeC12,并检测FeC13的转化率。已知相关物质的部分性质如下: C6H5C1(氯苯) C6H4C12 FeC13 FeC12 相对分子质量 112.5 147 162.5 127 熔点/℃ -45 53 306 670~674 沸点/℃ 132 173 315 1023 将162.5g无水氯化铁和200g氯苯加入到圆底烧瓶中, 在锥形瓶中加入200g滴有酚酞的9.5%的NaOH溶液。 先通入N2一段时间,再加热,控制温度在132℃左右发 生反应。实验完成后冷却,分离提纯得到粗产品。 ①先通入N2的目的是____________;导管a的作用是___________________。 (2)当锥形瓶内溶液颜色由红色变为无色时,停止加热,则氯化铁转化率理论上达到或超过__________%。 ③实验结束后,回收过量氯苯的操作名称为_______________。 ④指出装置c可能存在的缺点_________________________________。 18.(13分)海水是巨大的化学资源宝库,利用海水可以提取很多物质。 利用1:提溴工业 用海水晒盐之后的盐卤可提取溴,提取流程如下: (1)吹出塔中热空气能将溴单质吹出的原因是_______________。蒸馏塔中通入水蒸气进行加热,需要控制温度在90℃左右的原因是_________________________。 利用2:提镁工业 从海水提取食盐和Br2之后的盐卤中除含有Mg2+、C1-外,还含有少量Na+、Fe2+、Fe3+、和CO(NH2)2等,还可以用来提取MgCl2、MgO、Mg(OH)2等物质,流程如下图所示: (2)用NaC1O除去尿素CO(NH2)2时,生成物除盐外,还有能参与大气循环的无毒物质,则该反应的化学方程式为_____________;加入NaC1O的另一个作用是_______________。 利用3:淡化工业 (3)海水淡化的方法主要有闪蒸法、离子交换法、电渗析法等。离子交换法淡化海水模拟过程如右图所示。氢型阳离子交换原理可表示为:HR+Na+=NaR+H+;……。羟型阴离子交换树脂填充部分存在的反应有:ROH+C1-=RC1+OH-;________________;_________________。 (4)电渗析法是一种利用离子交换膜进行海水淡化的方法,其原理如下图所示: ①图中的海水没有直接通入到阴极室中,其原因是_________________________。 ②淡化水在____________室(填X、Y、Z、M或N)形成后流出。 19.(10分)CO在工农业生产及科学研究中有着重要的应用。 (1)CO催化脱硫:科学研究发现CoS对CO还原SO2实现脱硫、并回收S有很好的催化效果,该反应的化学方程式为_______________________________。 (2)CO催化脱氮:在一定温度下,向2L的恒容密闭容器中充入4.0molNO2和4.0molCO,在催化制作用下发生反应: =-1227.8kJ·mol-1,测得相关数据如下: 时间 浓度 0min 5min 10min 15min 20min C(NO2)/mol·L-1 2.0 1.7 1.56 1.5 1.5 C(N2) /mol·L-1 0 0.15 0.22 0.25 0.25 ①其他条件不变,若不使用催化剂,则0~5min内NO2的转化率将___________(填“变大”“变小”或“不变”)。 ②下列表述能说明该反应已达到平衡状态的是____________(填序号)。 A.CO的化学反应速率为N2的4倍 B.气体的颜色不再变化 C.化学平衡常数K不再变化 D.混合气体的密度不再变化 ③有利于提高该反应中NO2平衡转化率的条件是____________(填序号)。 A.高温低压 B.低温高压 C.高温高压 D.低温低压 (3)CO与Ni发生羰化反应形成的络台物可作为催化烯烃反应的催化剂。Ni的羰化反应为Ni(s)+4CO(g)Ni(CO)4(g) <0,T0温度下,将足量的Ni粉和3.7molCO加入到刚性密闭容器中,10min时反应达到平衡,测得体系的压强为原来的。则: ①0~10min内平均反应速率v(Ni)=________________g·min-1。 ②研究表明,正反应速率v正=k正·x4(CO),逆反应速率v逆=k逆·x[Ni(CO)4](k正和k逆分别表示正反应和逆反应的速率常数,x为物质的量分数),计算T0温度下的=________。 ③T1温度下测得一定的实验数据,计算得到v正~x(CO)和v逆~x[Ni(CO)4]的关系如图所示。当降低温度时,反应重新达到平衡,相应的点分别为____________、___________(填字母)。 20.(12分)海南粗榧新碱是从植物中提取的、具有边缘抗肿瘤活性的生物碱,合成该碱的一种常见中间体G的合成线路如下: 已知 ① ② 回答下列问题: (1)X为醛类物质,其名称为_______________。 (2)B→的反应类型为__________________。 (3)D→E的反应方程式为____________________________。 (4)化合物F的结构简式为_______________________。 (5)有机物Y是A的同分异构体,满足下列条件的Y还有____________种。 ①能与FeC13溶液发生显色反应 ②1mo1Y与足量金属Na反应生成1mo1H2 ③结构中含“” 其中核磁共振氢谱显示为4组峰,且峰面积比为2:2:1:1的物质为____________(写出其中一种结构简式)。 6)设计以为起始原料制备的合成线路(无机试剂任选) 高三化学试题参考答案 一、选择题:本题共10小题,每小题2分,共20分。每小题只有一个选项符合题意。 1.C 2.B 3.B 4.C 5.D 6.D 7.D 8.A 9.A 10.D 二、选择题:本题共5小题,每小题4分,共20分。每小题有一个或两个选项符合题意,全部选对得4分,选对但不全的得2分,有选错的得0分。 11.BD 12.AC 13.C 14.BD 15.D 三、非选择题:本题共5小题,共60分。 16.(12分) (1)ds(1分) 7(或七)(1分) (2)O>N>C>H(1分) 碳、氧(1分) (3)V形(或角形)(1分) 水分子间存在氢键,H2S分子间不存在氢键(1分) (4)小于(1分) (5)CuC1(1分) (2分) (2分) 17.(13分) Ⅰ.趁热过滤(1分) (冷却)结晶(1分) Ⅱ.(1)FeC13的焙沸点低,防止FeC13冷凝时堵塞导管(2分) (2)①除尽装置中的O2和水蒸气,防止FeCl2被氧化、防止发生水解反应(2分) 导气,冷凝回流氯苯(2分) ②95(2分) ③蒸馏(1分) ④无防倒吸装置(2分) 18.(13分) (1)溴单质的沸点低,溴单质易挥发(2分) 温度过低不利于溴的蒸出,温度过高会蒸出较多水蒸气(1分) (2)3NaC1O+CO(NH2)2=3NaC1+CO2↑+N2↑+2H2O(2分) 将Fe2+氧化为Fe3+,并形成Fe(OH)3(2分) (3)2ROH+=R2SO4+2OH-(1分) H++OH-=H2O(1分) (4)①海水中含有较多的Mg2+、Ca2+等阳离子,阴极放电产生OH-,容易生成Mg(OH)2和Ca(OH)2等沉淀附着在电极表面或堵塞交换膜(2分) ②Y、M(2分) CoS 19.(10分) (I)2CO+SO2 2CO2+S(2分) (2)①变小(1分) ②B(1分) ③B(1分) (3)①5.31(1分) ②9×103(或9000)(2分) ③D(1分) B(1分) 20.(12分) (1)甲醛(1分) (2)加成(还原)反应(1分) (3) (2分) (4) (2分) (5)8(2分) 或或(1分) (6)(3分)查看更多