- 2021-04-22 发布 |
- 37.5 KB |
- 42页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2020届二轮复习原子结构与性质课件(42张)(全国通用)
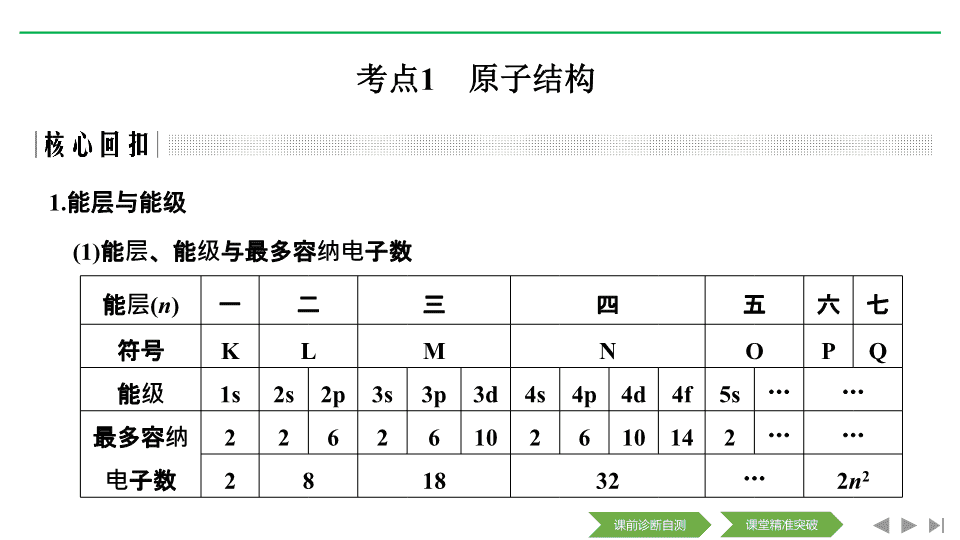
第 1 讲 原子结构与性质 【考纲点击】 原子结构与元素的性质: (1) 了解原子核外电子的运动状态、能级分布和排布原理,能正确书写 1 ~ 3 6 号元素原子核外电子、价电子的电子排布式和电子排布图 ( 轨道表达式 ) ; (2) 了解电离能的含义,并能用以说明元素的某些性质; (3) 了解电子在原子轨道之间的跃迁及其简单应用; (4) 了解电负性的概念并能用以说明元素的某些性质。 考点 1 原子结构 1. 能层与能级 (1) 能层、能级与最多容纳电子数 能层 ( n ) 一 二 三 四 五 六 七 符号 K L M N O P Q 能级 1s 2s 2p 3s 3p 3d 4s 4p 4d 4f 5s … … 最多容纳电子数 2 2 6 2 6 10 2 6 10 14 2 … … 2 8 18 32 … 2 n 2 (2) 常见原子轨道电子云轮廓 原子轨道 电子云轮廓形状 轨道个数 s 球形 1 p 哑铃形 3(p x , p y , p z ) 2. 核外电子排布 (1) 排布规律 ① 能量最低原理:基态原子核外电子优先占据能量最低的原子轨道,如 Ge : 1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 2 4p 2 。 ② 泡利不相容原理:每个原子轨道上最多只能容纳 2 个自旋状态相反的电子。 ③ 洪特规则:原子核外电子在能量相同的各轨道上排布时,电子总是优先单独占据一个轨道,且自旋状态相同。 ④ 洪特规则特例 在能量最低原理的基础上,当轨道出现半充满、全充满、全空时,能量更低。 例: Cu 1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 1 Cr 1s 2 2s 2 2p 6 3s 2 3p 6 3d 5 4s 1 (2) 四种表示方法 c. 核外电子排布式简写错误 如 : 31 Ga [Ar]4s 2 4p 1 应为 [Ar]3d 10 4s 2 4p 1 33 As [Ar]4s 2 4p 3 应为 [Ar]3d 10 4s 2 4p 3 ② 电子排布图 1.(1) [2019· 课标全国 Ⅰ , 35(1)] 下列状态的镁中,电离最外层一个电子所需能量最大的是 ________( 填标号 ) 。 (2) [2018· 课标全国 Ⅰ , 35(1)(2)] ① 下列 Li 原子电子排布图表示的状态中,能量最低和最高的分别为 ________ 、 ________( 填标号 ) 。 ② Li + 与 H - 具有相同的电子构型, r (Li + ) 小于 r (H - ) ,原因是 ________ 。 答案 (1)A (2) ① D C ② Li + 核电荷数较大 2.(1) [2019· 课标全国 Ⅱ , 35(2)] Fe 成为阳离子时首先失去 ________ 轨道电子, Sm 的价层电子排布式为 4f 6 6s 2 , Sm 3 + 价层电子排布式为 ________ 。 (2) [2018· 课标全国 Ⅱ , 35(1)] 基态 Fe 原子价层电子的电子排布图 ( 轨道表达式 ) 为 ________________________________ ,基态 S 原子电子占据最高能级的电子云轮廓图为 ________ 形。 哑铃 ( 纺锤 ) 3.(1) [2019· 课标全国 Ⅲ , 35(1)] 在周期表中,与 Li 的化学性质最相似的邻族元素是 ________ ,该元素基态原子核外 M 层电子的自旋状态 ________( 填 “ 相同 ” 或 “ 相反 ” ) 。 (2) [2017· 课标全国 Ⅰ , 35(1)(2)] ① 元素 K 的焰色反应呈紫红色,其中紫色对应的辐射波长为 ________ nm( 填标号 ) 。 A.404.4 B. 553.5 C.589.2 D.670.8 E.766.5 ② 基态 K 原子中,核外电子占据的最高能层的符号是 ________ ,占据该能层电子的电子云轮廓图形状为 ________ 。 答案 (1)Mg 相反 (2) ① A ② N 球形 4.(1) [2017· 课标全国 Ⅱ , 35(1)] 氮原子价层电子的轨道表达式 ( 电子排布图 ) 为 ________________ 。 (2) [2017· 课标全国 Ⅲ , 35(1)] Co 基态原子核外电子排布式为 ________________ 。元素 Mn 与 O 中,第一电离能较大的是 ________ ,基态原子核外未成对电子数较多的是 ________ 。 (3) [2016· 全国 Ⅰ 卷, 37(1)] 基态 Ge 原子的核外电子排布式为 [Ar]________ ,有 ________ 个未成对电子。 (4) [2016· 课标全国 Ⅱ , 37(1)] 镍元素基态原子的电子排布式为 ________ , 3d 能级上的未成对电子数为 ________ 。 1. 若某原子处于能量最低状态时,外围电子排布式为 4d 1 5s 2 ,下列说法正确的是 ( ) A. 该元素原子最外层共有 3 个电子 B. 该元素处于第五周期第 Ⅱ A 族 C. 该元素原子核外 N 层上共有 9 个不同运动状态的电子 D. 该元素原子第四电子层上有 5 个空轨道 解析 A 项,该元素原子最外层共有 2 个电子; B 项,该元素位于第五周期第 Ⅲ B 族; C 项,该元素原子核外 N 层电子排布式为 4s 2 4p 6 4d 1 ,共有 9 个不同运动状态的电子; D 项,该元素原子第四电子层上有 4 个空轨道。 答案 C 2. 按要求书写: (1)Sc 的价电子排布式 _______________________________________ 。 (2)V 的价电子排布图 ________________________________________ 。 (3) 基态铜原子的核外电子排布式 ( 简写 ) : _________________________ 。 (4) 基态 Ga 原子的核外电子排布式 ( 简写 ) : ________________________ 。 (5) 第四周期核外电子排布未成对电子数和周期数相同的基态原子的核外电子排布式 ( 简写 ) : ______________________________________________________ 。 3.Ni 是元素周期表中第 28 号元素,第二周期基态原子未成对电子数与 Ni 相同且电负性小的元素是 ________ ; 26 号元素价层电子排布式为 ________ ; L 原子核外电子占有 9 个轨道,而且有一个未成对电子, L 是 ________ 元素。 答案 C 3d 6 4s 2 Cl 考点 2 电离能与电负性 1. 原子结构与性质 (1) 元素第一电离能与电负性的周期性变化 元素的第一电离能 电负性 同周期 ( 从左到右 ) 同主族 ( 自上而下 ) 同周期 ( 从左到右 ) 同主族 ( 自上而下 ) 元素的第一电离能总体上呈增大的趋势 元素的第一电离能逐渐减小 主族元素的电负性逐渐增大 主族元素的电负性逐渐减小 (2) 图示第一电离能的变化规律 说明 同周期元素,从左到右第一电离能呈增大趋势。同能级的轨道为全满、半满、全空时较相邻元素要大,即第 Ⅱ A 族、第 Ⅴ A 族元素的第一电离能分别大于同周期相邻元素。如 Be 、 N 、 Mg 、 P 。 2. 电离能、电负性大小判断 规律 在周期表中,电离能从左到右呈增大趋势、电负性从左到右逐渐增大,从上往下逐渐减小 特性 同周期主族元素,第 Ⅱ A 族 ( n p) 全空、 Ⅴ A 族 ( n p 3 ) 半充满,比较稳定,所以其第一电离能大于同周期相邻的第 Ⅲ A 和 Ⅵ A 族元素 方法 常常应用化合价及物质类别判断电负性的大小,如 O 与 Cl 的电负性比较: ① HClO 中 Cl 为+ 1 价、 O 为- 2 价,可知 O 的电负性大于 Cl ; ② Al 2 O 3 是离子化合物、 AlCl 3 是共价化合物,可知 O 的电负性大于 Cl 3. 电离能、电负性的应用 (1) 电离能的应用 判断元素金 属性的强弱 电离能越小,金属越容易失去电子,金属性越强;反之越弱 判断元素 的化合价 如果某元素的 I n + 1 ≫ I n ,则该元素的常见化合价为+ n ,如钠元素 I 2 ≫ I 1 ,所以钠元素的化合价为+ 1 (2) 电负性的应用 1. [2018· 课标全国 Ⅲ , 35(1)(2)] (1)Zn 原子核外电子排布式为 ________________ 。 (2) 黄铜是人类最早使用的合金之一,主要由 Zn 和 Cu 组成。第一电离能 I 1 (Zn)________ I 1 (Cu)( 填 “ 大于 ” 或 “ 小于 ” ) 。原因是 _______________ ______________________________________________________ 。 答案 (1)[Ar]3d 10 4s 2 ( 或 1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 2 ) (2) 大于 Zn 核外电子排布为全满稳定结构,较难失电子 2.(1) [2019· 课标全国 Ⅲ , 35(4)] NH 4 H 2 PO 4 中,电负性最高的元素是 ________ ; P 的 ________ 杂化轨道与 O 的 2p 轨道形成 ________ 键。 (2) [2017· 江苏化学, 21(A) - (3)] C 、 H 、 O 三种元素的电负性由小到大的顺序为 ________________ 。 (3) [2017· 课标全国 Ⅱ , 35(2)] 元素的基态气态原子得到一 个电子形成气态负一价离子时所放出的能量称作第一电子 亲和能 ( E 1 ) 。第二周期部分元素的 E 1 变化趋势如图所示, 其中除氮元素外,其他元素的 E 1 自左而右依次增大的原因是 ______________________________________________________ ; 氮元素的 E 1 呈现异常的原因是 _____________________________ 。 答案 (1)O sp 3 σ (2)H查看更多