- 2021-04-22 发布 |
- 37.5 KB |
- 27页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
山东省2020届高三新高考仿真试卷系列化学试题(5)
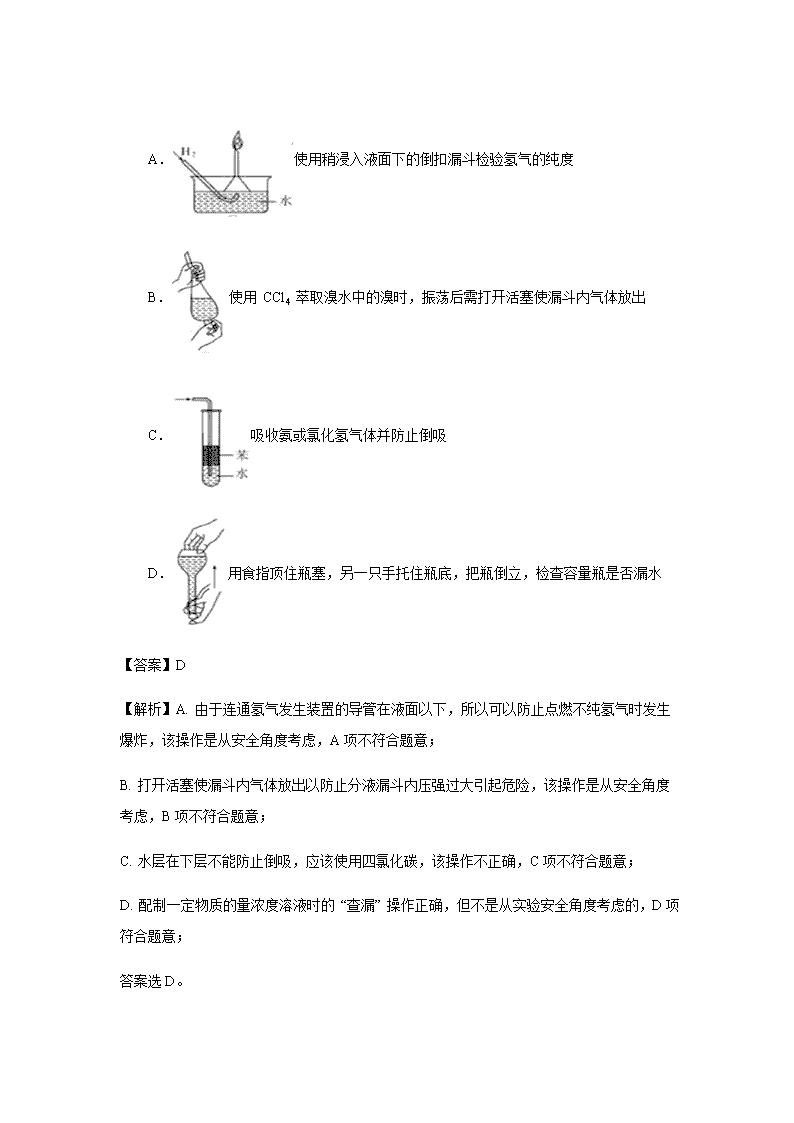
2020年山东新高考仿真试卷系列-化学(5) 1.答题前,考生先将自己的姓名、考生号、座号填写在相应位置,认真核对条形码上的姓名、考生号和座号,并将条形码粘贴在指定位置上。 2.选择题答案必须使用2B铅笔(按填涂样例)正确填涂;非选择题答案必须使用0.5毫米黑色签字笔书写,字体工整、笔迹清楚。 3.请按照题号在各题目的答题区域内作答,超出答题区域书写的答案无效;在草稿纸、试题卷上答题无效。保持卡面清洁,不折叠、不破损。 可能用到的相对原子质量:H 1 N 14 O 16 P 31 S 32 Zn 65 一、 选择题(本题共10小题,每小题2分,共20分。每小题只有一个选项符合题意。) 1.在2020年抗击新型冠状病毒肺炎的战役中化学品发挥了重要作用。下列说法中错误的是( ) A.医用消毒酒精中乙醇的浓度为95% B.生产医用防护口罩的原料聚丙烯纤维属于有机高分子材料 C.84消毒液、二氧化氯泡腾片可作为环境消毒剂 D.硝酸铵制成的医用速冷冰袋利用了硝酸铵溶于水吸热的性质 【答案】A 【解析】医用消毒酒精中乙醇的浓度为75%,这个浓度的酒精使病毒中的蛋白质变性,从而杀死病毒,A错误;PP纤维也称聚丙烯纤维,由聚丙烯及多种有机、无机材料,经特殊的复合技术精制而成的有机高分子材料,B正确;84消毒液、二氧化氯具有强氧化性,可作为环境消毒剂,C正确;硝酸铵溶于水是吸热的,可以用于医用速冷冰袋,D正确;故选A。 2.下列实验操作正确但不是从实验安全角度考虑的是 A.使用稍浸入液面下的倒扣漏斗检验氢气的纯度 B.使用 CCl4 萃取溴水中的溴时,振荡后需打开活塞使漏斗内气体放出 C.吸收氨或氯化氢气体并防止倒吸 D.用食指顶住瓶塞,另一只手托住瓶底,把瓶倒立,检查容量瓶是否漏水 【答案】D 【解析】A. 由于连通氢气发生装置的导管在液面以下,所以可以防止点燃不纯氢气时发生爆炸,该操作是从安全角度考虑,A项不符合题意; B. 打开活塞使漏斗内气体放出以防止分液漏斗内压强过大引起危险,该操作是从安全角度考虑,B项不符合题意; C. 水层在下层不能防止倒吸,应该使用四氯化碳,该操作不正确,C项不符合题意; D. 配制一定物质的量浓度溶液时的 “查漏” 操作正确,但不是从实验安全角度考虑的,D项符合题意; 答案选D。 3.下列化学用语表达不正确的是( ) ①丙烷的球棍模型 ②丙烯的结构简式为CH3CHCH2 ③某有机物的名称是2,3-二甲基戊烷 ④与C8H6互为同分异构体 A.①② B.②③ C.③④ D.②④ 【答案】D 【解析】①丙烷的球棍模型为,①正确; ②丙烯的结构简式应为CH3CH=CH2,②不正确; ③某有机物的名称是2,3-二甲基戊烷,③正确; ④的分子式为C8H6,但分子式为C8H6的其结构并不知道,因此二者不一定是同分异构体,④不正确; 答案选D。 4.设NA为阿伏加德罗常数的值,下列说法不正确的是 A.1L0.1mol·L-1Fe2(SO4)3溶液中含有的阳离子数目小于0.2NA B.0.24g Mg在O2和CO2的混合气体中完全燃烧,转移电子数为0.02NA C.3g由CO2和SO2组成的混合气体中含有的质子数为1.5NA D.1molNa2O2与SO2完全反应,转移电子数为2NA 【答案】A 【解析】A. 铁离子在溶液中水解导致阳离子个数增多,故溶液中阳离子个数多于0.2NA 个,故A错误; B. 0.24g Mg为0.01mol,Mg在O2和CO2的混合气体中完全燃烧生成MgO,失去0.02mol电子,则转移电子数为0.02NA,故B正确; C. CO2的摩尔质量为44g/mol,含22个质子;SO2的摩尔质量为64g/mol,含32个质子,即两者均是2g中含1mol质子,故3g混合物中含1.5mol质子即1.5NA个质子,故C正确; D.过氧化钠与二氧化硫反应生成硫酸钠,1mol过氧化钠中的−1价的氧原子变为−2价,故1mol过氧化钠转移2mol电子即2NA个,故D正确; 答案选A。 5.化合物Y具有抗菌、消炎作用,可由X制得。下列有关化合物X、Y的说法不正确的是( ) A.1molX最多能与3molNaOH反应 B.Y与乙醇发生酯化反应可得到X C.X、Y均能使酸性高锰酸钾溶液褪色 D.室温下X、Y分别与足量Br2加成的产物分子中手性碳原子数目相等 【答案】B 【解析】A. X中能与NaOH反应的官能团是羧基和酯基,1mol羧基能消耗1molNaOH,X中酯基水解成羧基和酚羟基,都能与氢氧化钠发生中和反应,1mol这样的酯基,消耗2molNaOH,即1molX最多能与3molNaOH反应,故A说法正确; B. Y中含有羟基,对比X和Y的结构简式,Y和乙酸发生酯化反应得到X,故B说法错误; C. 碳碳双键及连接苯环的碳原子上含有H 原子的结构都能与酸性高锰酸钾溶液反应,而使酸性高锰酸钾溶液褪色,故C说法正确; D. X中只有碳碳双键能和溴发生加成反应,Y中碳碳双键能和溴发生反应,两种有机物与溴反应后,X、Y中手性碳原子都是4个,故D说法正确; 答案:B。 6.短周期元素a、b、c、d的原子序数依次增大,在下列转化关系中,甲、乙、丙、丁、戊为上述四种元素组成的二元或三元化合物。其中A为d元素组成的单质,常温下乙为液体,丁物质常用于消毒、漂白。下列说法错误的是 A.简单离子半径:c>b B.丙中既有离子键又有极性键 C.b、c形成的化合物中阴、阳离子数目比为1:2 D.a、b、d形成的化合物中,d的杂化方式是sp3 【答案】A 【解析】【分析】短周期元素a、b、c、d的原子序数依次增大,常温下乙为液体,应该为H2O,则a为H元素,A为d元素组成的单质,且与丙反应生成水和常用于消毒、漂白的丁,则丙应为碱,由转化关系可知甲为Na2O,丙为NaOH,A为Cl2,生成丁、戊为NaCl,NaClO,可知b为O元素、c为Na元素、d为Cl元素,以此解答该题。 【详解】由以上分析可知a为H元素、b为O元素、c为Na元素、d为Cl元素,甲为Na2O、乙为H2O、丙为NaOH、丁为NaClO、戊为NaCl; A.b、c对应的离子为O2-和Na+,具有相同的核外电子排布,核电荷数越大离子半径越小,则离子半径O2->Na+,即b>c,故A错误; B.丙为NaOH,由Na+和OH-组成,则含有离子键和极性共价键,故B正确; C.b为O元素、c为Na元素,两者组成的Na2O和Na2O2中阴、阳离子数目比均为1:2,故C正确; D.a、b、d形成的化合物中,若为NaClO,Cl原子的价电子对为1+=4,则Cl的杂化方式是sp3;若为NaClO2,Cl原子的价电子对为2+=4,则Cl的杂化方式是sp3;同理若为NaClO3或NaClO4,Cl原子杂化方式仍为sp3,故D正确; 故答案为A。 7.下列有关说法正确的是( ) A.水合铜离子的模型如图,该微粒中存在极性共价键、配位键、离子键 B.CaF2晶体的晶胞如图,距离F-最近的Ca2+组成正四面体 C.氢原子的电子云图如图,氢原子核外大多数电子在原子核附近运动 D.金属Cu中Cu原子堆积模型如图,为面心立方最密堆积,Cu原子的配位数均为12,晶胞空间利用率68% 【答案】B 【解析】A.水合铜离子中水中的氧原子提供孤对电子与铜离子形成配位键,水中的H原子和O原子形成极性共价键,但不存在这离子键,A选项错误; B.CaF2晶体的晶胞中,F-位于体心,而Ca2+位于顶点和面心,距离F-最近的Ca2+组成正四面体,B选项正确; C.电子云密度表示电子在某一区域出现的机会的多少,H原子最外层只有一个电子,所以不存在大多数电子一说,只能说H原子的一个电子在原子核附近出现的机会多,C选项错误; D.金属Cu中Cu原子堆积模型为面心立方最密堆积,配位数为12,但空间利用率为74%,D选项错误; 答案选B。 【点睛】 本题考查了配合物、离子晶体、电子云、最密堆积等知识,解题关键是对所给图要仔细观察,并正确理解掌握基本概念。 8.用如图所示的装置进行实验,仪器、、中分别盛有试剂1、2、3,其中能达到实验目的是( ) 选项 试剂1 试剂2 试剂3 实验目的 A 浓盐酸 饱和食盐水 制备 B 浓硫酸 乙醇 溴水 验证乙烯能使溴水褪色 C 盐酸 品红试液 证明具有漂白性 D 稀硫酸 溶液 澄清石灰水 验证溶液中是否有 【答案】C 【解析】A.浓盐酸与二氧化锰反应需要加热,故A不符合题意; B.乙醇在浓硫酸、170℃的条件下可以生成乙烯,图示装置既没有酒精灯,也缺少温度计,故B不符合题意; C.盐酸酸性比亚硫酸强,所以盐酸可以与亚硫酸反应生成二氧化硫,生成的二氧化硫通入品红溶液验证二氧化硫的漂白性,故C符合题意; D.HCO3-也可以与稀硫酸反应生成CO2使澄清石灰水变浑浊,且SO2气体也可以使澄清石灰水变浑浊,故不能判断出X溶液中是否含有CO32-,故D不符合题意; 故答案为C。 9.乙醇催化氧化制取乙醛(沸点为20.8℃,能与水混溶)的装置(夹持装置已略) 如图所示。下列说法错误的是 A.①中用胶管连接其作用是平衡气压,便于液体顺利流下 B.实验过程中铜丝会出现红黑交替变化 C.实验开始时需先加热②,再通O2,然后加热③ D.实验结束时需先将④中的导管移出,再停止加热。 【答案】C 【解析】A.装置中若关闭K时向烧瓶中加入液体,会使烧瓶中压强增大,双氧水不能顺利流下,①中用胶管连接,打开K时,可以平衡气压,便于液体顺利流下,A选项正确; B.实验中Cu作催化剂,但在过渡反应中,红色的Cu会被氧化成黑色的CuO,CuO又会被还原为红色的Cu,故会出现红黑交替的现象,B选项正确; C.实验开始时应该先加热③,防止乙醇通入③时冷凝,C选项错误; D.为防止倒吸,实验结束时需先将④中的导管移出,再停止加热,D选项正确; 答案选C。 10.防治污染要坚决打好蓝天、碧水、净土三大保卫战。某工厂拟综合处理含NH4+废水和工业废气(主要含N2、CO2、SO2、NO、CO,不考虑其他成分),设计了如下流程: 下列说法正确的是( ) A.固体1的成分是CaCO3、CaSO3 B.向气体1中通入的空气需要过量 C.捕获剂所捕获的气体主要是CO D.处理含NH4+废水时,发生的反应为NH4++5NO2-+4H+=6NO↑+4H2O 【答案】C 【解析】从流程图可以看出,工业废气(主要含N2、CO2、SO2、NO、CO,不考虑其他成分)通入过量石灰乳中,CO2、SO2转化为CaCO3、CaSO3,成为固体1的主要成分;此时气体的主要成分为N2、NO、CO,通空气、再用NaOH溶液吸收,NO转化为NaNO2,用含NH4+废水处理,生成N2和水;CO气体用捕获剂处理,从而得到捕获产物。 A.由以上分析可知,固体1的成分是CaCO3、CaSO3、Ca(OH)2等,A不正确; B.向气体1中通入的空气若过量,NaNO2将被氧化为NaNO3,B不正确; C.气体2的成分为N2和CO,N2不污染环境,所以捕获剂所捕获的气体主要是CO,C正确; D.处理含NH4+废水时,发生的反应为NH4++NO2- =N2↑+2H2O,D不正确; 故选C。 一、 选择题(本题共5小题,每小题4分,共20分。每小题只有一个或两个选项符合题意,全部选对得4分,选对但不全的得2分,有选错的得0分) 11.某新型电池,以NaBH4(B的化合价为+3价)和H2O2作原料,负极材料采用Pt,正极材料采用MnO2(既作电极材料又对该极的电极反应具有催化作用),该电池可用作卫星、深水勘探等无空气环境电源,其工作原理如图所示。下列说法不正确的是( ) A.每消耗3 mol H2O2,转移6 mol e− B.电池工作时Na+从b极区移向a极区 C.a极上的电极反应式为BH+8OH−−8e−===BO+6H2O D.b极材料是MnO2,该电池总反应方程式:NaBH4+4H2O2===NaBO2+6H2O 【答案】B 【解析】由图中信息可知,NaBH4是还原剂,其在负极上被氧化为BO,电极反应式为BH+8OH−−8e−===BO+6H2O,H2O2是氧化剂,其在正极上被还原为OH−,电极反应式为4H2O2+8e−===8OH−,该电池总反应方程式为NaBH4+4H2O2===NaBO2+6H2O。所以电极a是负极、电极b是正极。每消耗3 mol H2O2,O元素的化合价从−1降到−2,故转移6 mol e−,电池工作时Na+从负极区移向正极区,由此知A、C、D项正确,B项错误。 12.雌黄(As2S3) 在我国古代常用作书写涂改修正液。浓硝酸氧化雌黄可制得硫磺,并生成砷酸和一种红棕色气体,利用此反应原理设计为原电池。下列叙述正确的是( ) A.砷酸的分子式为H2AsO4 B.红棕色气体在该原电池的负极区生成并逸出 C.该反应的氧化剂和还原剂物质的量之比为10:1 D.该反应中每析出4.8g硫磺转移1mol电子 【答案】C 【解析】A. As位于第四周期VA族,因此砷酸的分子式为H3AsO4,故A错误; B. 红棕色气体为NO2,N的化合价由+5价→+4价,根据原电池工作原理,负极上发生氧化反应,化合价升高,正极上发生还原反应,化合价降低,即NO2应在正极区生成并逸出,故B错误; C. 根据题中信息,As的化合价由+3价→+5价,S的化合价由-2价→0价,化合价都升高,即As2S3为还原剂,HNO3为氧化剂,根据得失电子数目守恒,因此有n(As2S3)×[2×(5-3)+3×2]=n(HNO3)×(5-4),因此n(HNO3):n(As2S3)=10:1,故C正确; D. 4.8g硫磺的物质的量为:=0.15mol,根据硫原子守恒n(As2S3)=0.05mol,根据C 选项分析,1molAs2S3参与反应,转移10mole-,则0.05molAs2S3作还原剂,转移电子物质的量为0.05mol×10=0.5mol,故D错误; 答案:C。 13.向某容积为2L的恒容密闭容器中充入2molX(g)和1molY(g),发生反应2X(g)+Y(g)3Z(g)。反应过程中,持续升高温度,测得混合体系中X的体积分数与温度的关系如图所示。下列推断正确的是( ) A.M点时,Y的转化率最大 B.平衡后充入X,达到新平衡时X的体积分数减小 C.升高温度,平衡常数减小 D.W、M两点Y的正反应速率相同 【答案】C 【解析】【分析】起始时向容器中充入2molX(g)和1molY(g),反应从左到右进行,结合图像,由起点至Q点,X的体积分数减小;Q点之后,随着温度升高,X的体积分数增大,意味着Q点时反应达到平衡状态,温度升高,平衡逆向移动,反应从右向左进行。 【详解】A.Q点之前,反应向右进行,Y的转化率不断增大;Q点→M点的过程中,平衡逆向移动,Y的转化率下降,因此Q点时Y的转化率最大,A项错误; B.平衡后充入X,X的体积分数增大,平衡正向移动,根据勒夏特列原理,平衡移动只能减弱而不能抵消这个改变,达到新的平衡时,X的体积分数仍比原平衡大,B项错误; C.根据以上分析,升高温度,平衡逆向移动,平衡常数减小,C项正确; D.容器体积不变,W、M两点,X的体积分数相同,Y的体积分数及浓度也相同,但M点温度更高,Y的正反应速率更快,D项错误; 答案选C。 14.已知丙烯与发生加成反应有两种可能,如图1所示;其中丙烯加的位能曲线图如图2所示。下列说法错误的是( ) A.过渡态(Ⅰ)比过渡态(Ⅱ)稳定 B.生成①的过程所需活化能较低,速率快 C.①②③④中碳原子的杂化方式相同 D.丙烯与发生加成反应,主要生成产物③ 【答案】C 【解析】A.据图可知过渡态(Ⅰ)比过渡态(Ⅱ)能量更低,所以更稳定,故A正确; B.活化能越小反应速率越快,据图可知生成①的过程所需活化能较低,反应速率较快,故B正确; C.①②中均有一个碳原子为sp2杂化,其他碳原子均为sp3杂化,故C错误; D.据图可知生成①的过程所需活化能较低,反应更容易进行,选择性更强,所以主要产物为③,故D正确; 故答案为C。 15.已知反应:CH2=CHCH3(g)+Cl2(g)CH2=CHCH2Cl(g)+HCl(g)。在一定压强下,按ω=向密闭容器中充入氯气与丙烯。图甲表示平衡时,丙烯的体积分数()与温度(T)、ω的关系,图乙表示反应的平衡常数K与温度T的关系。则下列说法正确的是( ) A.图甲中ω1>1 B.图乙中,线A表示正反应的平衡常数 C.在恒容容器中进行,压强不变时反应达到平衡状态 D.当温度为T1、ω=2时,Cl2的转化率约为33.3% 【答案】D 【解析】A.增大氯气的浓度,平衡向正反应方向移动,丙烯的体积分数减小,由图可知,丙烯的体积分数ω1大于ω2,则ω1<1,故A错误; B.由图甲可知,温度升高,丙烯的体积分数增大,说明平衡向逆反应方向移动,该反应为放热反应,升高温度,放热反应的平衡常数减小,则图乙中,线B表示正反应的平衡常数,故B错误; C.该反应是一个气体体积不变的可逆反应,无论是否达到平衡,压强始终不变,则在恒容容器中进行,压强不变时不能说明反应达到平衡状态,故C错误; D.设温度为T1、ω=2时,容器体积为1L,CH2=CHCH3的起始物质的量为1mol,消耗物质的量为xmol,由题意建立如下三段式: 由平衡常数K=1可得=1,解得x=,则Cl2的转化率为≈33.3%,故D正确; 故选D。 【点睛】 由图甲可知,温度升高,丙烯的体积分数增大,说明平衡向逆反应方向移动,该反应为放热反应,升高温度,放热反应的平衡常数减小是解答关键和易错点。 一、 解答题(共5小题,满分60分) 16.(12分)甲烷水蒸气的重整反应是工业制备氢气的重要方式,其化学反应方程式为CH4(g)+H2O(g)CO(g)+3H2(g)。回答下列问题: (1)已知CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH1=-890.3kJ·mol-1 CO(g)+O2(g)=CO2(g) ΔH2=-283.0kJ·mol-1 H2(g)+O2(g)=H2O(l) ΔH3=-285.8kJ·mol-1 CO(g)+H2O(g)=CO2(g)+H2(g) ΔH4=-41.0kJ·mol-1 则甲烷水蒸气重整反应的ΔH=_____kJ·mol-1。 (2)通过计算机模拟实验,对400~1200℃、操作压强为0.1MPa条件下,不同水碳比(1~10)进行了热力学计算,反应平衡体系中H2的物质的量分数与水碳比、平衡温度的关系如图所示。 ①温度一定时,H2的物质的量分数与水碳比(1~10)的关系是_____,产生该结论的原因是_____。 ②据模拟实验可知,平衡温度为900℃,水碳比为1.0时,H2的物质的量分数为0.6,CH4的转化率为_____,其压强平衡常数为_____;反应速率方程为v=kp(CH4)p-1(H2),此时反应速率v=_____。 (已知:气体分压=气体的物质的量分数×总压,速率方程中k为速率常数)。 (3)厌氧细菌可将葡萄糖转化为CH4和H2,pH为5.5时不同热预处理温度和时间下的甲烷和氢气的产率如图所示,若要提高H2的产率,最佳温度为_____。 【答案】(1)+206.3 (2)水碳比越大,H2的物质的量分数越大 水碳比较大时,CO会与H2O进一步反应生成H2,使H2的物质量分数增大 66.7% 4.32×10-2(Mpa)2 (3)80℃ 【解析】【分析】(1)①+④−2×②−2×③即得甲烷水蒸气的重整反应方程式,用盖斯定律求甲烷水蒸气重整反应的△H; (2)①H2的物质的量分数与水碳比(1~10)的关系由图知;原因从生成氢气的反应角度来回答; ②平衡温度为900℃,水碳比为1.0时,H2的物质的量分数为0.6,列三段式求解CH4的转化率、压强平衡常数;根据压强与气体物质的量成正比,结合三段式计算; (3)厌氧细菌可将葡萄糖转化为CH4和H2,提高H2的产率的最佳温度,由图可知。 【详解】(1)已知:①CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH1=-890.3kJ·mol-1 ②CO(g)+0.5O2(g)=CO2(g) ΔH2=-283.0kJ·mol-1 ③H2(g)+0.5O2(g)=H2O(l) ΔH3=-285.8kJ·mol-1 ④CO(g)+H2O(g)=CO2(g)+H2(g) ΔH4=-41.0kJ·mol-1 根据盖斯定律,①+④−2×②−2×③即得甲烷水蒸气的重整反应方程式为CH4(g)+H2O(g)⇌CO(g)+3H2(g),则甲烷水蒸气的重整反应△H=△H1+△H4−2△H2−2△H3=(−890.3−41+2×283.0+2×285.8)kJ⋅mol−1=+206.3 kJ⋅mol−1; (2)①平衡温度一定时,H2的物质的量分数与水碳比(1~10)的关系,由图中曲线走势可知,水碳比越大,H2的物质的量分数越大的原因,从生成氢气的反应可知,除了甲烷水蒸气的重整反应生成氢气外,一氧化碳和水也会反应产生氢气; ②操作压强为0.1MPa、平衡温度为900℃条件下,水碳比为1.0时,H2的物质的量分数为0.6,设甲烷和H2O的物质的量均为3mol,达化学平衡时,甲烷消耗xmol,则: H2的物质的量分数===0.6,解得x=2mol,转化率α(CH4)=×100%=×100%=66.67%,平衡常数K==(Mpa)2=4.32×10-2(Mpa)2;反应速率v=kp(CH4)p-1(H2)=k=k=k×=; (3)厌氧细菌可将葡萄糖转化为CH4和H2,由图可知,pH为5.5时,若要提高H2的产率,降低甲烷产率,最佳温度为80℃。 【点睛】本题关键是理解图中给出的信息,注意(2)根据“H2的物质的量分数为0.6”这一条件,可以列三段式求解CH4的转化率、压强平衡常数。 17.铁系元素是人体必需的微量元素, Fe3+可以与KSCN溶液、苯酚等发生显色作用。镁元素也是人体所必需的阳离子元素之一,它能够维持核酸结构的稳定性,调节机体免疫功能,对人体抵抗新冠病毒等病毒侵袭起着重要作用。 (1)Fe3+的基态核外电子排布式为____________________。 (2)与SCN−互为等电子体且为非极性分子的化学式为__________(任写一种)。 (3)普鲁士蓝俗称铁蓝,晶胞如图甲所示(K+未画出),平均每两个晶胞立方体中含有一个K+,又知该晶体中铁元素有+2价和+3价两种,则Fe3+与Fe2+的个数比为_________。 (4)血红素铁(图乙)用作铁强化剂,其吸收率比一般铁剂高3倍,在图乙中画出Fe2+与N原子间的化学键(若是配位键,需要用箭头加以表示)______________ (5)镁单质晶体中原子的堆积模型如图,它的堆积模型名称为____________;晶胞是图中的_________________(填a、b或c);配位数是__________________;紧邻的四个镁原子的中心连线构成的正四面体几何体的体积是2a cm3,镁单质的密度为ρ g·cm-3,已知阿伏伏德罗常数为NA,则镁的摩尔质量的计算式是________________。 【答案】(1)[Ar]3d5(或1s22s22p63s23p63d5) (2)CO2或CS2 (3)1∶1 (4) (5)六方最密堆积 c 12 12NAaρ 【解析】 (1)铁是26号元素,其原子核外有26个电子,根据构造原理其核外电子排布式为[Ar]3d64s2,则Fe3+的基态核外电子排布式为[Ar]3d5(或1s22s22p63s23p63d5); (2)SCN−中含有3个原子,且其价电子数是16,与SCN−互为等电子体的一种非极性分子的为CO2(或CS2); (3)每隔一个立方体中心有一个钾离子,所以一个晶胞中钾离子个数==0.5,该立方体中铁原子个数=8×=1,CN−位于每条棱中点,该立方体中含有CN−个数=12×=3,所以平均化学式是K0.5Fe(CN)3,Fe平均化合价2.5,所以亚铁离子与铁离子之比是1:1; (4)配位键由提供孤电子对的原子指向提供空轨道的原子,Fe2+提供空轨道,N原子提供电子对,Fe2+与N原子间的的配位键为:; (5)镁单质晶体中原子的堆积方式是按ABABABAB…的方式堆积,单质晶体中原子为六方最密堆积,配位数为12,晶胞是图中的c;紧邻的四个镁原子的中心连线构成的几何体为正四面体,正四面体的该高为晶胞的,可推知四面体的体积为整个晶胞的,而晶胞中含有的镁原子数为1+=2,则晶胞质量=2g,则ρg·cm−3=,则有Mr=12NAaρ。 18.高碘酸钾(KIO4)溶于热水,微溶于冷水和氢氧化钾溶液,可用作有机物的氧化剂。制备高碘酸钾的装置图如下(夹持和加热装置省略)。回答下列问题: (1)装置I中仪器甲的名称是___________。 (2)装置I中浓盐酸与KMnO4混合后发生反应的离子方程式是___________。 (3)装置Ⅱ中的试剂X是___________。 (4)装置Ⅲ中搅拌的目的是___________。 (5)上述装置按气流由左至右各接口顺序为___________(用字母表示)。 (6)装置连接好后,将装置Ⅲ水浴加热,通入氯气一段时间,冷却析岀高碘酸钾晶体,经过滤,洗涤,干燥等步骤得到产品。 ①写出装置Ⅲ中发生反应的化学方程式:___________。 ②洗涤时,与选用热水相比,选用冷水洗涤晶体的优点是___________。 ③上述制备的产品中含少量的KIO3,其他杂质忽略,现称取ag该产品配制成溶液,然后加入稍过量的用醋酸酸化的KI溶液,充分反应后,加入几滴淀粉溶液,然后用1.0mol·L-1Na2S2O3标准溶液滴定至终点,消耗标准溶液的平均体积为bL。 已知:KIO3+5KI+6CH3COOH===3I2+6CH3COOK+3H2O KIO4+7KI+8CH3 COOH===4I2+8CH3COOK+4H2O I2+2Na2S2O3===2NaI+N2S4O6 则该产品中KIO4的百分含量是___________(Mr(KIO3)=214,Mr(KIO4)=230,列出计算式)。 【答案】(1)圆底烧瓶 (2)16H++10Cl-+2MnO4-=2Mn2++8H2O+5Cl2↑ (3)NaOH溶液 (4)使反应混合物混合均匀,反应更充分 (5)aefcdb (6)2KOH+KIO3+Cl2KIO4+2KCl+ H2O 降低KIO4的溶解度,减少晶体损失 100% 【解析】【分析】本题为制备高碘酸钾实验题,根据所提供的装置,装置III为KIO4的制备反应发生装置,发生的反应为2KOH+KIO3+Cl2KIO4+2KCl+ H2O;装置I可用来制取氯气,为制备KIO4提供反应物氯气;装置IV是氯气的净化装置;装置II是氯气的尾气吸收装置;装置的连接顺序为I→IV→III→II,以此分析解答。 【详解】(1)根据装置I中仪器甲的构造,该仪器的名称是圆底烧瓶, 因此,本题正确答案是:圆底烧瓶; (2)浓盐酸与KMnO4反应生成氯化钾、氯化锰、氯气和水,根据得失电子守恒及电荷守恒和原子守恒写出离子方程式是2MnO4-+10Cl-+16H+=2Mn2++5Cl2↑+8H2O, 因此,本题正确答案是:2MnO4-+10Cl-+16H+=2Mn2++5Cl2↑+8H2O; (3) 装置II是氯气的尾气吸收装置,所用的试剂X应是NaOH溶液, 因此,本题正确答案是:NaOH溶液; (4) 装置III为KIO4的制备反应发生装置,用氯气和NaOH的KIO3溶液反应,搅拌的目的是使反应混合物混合均匀,反应更充分, 因此,本题正确答案是:使反应混合物混合均匀,反应更充分; (5)根据以上分析,装置的连接顺序为I→IV→III→II,所以各接口顺序为aefcdb, 因此,本题正确答案是:aefcdb; (6)①装置III为KIO4的制备反应发生装置,氯气将KIO3氧化为KIO4,本身被还原为KCl,化学方程式为2KOH+KIO3+Cl2KIO4+2KCl+ H2O, 因此,本题正确答案是:2KOH+KIO3+Cl2KIO4+2KCl+ H2O; ②根据题给信息,高碘酸钾(KIO4)溶于热水,微溶于冷水和氢氧化钾溶液,所以,与选用热水相比,选用冷水洗涤晶体的优点是降低KIO4的溶解度,减少晶体损失, 因此,本题正确答案是:降低KIO4的溶解度,减少晶体损失; ③设ag产品中含有KIO3和KIO4的物质的量分别为x、y,则根据反应关系: KIO3~~~3I2,KIO4~~~4I2,I2~~~2Na2S2O3, ①214x+230y=a,②3x+4y=0.5b,联立①、②,解得y=mol, 则该产品中KIO4的百分含量是100%=100%, 因此,本题正确答案是:100%。 19.磷酸铝(AlPO4)是一种用途广泛的材料,在建筑、耐火材料、化工等方面具有广泛的应用前景。以磷硅渣(主要成分为Ca3(PO4)2、Al2O3、SiO2和V2O5等)为原料制备磷酸铝的工艺流程如图所示: 回答下列问题: (1)酸浸液中含磷元素的主要粒子是_____(填化学式,下同),浸渣中的主要化学成分是_____。 (2)生石灰除了调节pH外,另一作用是_____。 (3)滤液中钒元素以V3O93-形式存在,V3O93-易水解为[VO3(OH)]2-,该水解反应的离子方程式为_____。 (4)碱浸时,粗磷酸铝转化为可溶性溶质,则可溶性溶质分别是_____ (填化学式)。 (5)实验测得pH、反应温度与时间对碱浸时固相中P、Al含量的影响如图所示: 则最优反应条件是_____。 (6)固相反应制备磷酸铝的方法之一是在900℃的焙烧炉内加热磷酸二氢铵与氧化铝混合物,写出该反应的化学方程式:_____。 【答案】(1)H3PO4 SiO2、CaSO4 (2)除去过量的SO42- (3)V3O93-+3H2O⇌3[VO3(OH)]2-+3H+ (4)Na[Al(OH)4]、Na3PO4 (5)pH=12、温度为80℃、时间为1h (6)Al2O3+2NH4H2PO42AlPO4+2NH3↑+3H2O 【解析】【分析】磷硅渣的主要成分为Ca3(PO4)2、Al2O3、SiO2和V2O5等,加浓硫酸分离出滤渣为SiO2、CaSO4,酸浸液中加CaO可调节pH且除去过量硫酸根离子,滤渣1为CaSO4,滤液中钒元素以V3O93-形式存在,加NaOH分离出Na2[VO3(OH)],再加NaOH时粗磷酸铝溶解生成可溶性溶质为NaAlO2、Na3PO4,由图可知,pH=12、温度为80℃、时间为1h时碱浸时固相中P、Al含量w%小,为最优反应条件,然后过滤分离出AlPO4; (1)SiO2为酸性氧化物,不与硫酸反应;CaSO4微溶于水,据此回答; (2)加浓硫酸引人过量的硫酸根离子,CaSO4微溶于水,据此回答; (3)滤液中钒元素以V3O93-形式存在,V3O93-易水解为[VO3(OH)]2−; (4)加NaOH时粗磷酸铝溶解生成可溶性溶质为NaAlO2、Na3PO4; (5)在pH、反应温度与时间对碱浸时固相中P、Al含量的影响如图中,寻找碱浸时固相中P、Al 含量w%小时就为最优反应条件; (6)加热磷酸二氢铵与氧化铝混合物生成AlPO4、NH3和H2O。 【详解】(1)酸浸中磷元素主要转化为H3PO4,该反应的化学方程式为Ca3(PO4)2+3H2SO4=3CaSO4+2H3PO4,磷硅渣的主要成分为Ca3(PO4)2、Al2O3、SiO2和V2O5等,加浓硫酸分离出滤渣为SiO2、CaSO4; (2)生石灰除了调节pH 外,另一作用是除去过量的硫酸根离子; (3)滤液中钒元素以V3O93-形式存在,V3O93-易水解为[VO3(OH)]2−,该水解反应的离子方程式为V3O93-+3H2O⇌3[VO3(OH)]2-+3H+; (4)碱浸时,粗磷酸铝转化为可溶性溶质,则可溶性溶质分别是Na[Al(OH)4]、Na3PO4; (5)由图可知,pH=12、温度为80℃、时间为1h时碱浸时固相中P、Al 含量w%小,为最优反应条件; (6)加热磷酸二氢铵与氧化铝混合物生成AlPO4、NH3和H2O,化学方程式为:Al2O3+2NH4H2PO42AlPO4+2NH3↑+3H2O. 20.有机物 A 是一种重要的化工原料,以 A为起始原料可合成药物 I(结构简式如下),其合成路线如下: 已知:①有机物 D 为芳香烃 ②RNH2++H2O 回答下列问题: (1)F 的名称是_____,B 中官能团的名称是_____。 (2)由 B→C、E+H→I 的反应类型分别是_____、_____。 (3)G 的结构简式为_____。 (4)D→F 所需的试剂和反应条件是_____。 (5)G 和 CH3CHO 反应生成 H 的化学方程式为_____。 (6)芳香化合物J是 E的同分异构体。若J 能发生银镜反应,则J 可能结构有______种(不含立体异构), 其中核磁共振氢谱有四组峰,且峰面积之比为 1:1:2:6 的结构简式为_____ 【答案】(1)对硝基甲苯 羧基 (2)取代反应 加成反应 (3) (4)浓硝酸、浓硫酸、加热 (5)+CH3CHO+H2O (6)14 【解析】【分析】A 为CH3CHO,与新制Cu(OH)2反应后生成乙酸盐,酸化后得B,B为CH3COOH,SOCl2与B发生取代反应生成C,C为CH3COCl,D为甲苯,C与D反应E,由I可以推出E为,D发生硝化反应得F,F为,F还原后生成G,G为,G与CH3CHO反应生成H,H为,E和H通过加成反应生成I。 【详解】(1)F为,名称是对硝基甲苯,B为CH3COOH,B中官能团的名称是羧基。故答案为:对硝基甲苯;羧基; (2)B为CH3COOH,SOCl2与B发生取代反应生成C,C为CH3COCl,由 B→C是取代反应、E和H通过加成反应生成I,E+H→I 的反应类型分别是加成反应。故答案为:取代反应;加成反应; (3)G 的结构简式为。故答案为:; (4)D发生硝化反应得F,D→F 所需的试剂和反应条件是浓硝酸、浓硫酸、加热。故答案为:浓硝酸、浓硫酸、加热; (5)根据信息2,G 和 CH3CHO 反应生成 H 的化学方程式为+CH3CHO+H2O。故答案为:+CH3CHO+H2O; (6)芳香化合物J是 E的同分异构体,E为,若J 能发生银镜反应,说明J中含有醛基,若含有2个甲基,一个醛基,邻二甲苯、间二甲苯、对二甲苯再加一个醛基分别有2种、3种、1种;若为一个甲基,一个-CH2CHO,有邻间对3种;若为一个乙基、一个醛基,有邻间对3种;若只有一个取代基,则形成2-苯基丙醛、3-苯基丙醛2种同分异构,则J 可能结构有14种(不含立体异构), 其中核磁共振氢谱有四组峰,且峰面积之比为 1:1:2:6 的结构简式为;故答案为:。查看更多