- 2021-04-22 发布 |
- 37.5 KB |
- 8页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2018-2019学年海南省海口市第四中学高一上学期期末考试化学试卷
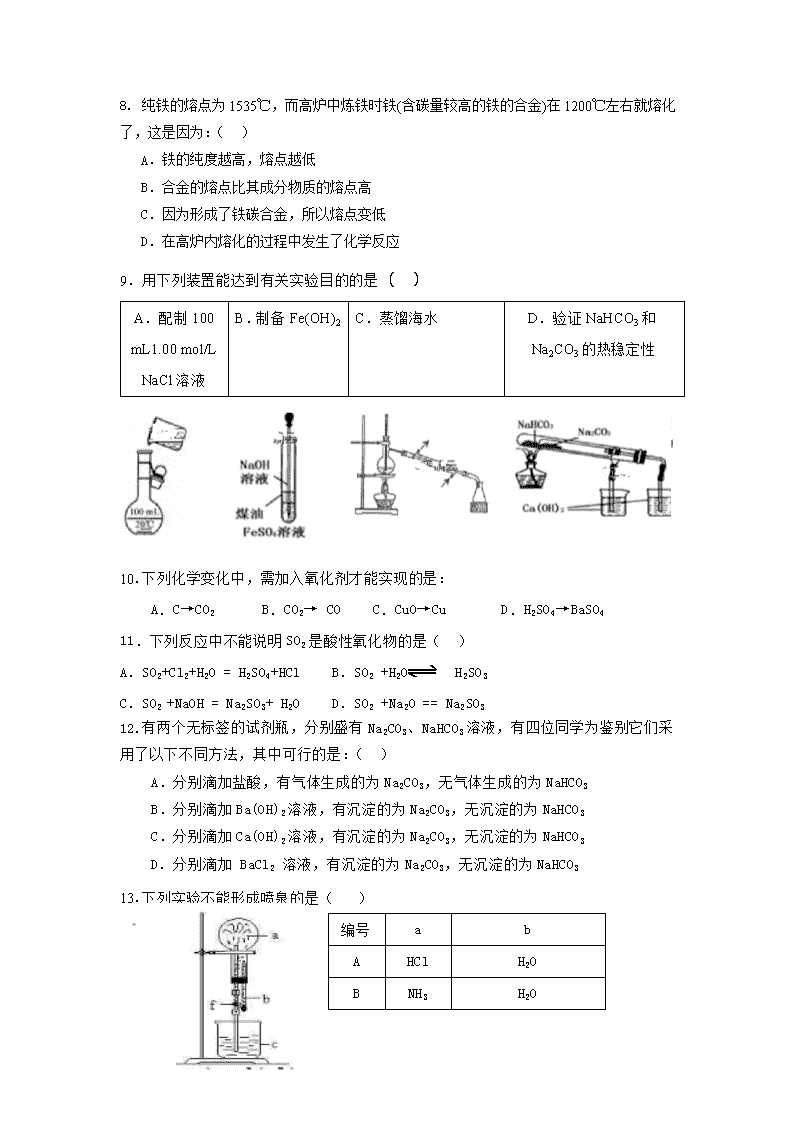
2018-2019学年海南省海口市第四中学高一上学期期末考试化学试卷 1、本试卷分选择题和非选择题两部分,共6页,满分100分。考试时间90分钟。 2、答案全部答于答题卷上 可能用到的相对原子质量: H:1 O:16 Na:23 Cu:64 Fe:56 Cl:35.5 第Ⅰ卷(选择题 共48分) 一.选择题 (本题包括16小题,每小题3分,共48分。每小题只有一个正确选项) 1.化学与环境密切相关,下列物质中能引起酸雨污染的是( ) A.CO2 B.可吸入颗粒物 C.N2 D. SO2 2.下列实验装置一般不用于分离物质的是( ) 3. 下列气体不能用排空气法收集的是( ) A.NH3 B.NO C.O2 D.NO2 4.配制一定物质的量浓度的NaOH溶液时,造成实验结果偏高的是( ) A.定容时仰视刻度线 B.容量瓶中原来有少量蒸馏水 C.未洗涤烧杯和玻璃棒 D.将NaOH溶液转移到容量瓶之前没有将溶液冷却 5.在碱性溶液中能大量共存且溶液为无色透明的离子组是:( ) A. K+、MnO4-、Cu2+、Cl- B. K+、Na+、NO3-、CO32- C. Fe2+、H+、NO3-、SO42- D.Mg2+、Na+、Cl-、SO42- 6.要想证明某溶液中含有Fe3+,下列操作中正确的是:( ) A.加入铁粉 B.滴入KSCN溶液 C.通入氯气 D.加入铜片 7.以NA表示阿伏伽德罗常数,下列叙述中正确的是( ) A.标准状况下,2.24 L H2O含有的分子数为0.1 NA B.标准状况下,2.24 L CH4与18g H2O所含有的电子数均为10 NA C.1mol Na2O2和水完全反应,转移电子数为2 NA D.标准状况下,22.4 L CO2和O2混合气体中含有的氧原子数为2NA 8. 纯铁的熔点为1535℃,而高炉中炼铁时铁(含碳量较高的铁的合金)在1200℃左右就熔化了,这是因为:( ) A.铁的纯度越高,熔点越低 B.合金的熔点比其成分物质的熔点高 C.因为形成了铁碳合金,所以熔点变低 D.在高炉内熔化的过程中发生了化学反应 9.用下列装置能达到有关实验目的的是( ) A.配制100 mL1.00 mol/L NaCl溶液 B.制备Fe(OH)2 C.蒸馏海水 D.验证NaHCO3和Na2CO3的热稳定性 10.下列化学变化中,需加入氧化剂才能实现的是: A.C→CO2 B.CO2→ CO C.CuO→Cu D.H2SO4→BaSO4 11.下列反应中不能说明SO2是酸性氧化物的是( ) A.SO2+Cl2+H2O = H2SO4+HCl B.SO2 +H2O H2SO3 C.SO2 +NaOH = Na2SO3+ H2O D.SO2 +Na2O == Na2SO3 12.有两个无标签的试剂瓶,分别盛有Na2CO3、NaHCO3溶液,有四位同学为鉴别它们采用了以下不同方法,其中可行的是:( ) A.分别滴加盐酸,有气体生成的为Na2CO3,无气体生成的为NaHCO3 B.分别滴加Ba(OH)2溶液,有沉淀的为Na2CO3,无沉淀的为NaHCO3 C.分别滴加Ca(OH)2溶液,有沉淀的为Na2CO3,无沉淀的为NaHCO3 D.分别滴加 BaCl2 溶液,有沉淀的为Na2CO3,无沉淀的为NaHCO3 13.下列实验不能形成喷泉的是( ) 编号 a b A HCl H2O B NH3 H2O C CO2 H2O D SO2 NaOH溶液 14.下列离子方程式中,正确的是:( ) A. 将少量铜屑放入浓硝酸中: Cu+ 4H+ + 2NO3- ==Cu2+ + 2NO2 ↑+ 2H2O B. 将稀硫酸滴在铜片上: Cu + 2H+ == Cu2+ + H2 ↑ C. 硫酸铜溶液与氢氧化钡混合: Cu2+ + 2OH- == Cu(OH)2↓ D. 氯化铁溶液与铜反应: Cu + Fe3+ == Fe2+ + Cu2+ 15.类推思想在化学学习与研究中经常被采用,但类推出的结论是否正确最终要经过实验的验证。以下类推的结论中正确的是( ) A.SO2能使酸性KMnO4溶液褪色,故CO2也能使酸性KMnO4溶液褪色 B.盐酸与镁反应生成氢气,故硝酸与镁反应也生成氢气 C.SO2能使品红溶液褪色,故CO2也能使品红溶液褪色 D.常温下浓硫酸能使铁和铝钝化,故常温下浓硝酸也能使铁和铝钝化 16.根据下列反应:(1)2Fe3++2I-= 2Fe2++I2 ⑵Cl2+2Fe2+=2Cl- +2Fe3+,判断离子的还原性由强到弱的顺序是: ( ) A.Cl- > I- >Fe2+ B.I- > Fe2+ >Cl- C.Fe2+ > I- >Cl- D.Cl- > Fe2+ > I- 第Ⅱ卷(非选择题 共52分) 二.填空题 17. (每空2分,共4分)用编号回答下列问题 (1)下列物质中:①NaCl晶体②氨水③铜④蔗糖⑤乙醇⑥熔融的KNO3 ⑦液氧⑧HCl,其中属于电解质的是: (2) 当光束通过下列分散系:①有尘埃的空气 ②稀硫酸 ③食盐溶液 ④Fe(OH)3胶体,能观察到丁达尔效应的是: 18.(每空1分,共4分)有 4.6g的钠跟水溶液恰好完全反应得到200 mL溶液,求: (1) 钠的物质的量为________mol; (2)生成的气体在标况下的体积为_________L; (3)所得溶液的物质的量浓度为_________mol/L; (4)反应中转移的电子数为_____________NA 。 19.(每空2分,共6分)写出下列相关的方程式 (1)在FeCl3溶液中加入足量Fe粉,写出反应的离子反应方程式:________________________。 (2)把Fe3+ + 3OH- = Fe(OH)3↓改写为化学方程式:______________________________。 (3)把AgNO3 + NaCl =AgCl↓ + NaNO3改为离子方程式:________________________。 20. (方程式2分,其他每空1分,共7分) (1)如右图所示,将氯气依次通过盛有干燥有色布条的广口瓶和盛有潮湿有色布条的广口瓶,可观察到的现象: B瓶 A瓶 A瓶中有色布条 ;B瓶中有色布条 。 (2)为防止氯气尾气污染空气,根据氯水显酸性的性质, 可用 溶液吸收多余的氯气,原理是(用化学方程式表示)_________________________________。 (3)根据以上原理,工业上常用廉价的Ca(OH)2吸收工业氯气尾气制得漂白粉,漂白粉的有效成分是__________(填化学式),长期露置于空气中的漂白粉,加稀盐酸后产生的气体是__________ _(用字母代号填)。 A.O2 B.Cl2 C.CO2 D.HClO 21.(第(2)小题的第3空1分,其他每空2分,共11分) 化学课上,围绕硫的化合物性质进行如下探究,请根据要求回答以下问题. 装置A中反应的化学方程式为 . 若有3.2克铜发生反应,则被还原的硫酸的物质的量是 ______ mol. 装置B用来探究的漂白性,则应装的试剂是 ______ ,反应一段时间后,看到的现象是 ______ ;若将通入B中也能看到同样的现象,则二者在反应原理上 ______ 填“相同”或“不相同”. 装置C检验具有 ______ 性填“氧化”或“还原”) 22.黑色固体 X粉末,加热 气体B (共8分) H2SO4 物质有以下转化关系: CO2 固体C 淡黄色 粉末A 蓝色沉淀 澄清石灰水 ① 白色沉淀 无色溶液 蓝色溶液 ② 根据上图和实验现象,回答下列问题:(用化学式表示) (1)A是________,B是________, C是________,X粉末是________。(每空1分) (2)写出反应①的化学方程式___________________________________________(2分) (3)写出反应②的离子方程式 ___________________________________________(2分) 23.(每空2分,共12分)实验室制备NH3 (1)实验室用NH4Cl和某固体药品混合加热制取NH3,写出相应的化学方程式: (2)根据上述原理选择NH3的发生装置为 (填相应字母) C (3)选择NH3的收集装置为 (填相应字母) A B C (4)为检验NH3是否收集满了,其操作步骤为: (5)收集NH3时,常在瓶口放置蘸有 药品的一团棉花来进行尾气处理(填相应字母)。 A. Ca(OH)2溶液 B. NaOH溶液 C.浓盐酸 D.稀硫酸 (6)氨被催化氧化生成一氧化氮的化学方程式 。 海口四中2018-2019学年度第一学期 高一化学期末测试题答案 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 D D B D B B D C B A A D C A D B 17. (每空2分,共4分) (1)①⑥⑧ (2)①④ 18. (每空1分,共4分) (1) 0.2mol; (2) 2.24 L; (3)1 mol/L; (4) 0.2 NA 。 19. (每空2分,共6分) (1)2 Fe3+ +Fe == 3Fe2+ (2)FeCl3 + NaOH == Fe(OH)3 ↓+ 3NaCl (合理都对) (3)Ag+ +Cl- == AgCl↓ 20. (方程式2分,其他每空1分,共7分) (1)无变化(不褪色); 褪色。 (2)NaOH(合理均对,用碱液吸收) Cl2 +2NaOH == NaCl + NaClO + H2O (3) Ca(ClO)2 , 选择 C 21. (第(2)小题的第3空1分,其他每空2分,共11分) (1)浓;0.05 (2) 品红溶液;品红溶液褪色;不相同; (3) 还原; 22. (共8分) (1)Na2O2 ,O2 ,Na2CO3 , Cu (每空1分) (2)2Na2O2 + 2CO2 == 2Na2CO3+O2 (2分) (3) Cu2+ + 2OH- == Cu(OH)2 ↓ (2分) 23.(每空2分,共12分) (1) 2NH4Cl+Ca(OH)2==△== CaCl2+2NH3↑+2H2O (2)A (3)A (4)将湿润的红色石蕊试纸放在瓶口,若试纸变蓝,则证明已经收集满。 或用蘸有浓盐酸的玻璃棒靠近瓶口,若出现大量白烟,则证明已经收集满 (5)D 催化剂 (6) △ 4NH3 + 5O2 ====== 4NO + 6H2O 查看更多