- 2021-04-22 发布 |
- 37.5 KB |
- 8页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2020年高一化学人教版必修1练习 (12)
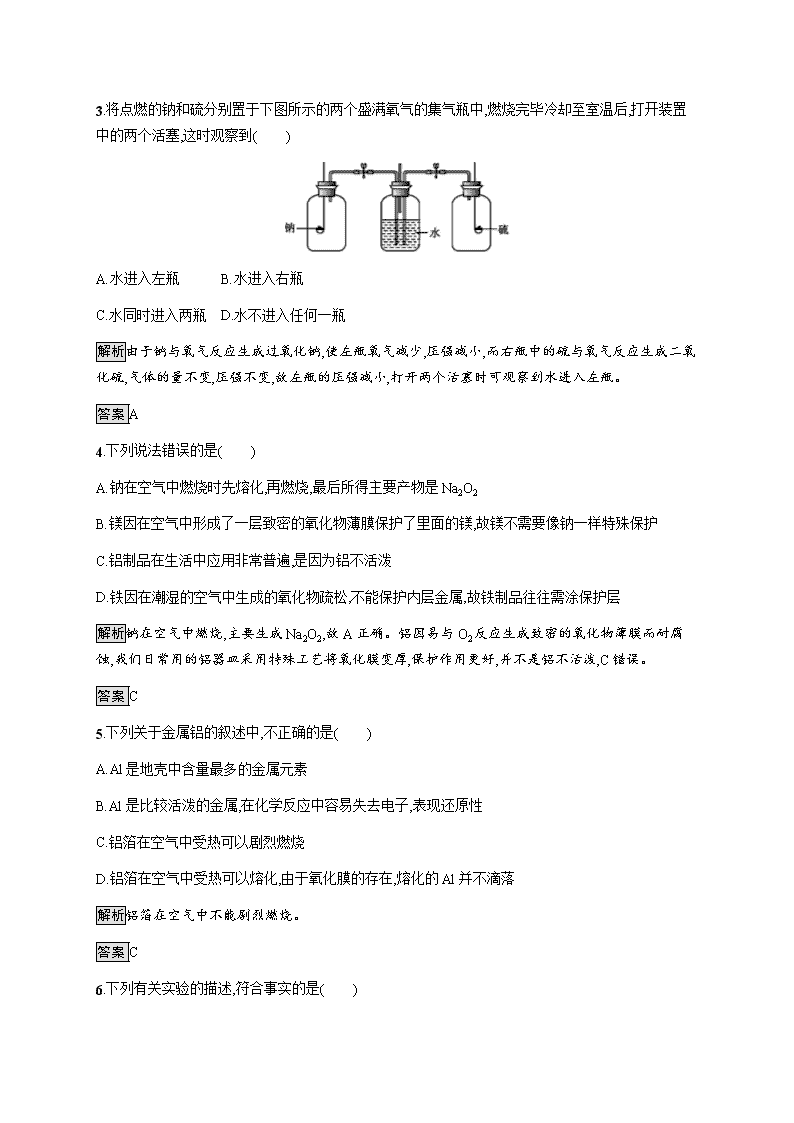
第三章金属及其化合物 第一节 金属的化学性质 第1课时 金属与非金属的反应 课后篇巩固提升 基础巩固 1.镁、铝能够在空气中稳定存在的原因是( ) A.性质不活泼,不与空气中的成分反应 B.镁、铝与氧气的反应速率极慢 C.经过了特殊的工艺处理 D.与氧气反应形成了氧化物保护膜 解析镁、铝均与O2反应生成致密的氧化物保护膜。 答案D 2.下面关于金属钠的描述正确的是( ) A.钠的化学性质很活泼,在自然界里不能以游离态存在 B.钠离子具有较强的还原性 C.钠很软,在新材料领域没有用途 D.钠露置于空气中最后变为Na2O 解析钠的化学性质活泼,能与空气中的氧气等物质反应,在自然界中只能以化合态形式存在,A项正确;钠离子不能再失去电子,不具有还原性,B项错误;钠很软、熔点低,导电、导热性好,可用于新光源、原子反应堆导热剂等,C项错误;钠露置于空气中会发生一系列反应,最后变为Na2CO3,D项错误。 答案A 3.将点燃的钠和硫分别置于下图所示的两个盛满氧气的集气瓶中,燃烧完毕冷却至室温后,打开装置中的两个活塞,这时观察到( ) A.水进入左瓶 B.水进入右瓶 C.水同时进入两瓶 D.水不进入任何一瓶 解析由于钠与氧气反应生成过氧化钠,使左瓶氧气减少,压强减小,而右瓶中的硫与氧气反应生成二氧化硫,气体的量不变,压强不变,故左瓶的压强减小,打开两个活塞时可观察到水进入左瓶。 答案A 4.下列说法错误的是( ) A.钠在空气中燃烧时先熔化,再燃烧,最后所得主要产物是Na2O2 B.镁因在空气中形成了一层致密的氧化物薄膜保护了里面的镁,故镁不需要像钠一样特殊保护 C.铝制品在生活中应用非常普遍,是因为铝不活泼 D.铁因在潮湿的空气中生成的氧化物疏松,不能保护内层金属,故铁制品往往需涂保护层 解析钠在空气中燃烧,主要生成Na2O2,故A正确。铝因易与O2反应生成致密的氧化物薄膜而耐腐蚀,我们日常用的铝器皿采用特殊工艺将氧化膜变厚,保护作用更好,并不是铝不活泼,C错误。 答案C 5.下列关于金属铝的叙述中,不正确的是( ) A.Al是地壳中含量最多的金属元素 B.Al是比较活泼的金属,在化学反应中容易失去电子,表现还原性 C.铝箔在空气中受热可以剧烈燃烧 D.铝箔在空气中受热可以熔化,由于氧化膜的存在,熔化的Al并不滴落 解析铝箔在空气中不能剧烈燃烧。 答案C 6.下列有关实验的描述,符合事实的是( ) A.金属钠暴露在空气里,表面变暗,生成白色的氧化钠固体 B.用坩埚钳夹住打磨过的镁带,在酒精灯上点燃,发出耀眼的白光,放出大量的热,产生白色粉末 C.用坩埚钳夹住一小块铁片在酒精灯上点燃,火星四射,放出大量的热 D.用坩埚钳夹住一小块打磨过的铝箔,在酒精灯上加热至熔化,有液态的铝滴落下来 解析用坩埚钳夹住打磨过的镁带,在酒精灯上点燃,产生的是白色固体氧化镁,而不是白色粉末,B项错误;铁不能在空气中燃烧,C项错误;加热铝箔,因为Al2O3的熔点比Al的高,熔化的铝并不会滴落下来,D项错误。 答案A 7.4.6 g金属钠在一定条件下与氧气反应后,得到7.0 g固体,由此可判断其氧化产物是( ) A.只有Na2O B.只有Na2O2 C.Na2O2和Na2O D.无法确定 解析此题可用极限法巧解。若4.6 g金属钠完全被氧化为Na2O2,质量应为7.8 g;若完全生成Na2O,则质量应为6.2 g,由此可知氧化产物应为Na2O2和Na2O的混合物。 答案C 8.把铝箔放在盐酸中除去表面的氧化膜,所发生反应的化学方程式为 ,把除去氧化膜的铝箔迅速放到酒精灯火焰上加热,看到的现象是 ,原因是 ,所发生的反应是 。 解析铝箔表面的氧化膜为Al2O3,它可以和酸反应生成盐和水;把除去氧化膜的铝箔迅速放到酒精灯火焰上加热时,其表面已生成致密的氧化膜,它阻碍了氧气和铝的进一步反应,并且它的熔点很高,难以熔化。 答案Al2O3+6HCl2AlCl3+3H2O 铝箔形成液滴却不滴落 生成的Al2O3薄膜阻止了Al和O2的进一步反应,且Al2O3的熔点高于Al的熔点,故使内层熔化的Al无法滴落 4Al+3O22Al2O3 9.根据你对金属钠性质的了解,回答下列问题。 (1)下列关于钠的叙述中,正确的是 。 A.钠是银白色金属,硬度很大 B.将金属钠放在石棉网上,用酒精灯加热后金属钠剧烈燃烧,发出黄色火焰,生成过氧化钠 C.金属钠在空气中燃烧,生成氧化钠 D.金属钠的熔点很高 (2)由于金属钠很容易与空气中的 等物质反应,通常将它保存在 里,以使它与 等隔绝。 解析通过外观、金属的通性以及钠与水反应的实验现象可知,钠的物理性质有:银白色、密度小、熔沸点低、质软、导电、导热等,作为活泼的金属,钠易与O2、水等发生化学反应。 (1)A选项中有关钠硬度的描述不正确;C选项中有关钠在空气中燃烧的产物说法有误;D选项中有关金属钠熔点的描述不符合事实。只有B项正确。 (2)由于金属钠很活泼,很容易与空气中的氧气、水蒸气等物质反应,因此保存时应隔绝空气,通常保存在煤油里,这是因为钠的密度大于煤油的密度且钠与煤油不反应,钠在煤油中沉在底部而避免了与空气的接触。 答案(1)B (2)氧气 煤油 氧气 能力提升 1.某同学将金属钠露置于空气中,观察到下列现象:银白色变灰暗变白色出现液滴白色晶体白色粉末,根据钠及其化合物的性质分析,下列说法正确的是( ) A.①发生了氧化还原反应 B.变灰暗是因为生成了过氧化钠 C.③是碳酸钠吸收空气中的水蒸气形成了溶液 D.④⑤只发生物理变化 解析钠露置在空气中由银白色变灰暗,是因为Na与O2反应生成了Na2O,Na2O与H2O反应生成白色固体NaOH,NaOH易潮解,吸收空气中的H2O形成NaOH溶液而出现液滴,同时吸收空气中的CO2生成Na2CO3·10H2O,Na2CO3·10H2O逐渐风化最后变为Na2CO3粉末。其中①发生了氧化还原反应,A正确;Na只有在加热或点燃时才能生成Na2O2,B错误;③是NaOH潮解,C错误;④⑤中发生的反应有2NaOH+CO2Na2CO3+H2O,Na2CO3+10H2ONa2CO3·10H2O及Na2CO3·10H2ONa2CO3+10H2O,D错误。 答案A 2.近年来,科学家正在探索利用铝粉作燃料的可能性,以期铝能成为石油的一种取代物。假如铝作为一种普遍使用的新型能源被开发利用,下列关于其有利因素的说法中,你认为不正确的是( ) A.铝质轻,便于运输、贮存,且安全 B.铝燃烧时放出的热量多,且燃烧后的产物对环境的污染容易得到有效控制 C.在地球上,铝矿资源丰富 D.现代电冶铝的工业技术已为铝作为新能源奠定了重要基础 解析铝质轻,燃烧时放热多,在地壳中是含量最大的金属元素,铝矿资源丰富,这些都是用铝作为新型燃料的有利条件。但是电冶铝本身需要消耗大量的能量,从这一点考虑,如果没有开发出新的冶炼金属铝的技术,那么用铝作为新能源的做法是不合算的。 答案D 3.等质量的两块钠,第一块在加热下与足量氧气充分反应,第二块在常温下与足量氧气充分反应。则下列说法正确的是( ) A.第一块钠失去电子数多 B.两块钠失去电子数相同 C.两块钠的反应产物的颜色相同 D.两块钠所得反应产物的质量相等 解析Na与O2在不同条件下发生的反应分别为2Na+O2Na2O2,4Na+O22Na2O,等质量的Na无论生成Na2O2还是生成Na2O,Na的化合价都是由0价变为+1价,其失去电子数相同,A错误,B正确;Na2O2为淡黄色,Na2O为白色,两者颜色不同,C错误;等质量的Na生成Na2O2和Na2O的物质的量相同,因Na2O2摩尔质量大于Na2O的摩尔质量,故生成Na2O2的质量大,D错误。 答案B 4.若m g Na在足量氯气中燃烧,生成固体的质量为(m+3.55) g,则m g Na与氧气反应,生成固体的质量可能为( ) ①(m+0.8) g ②(m+1.0) g ③(m+1.2) g ④(m+1.6) g ⑤(m+1.4) g A.①④ B.①⑤ C.③④ D.①②③④⑤ 解析由题可知,Na的质量为2.3 g,物质的量为0.1 mol,与O2反应可能生成(m+0.8) g Na2O,也可能生成(m+1.6) g Na2O2,也可以既生成Na2O,又生成Na2O2,质量在(m+0.8) g与(m+1.6) g之间。 答案D 5.(1)用金属钠制取过氧化钠的化学方程式为 ,现象是 。 (2)指出下列各物质中氧元素的化合价: Na2O2: ;Na2O: 。 (3)已知用金属钠生成氧化钠,可有多种方法(反应条件省略): ①4Na+O22Na2O; ②4Na+CO22Na2O+C; ③2NaNO2+6Na4Na2O+N2↑。 在上述三种方法中最好的方法是 (填序号),原因是 。 解析解答第(3)问时,如果只简单考虑,当然是钠直接与氧气反应最好,但实际上钠与氧气反应时,生成的Na2O容易被空气中的氧气氧化生成Na2O2,产物含有杂质,故方法①不好。而方法②首先是产物中含有碳杂质,且生成的Na2O会与CO2反应生成Na2CO3,故此法也不好。最好的方法是方法③,产物纯度高,且不易变质。 答案(1)2Na+O2Na2O2 产生黄色火焰,生成淡黄色固体 (2)-1价 -2价 (3)③ 此反应产物中只有Na2O是固体,而且另一产物N2可以把周围环境中的氧气排净,使得Na2O不被氧化成Na2O2 6.A、B、C是中学化学中常见的三种物质,它们之间的相互转化关系如下(部分反应条件及产物略去): (1)若A是一种金属,C是淡黄色固体,则B的化学式为 ,A→C反应的化学方程式为 。 (2)若A是一种非金属,其常见单质为黑色固体,C是最主要的温室气体,则C的分子式为 ,B→C反应的化学方程式为 。A与C能否发生反应? ,若能,写出反应的化学方程式,若不能,此空不填 。 解析(1)根据C是淡黄色固体,则C为Na2O2,B为Na2O、A为Na,A→C的反应为2Na+O2Na2O2。 (2)C是主要的温室气体,则C为CO2,A为C(碳单质),B为CO,B→C的反应为2CO+O22CO2,A和C可以反应生成B,化学方程式为C+CO22CO。 答案(1)Na2O 2Na+O2Na2O2 (2)CO2 2CO+O22CO2 能 C+CO22CO 7.(1)如图所示装置,在平底烧瓶的底部有一块钠,平底烧瓶内是干燥的空气。过一段时间后可观察到 ,发生反应的化学方程式为 。 (2)某班同学用如右图所示装置测定空气中氧气的含量。 先用弹簧夹夹住橡胶管。点燃钠,伸入瓶中并塞上瓶塞。待钠熄灭并冷却后,打开弹簧夹,观察广口瓶内水面变化情况。 ①上述实验过程中发生反应的化学方程式为 。 ②实验完毕,甲同学的广口瓶内水面上升明显小于瓶内原空气体积的,乙同学的广口瓶内水面上升明显大于瓶内空气体积的。下列对这两种现象解释合理的是 。 A.甲同学可能使用钠的量不足,瓶内氧气没有消耗完 B.甲同学可能未塞紧瓶塞,钠熄灭冷却时外界空气进入瓶内 C.乙同学可能没夹紧弹簧夹,钠燃烧时瓶内部分空气受热从导管逸出 D.乙同学可能插入燃烧匙太慢,塞紧瓶塞之前,瓶内部分空气受热逸出 解析(1)钠与空气中的氧气反应生成Na2O,使钠表面变灰暗,同时烧瓶内压强降低,气球会膨胀。 (2)A项,若钠的量不足,则氧气消耗不完,造成进水量少于容器中原气体体积的,结果偏低,合理。B项,若瓶塞未塞紧,钠熄灭冷却,瓶内气体收缩,外面的空气会进入瓶内,使气体得到补充,造成结果偏低,合理。C项,若弹簧夹未夹紧,钠燃烧时,瓶内气体膨胀,使部分气体从导管口逸出,造成结果偏高,合理。D项,若插入燃烧匙太慢,钠燃烧时,瓶内气体膨胀,在塞紧瓶塞前,瓶内部分气体从瓶口逸出,造成结果偏高,合理。 答案(1)钠表面变灰暗,气球膨胀 4Na+O22Na2O (2)①2Na+O2Na2O2 ②ABCD查看更多