- 2021-04-22 发布 |
- 37.5 KB |
- 6页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2019届二轮复习化学平衡常数、平衡转化率的计算作业(全国通用)
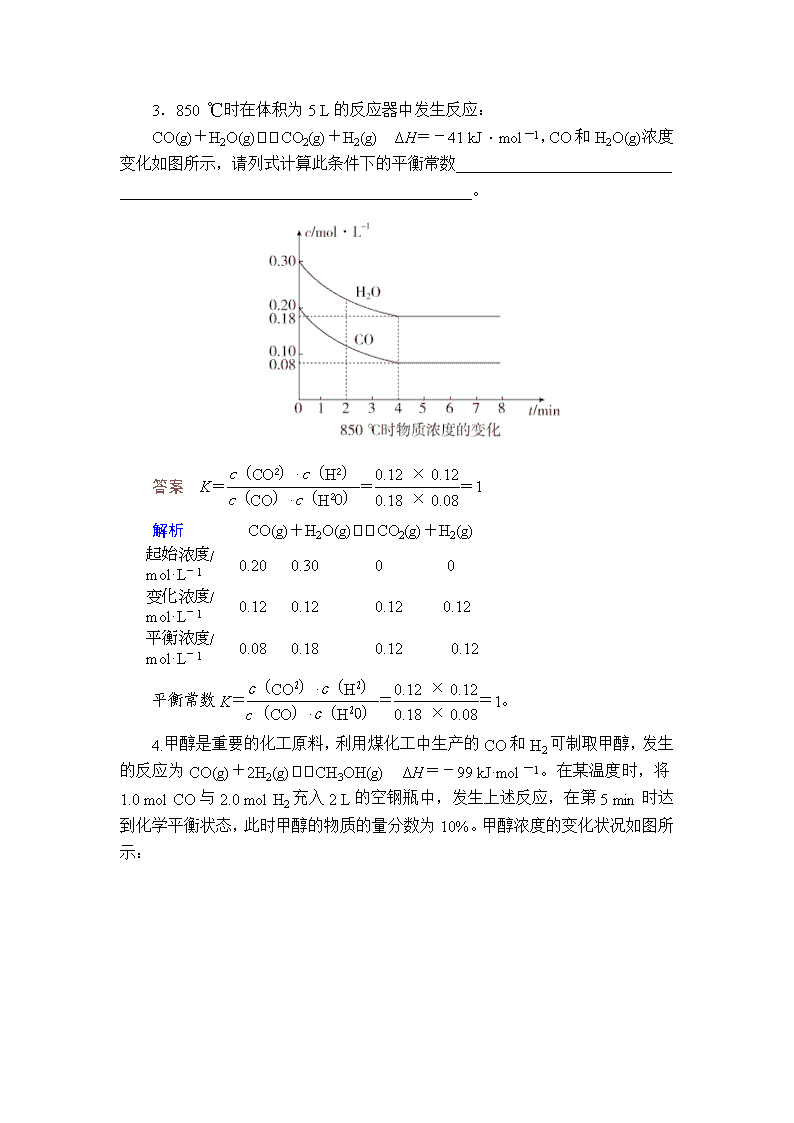
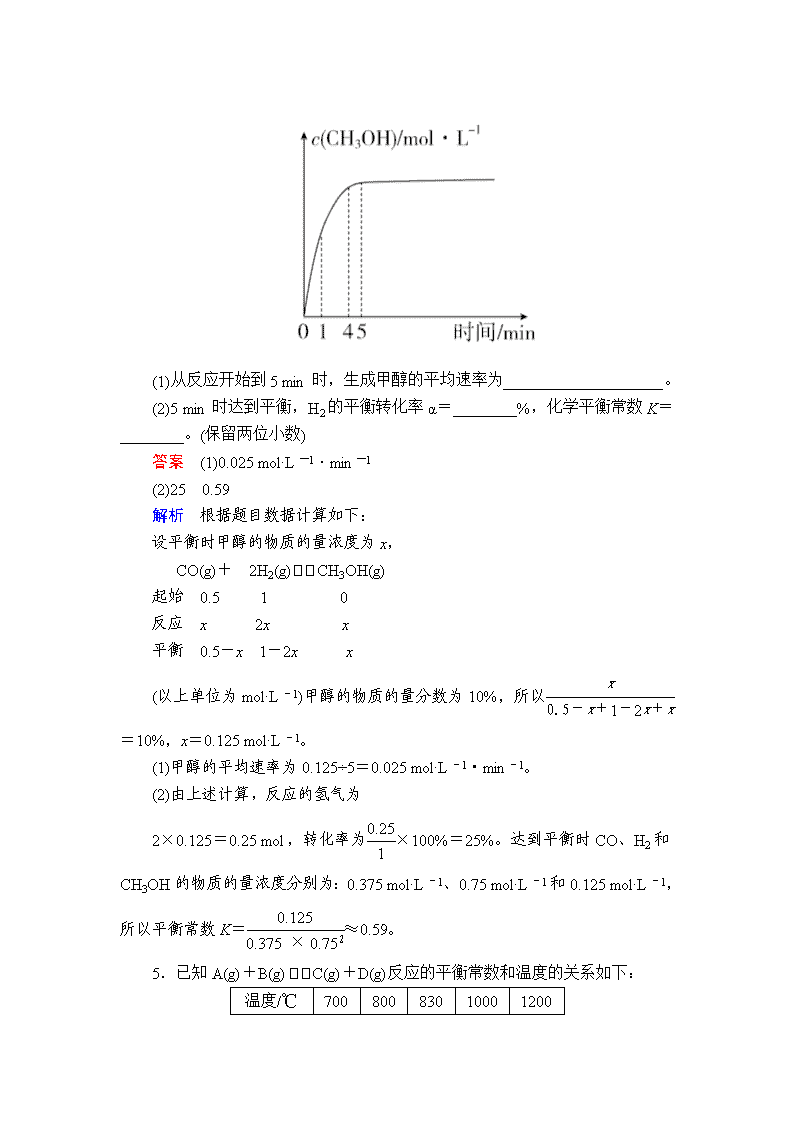
热点 3 化学平衡常数、平衡转化率的计算 1.CuCl2 溶液中的铜主要以 Cu(H2O)2+ 4 、CuCl 2- 4 形式存在,将 CuCl2 溶于浓 盐酸中,存在下列平衡:Cu(H2O)2+ 4 (aq)+4Cl-(aq) CuCl2- 4 (aq)+4H2O(l) ΔH <0。 (1)该反应的平衡常数表达式为_______________________。 (2)常温下,测定平衡体系中:Cu(H2O)2+ 4 浓度为 a mol·L-1、Cl-浓度为 b mol·L -1、CuCl 2- 4 浓度为 c mol·L-1,Cl-的转化率为____________(用含 a、b、c 的字 母表示)。 答案 (1) c(CuCl2- 4 ) c4(Cl-)·c[Cu(H2O)2+ 4 ] (2) 4c b+4c 解析 (2)已知 Cu(H2O)2+ 4 (aq)+4Cl-(aq) CuCl2- 4 (aq)+4H2O(l)平衡体系 中:Cu(H2O)2+ 4 浓度为 a mol·L-1、Cl-浓度为 b mol·L-1、CuCl 2- 4 浓度为 c mol·L -1,则 Cl-变化的浓度为 4c mol·L-1,Cl-起始的浓度为(b+4c) mol·L-1,Cl-的 转化率为 4c b+4c 。 2.T 温度时,向 10 L 恒容密闭容器中充入 2 mol NO 和 2 mol CO 发生反应 2NO(g)+2CO(g) N2(g)+2CO2(g)ΔH=-746.5 kJ·mol-1 5 min 时达到平衡,测得 0~5 min 内该反应速率 v(N2)=0.016 mol·L-1·min -1。 (1)T 温度时,该反应的平衡常数 K=________。 (2)平衡时容器内压强与起始时容器内压强之比为________。 答案 (1)800 (2)4∶5 解析 (1)T 温度时,0~5 min 内该反应速率 v(N2)=0.016 mol·L-1·min-1, 则平衡时 c(N2)=0.016 mol·L-1·min-1×5 min=0.08 mol·L-1,根据方程式 2NO(g) +2CO(g) N2(g)+2CO2(g),平衡时 c(CO2)=0.16 mol·L-1,c(CO)=0.04 mol·L -1,c(NO)=0.04 mol·L-1,该反应的平衡常数 K= 0.162×0.08 0.042×0.042 =800。 (2)平衡时容器内压强与起始时容器内压强之比等于物质的量之比= (0.16+0.08+0.04+0.04)×10 2+2 =4 5 。 3.850 ℃时在体积为 5 L 的反应器中发生反应: CO(g)+H2O(g) CO2(g)+H2(g) ΔH=-41 kJ·mol-1,CO 和 H2O(g)浓 度 变 化 如 图 所 示 , 请 列 式 计 算 此 条 件 下 的 平 衡 常 数 ___________________________ ____________________________________________。 答案 K= c(CO2)·c(H2) c(CO)·c(H2O) =0.12×0.12 0.18×0.08 =1 解析 CO(g)+H2O(g) CO2(g)+H2(g) 起始浓度/ mol·L-1 0.20 0.30 0 0 变化浓度/ mol·L-1 0.12 0.12 0.12 0.12 平衡浓度/ mol·L-1 0.08 0.18 0.12 0.12 平衡常数 K= c(CO2)·c(H2) c(CO)·c(H2O) =0.12×0.12 0.18×0.08 =1。 4.甲醇是重要的化工原料,利用煤化工中生产的 CO 和 H2 可制取甲醇,发生 的反应为 CO(g)+2H2(g) CH3OH(g) ΔH=-99 kJ·mol-1。在某温度时,将 1.0 mol CO 与 2.0 mol H2 充入 2 L 的空钢瓶中,发生上述反应,在第 5 min 时达 到化学平衡状态,此时甲醇的物质的量分数为 10%。甲醇浓度的变化状况如图所 示: (1)从反应开始到 5 min 时,生成甲醇的平均速率为____________________。 (2)5 min 时达到平衡,H2 的平衡转化率α=________%,化学平衡常数 K= ________。(保留两位小数) 答案 (1)0.025 mol·L-1·min-1 (2)25 0.59 解析 根据题目数据计算如下: 设平衡时甲醇的物质的量浓度为 x, CO(g)+ 2H2(g) CH3OH(g) 起始 0.5 1 0 反应 x 2x x 平衡 0.5-x 1-2x x (以上单位为 mol·L-1)甲醇的物质的量分数为 10%,所以 x 0.5-x+1-2x+x = 10%,x=0.125 mol·L-1。 (1)甲醇的平均速率为 0.125÷5=0.025 mol·L-1·min-1。 (2)由上述计算,反应的氢气为 2×0.125=0.25 mol,转化率为0.25 1 ×100%=25%。达到平衡时 CO、H2 和 CH3OH 的物质的量浓度分别为:0.375 mol·L-1、0.75 mol·L-1 和 0.125 mol·L-1, 所以平衡常数 K= 0.125 0.375×0.752 ≈0.59。 5.已知 A(g)+B(g) C(g)+D(g)反应的平衡常数和温度的关系如下: 温度/℃ 700 800 830 1000 1200 平衡常数 1.7 1.1 1.0 0.6 0.4 回答下列问题: (1)该反应的平衡常数表达式 K=________,ΔH________0。(填“<”“>” 或“=”) (2)830 ℃时,向一个 5 L 的密闭容器中充入 0.20 mol 的 A 和 0.80 mol 的 B, 如反应初始 6 s 内 A 的平均反应速率 v(A)=0.003 mol·L-1·s-1,则 6 s 时 c(A)= ________mol·L-1,C 的物质的量为________mol;反应经过一段时间,达到平 衡时 A 的转化率为________,如果这时向该密闭容器中再充入 1 mol 氩气,平衡 时 A 的转化率为________。 答案 (1)c(C)·c(D) c(A)·c(B) < (2)0.022 0.09 80% 80% 解析 (1)根据反应 A(g)+B(g) C(g)+D(g),可写出平衡常数 K= c(C)·c(D) c(A)·c(B) ,随着温度升高,K 值减小,即升温平衡逆向移动,正反应为放 热反应,即ΔH<0。 (2)6 s 内消耗的 A 为 0.003 mol·L-1·s-1×6 s×5 L=0.09 mol,则此时 A 的 物质的量浓度为0.20 mol-0.09 mol 5 L =0.022 mol·L-1;生成 C 的物质的量与消耗 A 的物质的量相等,均为 0.09 mol。设参与反应的 A 的物质的量为 x mol,则平衡 时 A、B、C、D 的物质的量分别为(0.20-x) mol,(0.80-x) mol、x mol、x mol, 根据平衡常数的表达式和此时 K=1.0,求得 x=0.16,即平衡时 A 的转化率为 80%;向该平衡体系中充入氩气,对该平衡无影响,即平衡时 A 的转化率依然为 80%。 6.研究氮氧化物与悬浮在大气中海盐粒子的相互作用时,涉及如下反应: 2NO2(g)+NaCl(s) NaNO3(s)+ClNO(g) K1 ΔH<0(Ⅰ) 2NO(g)+Cl2(g) 2ClNO(g) K2 ΔH<0(Ⅱ) (1)4NO2(g) + 2NaCl(s) 2NaNO3(s) + 2NO(g) + Cl2(g) 的 平 衡 常 数 K = ________(用 K1、K2 表示)。 (2)为研究不同条件对反应(Ⅱ)的影响,在恒温条件下,向 2 L 恒容密闭容器 中加入 0.2 mol NO 和 0.1 mol Cl2,10 min 时反应(Ⅱ)达到平衡。测得 10 min 内 v(ClNO)=7.5×10-3 mol·L-1·min-1,回答下列问题: ①平衡后 n(Cl2)=________ mol。 ②NO 的转化率α1=________。 ③其他条件保持不变,反应(Ⅱ)在恒压条件下进行,平衡时 NO 的转化率 α2________α1(填“>”“<”或“=”),平衡常数 K2________(填“增大”“减 小”或“不变”)。 ④若要使 K2 减小,可采用的措施是________________。 答案 (1)K2 1 K2 (2)①2.5×10-2 ②75% ③> 不变 ④升高温度 解析 (1)反应①的化学平衡常数=c(ClNO) c2(NO2) ,反应②的平衡常数= c2(ClNO) c2(NO)·c(Cl2) ,反应③平衡常数=c(Cl2)·c2(NO) c4(NO2) ,所以计算 K=K2 1 K2 。 (2) 2NO(g)+Cl2(g) 2ClNO(g) 起始量/mol 0.2 0.1 0 变化量/mol 0.15 0.075 0.15 平衡量/mol 0.05 0.025 0.15 则平衡后氯气的物质的量为 2.5×10-2 mol;一氧化氮的转化率=0.15 0.2 =75%; 其他条件保持不变,反应(Ⅱ)在恒压条件下进行,随反应进行,气体体积减小, 为保持恒压所以容器的体积减小,压强比恒容容器大,平衡正向移动,平衡时一 氧化氮的转化率增大,平衡常数随温度变化,不随浓度或压强变化,若要使平衡 常数减小,平衡逆向移动,正反应是放热的,所以可以选择升高温度。 7.2NO(g)+O2(g) 2NO2(g) ΔH<0 是制造硝酸的重要反应之一。在 800 ℃时,向容积为 1 L 的密闭容器中充入 0.010 mol NO 和 0.005 mol O2,反应过程 中 NO 的浓度随时间变化如图所示: 请回答下列问题: (1)2 min 内,v(O2)________ mol·L-1·min-1。 (2)升高温度,平衡向________(填“正”或“逆”)反应方向移动。 (3)平衡时,NO 的转化率是________。 (4)800 ℃时,该反应的化学平衡常数为________。 答案 (1)1.25×10-3 (2)逆 (3)50% (4)400 解析 (1)v(NO)=0.010 mol·L-1-0.005 mol·L-1 2 min =0.0025 mol·L-1·min-1,则 v(O2)=1 2v(NO)=1.25×10-3 mol·L-1·min-1。 (2)正反应放热,则升高温度平衡逆向移动。 (3)起始时 c(NO)=0.010 mol·L-1,平衡时 c(NO)=0.005 mol·L-1,可知转化 率为0.005 0.010 ×100%=50%。 (4) 2NO(g)+O2(g) 2NO2(g) 起始/mol·L-1 0.010 0.005 0 平衡/mol·L-1 0.005 0.0025 0.005 则 K= c2(NO2) c2(NO)·c(O2) = 0.0052 0.0052×0.0025 =400。查看更多