- 2021-04-22 发布 |
- 37.5 KB |
- 4页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2020届二轮复习考前增分秘笈一易忘知识常记忆学案(全国通用)
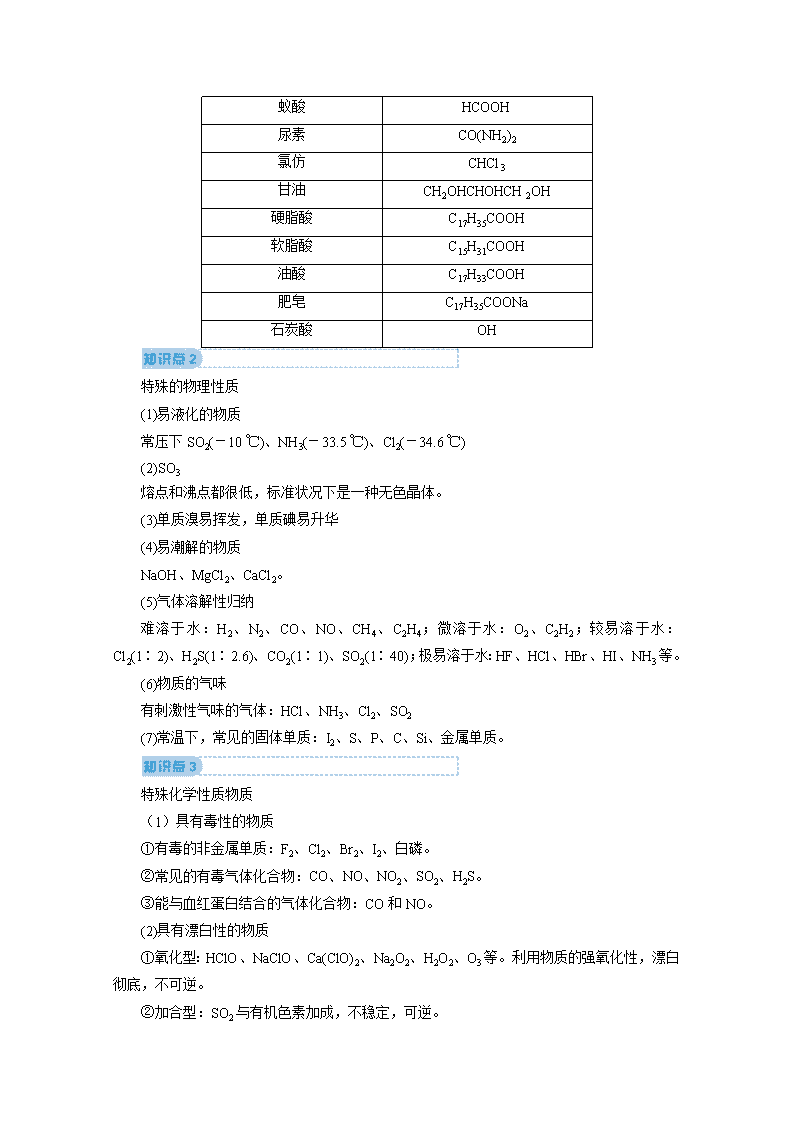
常见物质的俗名及成分 俗名 化学式(或主要成分) 双氧水 H2O2 干冰 CO2 纯碱、苏打、天然碱 Na2CO3 小苏打 NaHCO3 烧碱、火碱、苛性钠 NaOH 水玻璃、泡花碱 Na2SiO3 明矾 KAl(SO4)2·12H2O 生石膏 CaSO4·2H2O 石灰石、大理石 CaCO3 重晶石(钡餐) BaSO4 生石灰 CaO 熟石灰、消石灰 Ca(OH)2 碱石灰 CaO、NaOH(混合物) 电石 CaC2 石英、水晶 SiO2 刚玉(蓝宝石、红宝石) Al2O3 水煤气 CO、H2 高炉煤气 CO、CO2等混合气体 天然气(沼气) CH4 “84”消毒液 NaClO、NaCl(混合溶液) 漂白粉(漂白精) Ca(ClO)2、CaCl2(混合物) 绿矾 FeSO4·7H2O 铁红、赤铁矿 Fe2O3 磁铁矿 Fe3O4 胆矾、蓝矾 CuSO4·5H2O 铜绿、孔雀石 Cu2(OH)2CO3 福尔马林 35%~40%的HCHO水溶液 蚁酸 HCOOH 尿素 CO(NH2)2 氯仿 CHCl3 甘油 CH2OHCHOHCH2OH 硬脂酸 C17H35COOH 软脂酸 C15H31COOH 油酸 C17H33COOH 肥皂 C17H35COONa 石炭酸 OH 特殊的物理性质 (1)易液化的物质 常压下SO2(-10 ℃)、NH3(-33.5 ℃)、Cl2(-34.6 ℃) (2)SO3 熔点和沸点都很低,标准状况下是一种无色晶体。 (3)单质溴易挥发,单质碘易升华 (4)易潮解的物质 NaOH、MgCl2、CaCl2。 (5)气体溶解性归纳 难溶于水:H2、N2、CO、NO、CH4、C2H4;微溶于水:O2、C2H2;较易溶于水:Cl2(1∶2)、H2S(1∶2.6)、CO2(1∶1)、SO2(1∶40);极易溶于水:HF、HCl、HBr、HI、NH3等。 (6)物质的气味 有刺激性气味的气体:HCl、NH3、Cl2、SO2 (7)常温下,常见的固体单质:I2、S、P、C、Si、金属单质。 特殊化学性质物质 (1)具有毒性的物质 ①有毒的非金属单质:F2、Cl2、Br2、I2、白磷。 ②常见的有毒气体化合物:CO、NO、NO2、SO2、H2S。 ③能与血红蛋白结合的气体化合物:CO和NO。 (2)具有漂白性的物质 ①氧化型:HClO、NaClO、Ca(ClO)2、Na2O2、H2O2、O3等。利用物质的强氧化性,漂白彻底,不可逆。 ②加合型:SO2与有机色素加成,不稳定,可逆。 ③吸附型:活性炭、胶体。活性炭疏松、多孔、表面积大,其漂白原理为物理吸附。 (3)具有强吸水性的物质 ①浓硫酸吸收游离态的水,常用作干燥剂,但不能干燥NH3、H2S、HBr、HI等。 ②五氧化二磷(P2O5):磷酸或偏磷酸的酸酐,具有强烈的吸水性,可作酸性气体的干燥剂。 ③氯化钙:在空气中极易潮解,可作一般气体的干燥剂,但不能干燥氨气,因为会与氨气发生络合反应。 ④碱石灰:生石灰与氢氧化钠固体加热处理而得,具有吸水性,可作碱性气体的干燥剂。 (4)强氧化性酸:主要是浓硫酸、硝酸。 (5)碱性气体:氨气。 (6)既能与强酸反应,又能与强碱反应的物质 Al、Al2O3、Al(OH)3、弱酸的酸式盐(如NaHCO3)、弱酸的铵盐[如(NH4)2S]、氨基酸、蛋白质等。 特殊反应条件 (1)条件是“光照”的反应 ①次氯酸分解 ②氢气与氯气化合(也可以是点燃) ③硝酸分解(受热也能分解) ④AgCl、AgBr、AgI分解 ⑤甲烷与氯气发生取代反应 (2)中学化学中常见的使用催化剂的无机反应 ①2KClO32KCl+3O2↑ ②2H2O22H2O+O2↑ ③2SO2+O22SO3 ④N2+3H22NH3 ⑤4NH3+5O24NO+6H2O (3)条件是放电的反应:N2与O2化合生成NO。 特殊实验现象 (1)燃烧时火焰的颜色 ①苍白色:H2在Cl2中燃烧。 ②蓝色:CO在空气中燃烧。 ③淡蓝色:H2S、CH4、H2在空气中燃烧。 ④黄色:含钠元素的物质在灯焰上灼烧。 ⑤浅紫色(透过蓝色钴玻璃):含钾元素的物质在灯焰上灼烧。 (2)沉淀现象 ①在溶液中反应有黄色沉淀生成的有Ag+与Br-(浅黄色)、I-,S2O与H+,H2S或Na2S溶液与一些氧化性物质(Cl2、O2、SO2等),Ag+与PO。 ②向某溶液中滴入碱液,先生成白色沉淀,后迅速变为灰绿色,最后变为红褐色,则溶液中一定含有Fe2+。 ③与碱产生红褐色沉淀的必是Fe3+。 ④产生黑色沉淀的是Fe2+、Cu2+、Pb2+与S2-。 ⑤与碱反应生成白色沉淀的一般是Mg2+和Al3+,若加过量NaOH溶液沉淀不溶解,则是Mg2+,沉淀溶解则是Al3+。 ⑥加过量酸产生白色胶状沉淀的是SiO。 (3)放气现象 ①与稀盐酸反应生成刺激性气味的气体,且该气体可使品红溶液褪色,该气体一般是SO2,则原溶液中含有SO或HSO。 ②与稀盐酸反应生成无色气体,且该气体可使澄清石灰水变浑浊,该气体可能是CO2或SO2。 ③与碱溶液反应且加热时产生刺激性气味的气体,该气体可使湿润的红色石蕊试纸变蓝,该气体是NH3,原溶液中一定含有NH。 (4)变色现象 ①Fe3+与SCN-、Fe、Cu反应时颜色的变化。 ②遇空气迅速由无色变为红棕色的气体必为NO。 ③Fe2+与Cl2、Br2等氧化性物质反应时颜色的变化。 ④酸碱性溶液遇指示剂的变化。 ⑤品红溶液与Cl2、SO2等漂白剂的作用。 ⑥淀粉溶液遇碘变蓝。 ⑦Fe(OH)2在空气中被氧化:由白色迅速变为灰绿色最后变为红褐色。 ⑧蛋白质(含苯环)遇浓硝酸变黄,被灼烧时有烧焦羽毛的气味。查看更多