- 2021-04-22 发布 |
- 37.5 KB |
- 26页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2019届一轮复习鲁科版电能转化为化学能——电解学案
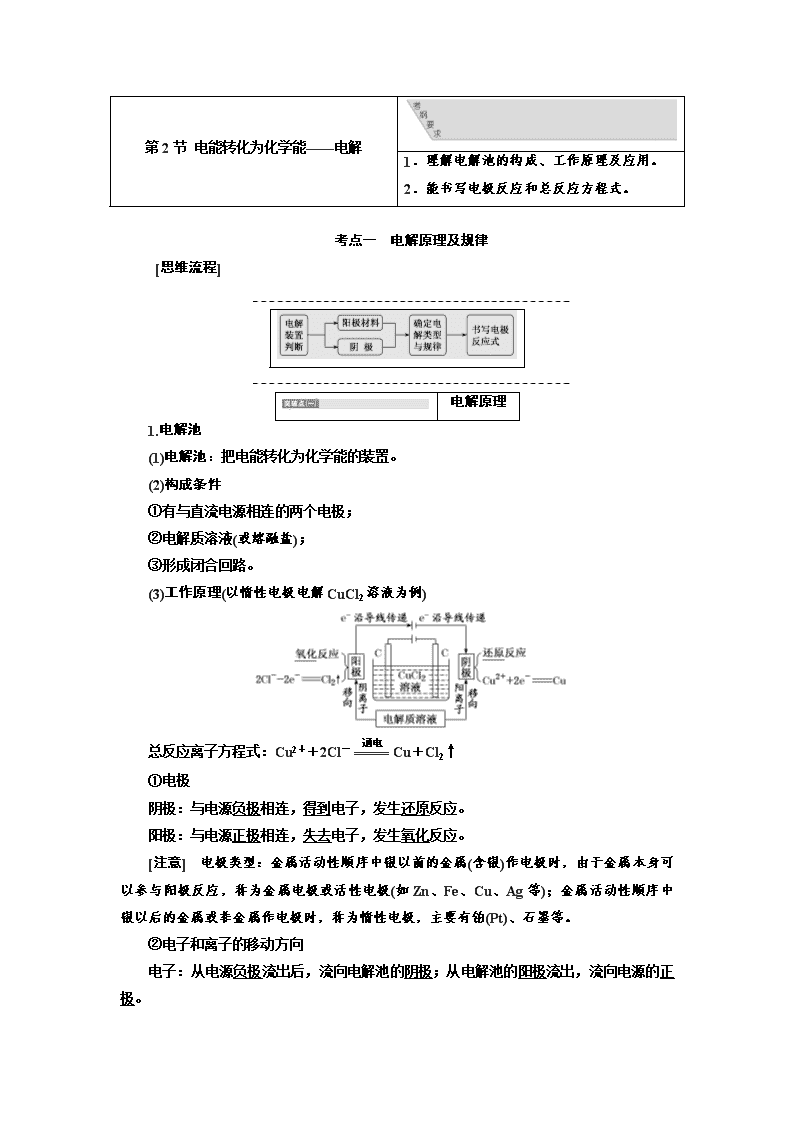
第2节 电能转化为化学能——电解 1.理解电解池的构成、工作原理及应用。 2.能书写电极反应和总反应方程式。 考点一 电解原理及规律 [思维流程] 电解原理 1.电解池 (1)电解池:把电能转化为化学能的装置。 (2)构成条件 ①有与直流电源相连的两个电极; ②电解质溶液(或熔融盐); ③形成闭合回路。 (3)工作原理(以惰性电极电解CuCl2溶液为例) 总反应离子方程式:Cu2++2Cl-Cu+Cl2↑ ①电极 阴极:与电源负极相连,得到电子,发生还原反应。 阳极:与电源正极相连,失去电子,发生氧化反应。 [注意] 电极类型:金属活动性顺序中银以前的金属(含银)作电极时,由于金属本身可以参与阳极反应,称为金属电极或活性电极(如Zn、Fe、Cu、Ag等);金属活动性顺序中银以后的金属或非金属作电极时,称为惰性电极,主要有铂(Pt)、石墨等。 ②电子和离子的移动方向 电子:从电源负极流出后,流向电解池的阴极;从电解池的阳极流出,流向电源的正极。 离子:阳离子移向电解池的阴极,阴离子移向电解池的阳极。 [注意] 电解时,在外电路中有电子通过,而在溶液中是依靠离子定向移动形成电流,即电子不通过电解质溶液。 2.电极反应式的书写步骤 [注意] (1)书写电解池的电极反应式时,可以用实际放电的离子表示,但书写电解池的总反应时,弱电解质要写成分子式。 如用惰性电极电解食盐水时,阴极反应式为2H++2e-===H2↑(或2H2O-2e-===H2↑+2OH-) 总反应式为2Cl-+2H2O2OH-+H2↑+Cl2↑ (2)电解水溶液时,应注意放电顺序,位于H+、OH-之后的离子一般不参与放电。 (3)Fe3+在阴极上放电时生成Fe2+而不是得到单质Fe。 [对点训练] 1.判断正误(正确的打“√”,错误的打“×”)。 (1)电解池的阳极发生氧化反应,阴极发生还原反应(√) (2)直流电源跟电解池连接后,电子从电源负极流向电解池阳极(×) (3)电解CuCl2溶液,阴极逸出的气体能使湿润的淀粉碘化钾试纸变蓝(×) (4)用惰性电极电解饱和食盐水,溶液的pH不变(×) (5)用铜作电极电解CuSO4溶液的方程式为2Cu+2H2O2Cu+O2↑+4H+(×) (6)电解NaCl溶液得到22.4 L H2(标准状况),理论上需要转移NA个电子(×) 2.某同学将电解池工作时电子、离子流动方向及电极种类等信息表示在下图中,下列有关分析完全正确的是( ) 选项 A B C D a电极 阳极 阴极 阳极 阴极 d电极 正极 正极 负极 负极 Q离子 阳离子 阳离子 阴离子 阴离子 解析:选B 电子从电源的负极流出,故a是阴极,d是正极,溶液中阳离子移向阴极。 3.(2018·株洲二中月考)用如图所示装置除去含CN-、Cl-废水中的CN-时,控制溶液pH为9~10,阳极产生的ClO-将CN-氧化为两种无污染的气体,下列说法不正确的是( ) A.用石墨作阳极,铁作阴极 B.阳极的电极反应式为Cl-+2OH--2e-===ClO-+H2O C.阴极的电极反应式为2H2O+2e-===H2↑+2OH- D.除去CN-的反应:2CN-+5ClO-+2H+===N2↑+2CO2↑+5Cl-+H2O 解析:选D 若铁作阳极,则铁失电子生成Fe2+,则CN-无法除去,故铁只能作阴极,阳极需为惰性电极,可用石墨作阳极,A项正确;阳极Cl-失去电子生成ClO-,发生氧化反应,又已知溶液呈碱性,故B项正确;在碱性条件下,水电离出的氢离子在阴极得电子生成氢气,发生还原反应,故C项正确;溶液pH为9~10,呈碱性,反应物中不可能含有大量的H+,故D项错误。 电解规律 以惰性电极电解电解质溶液的规律 类型 实例 电极反应特点 电解质溶液浓度 pH 电解质溶液复原 电解水型 NaOH 阴极:4H++4e-===2H2↑ 阳极:4OH--4e-===2H2O+O2↑ 增大 增大 加水 H2SO4 增大 减小 加水 Na2SO4 增大 不变 加水 电解电解质型 HCl 电解质电离出的阴、阳离子分别在两极放电 减小 增大 通HCl CuCl2 减小 加CuCl2 放H2生碱型 NaCl KCl 阴极:H2O放H2生碱 阳极:电解质阴离子放电 生成新电解质 增大 通HCl 放O2生酸型 CuSO4 Cu(NO3)2 阴极:电解质阳离子放电 阳极:H2O放O2生酸 生成新电解质 减小 加CuO [对点训练] 4.下列关于电解Na2SO4溶液的叙述正确的是( ) A.随着电解的进行,溶液的pH升高 B.OH-向阳极移动,阳极附近溶液呈碱性 C.SO向阳极移动,Na+向阴极移动,分别在对应的电极上析出 D.阴极上H+得电子被还原成H2,使阴极附近的溶液呈碱性 解析:选D 电解Na2SO4溶液,实质上发生的是2H2O2H2↑+O2↑,电解的过程中溶液pH不变,A项错;阳极因4OH--4e-===O2↑+2H2O而破坏附近水的电离使c(H+)>c(OH-),溶液呈酸性,B项错;在阴、阳极上分别是H+、OH-放电,C项错。 5.(2018·桂林中学月考)下列各组中,每种电解质溶液用惰性电极电解时只生成氢气和氧气的一组是( ) A.HCl、CuCl2、Ba(OH)2 B.NaOH、CuSO4、H2SO4 C.NaOH、H2SO4、Ba(OH)2 D.NaBr、H2SO4、Ba(OH)2 解析:选C 用惰性电极电解时,常见离子的放电顺序:阳离子的放电顺序为Ag+>Cu2+>H+>Na+>K+,阴离子的放电顺序为I->Br->Cl->OH->常见含氧酸根离子。电解HCl溶液生成H2和Cl2,电解CuCl2溶液生成Cu和Cl2,电解Ba(OH)2溶液生成H2和O2,A不符合;电解NaOH和H2SO4溶液均生成H2和O2,电解CuSO4溶液则生成Cu和O2,B不符合;电解NaOH、H2SO4、Ba(OH)2溶液均相当于电解水,均生成H2和O2,C符合;电解NaBr溶液则生成Br2和H2,D不符合。 [真题验收] 1.(2016·北京高考)用石墨电极完成下列电解实验。 实验一 实验二 装置 现象 a、d处试纸变蓝;b处变红,局部退色;c处无明显变化 两个石墨电极附近有气泡产生;n处有气泡产生…… 下列对实验现象的解释或推测不合理的是( ) A.a、d处:2H2O+2e-===H2↑+2OH- B.b处:2Cl--2e-===Cl2↑ C.c处发生了反应:Fe-2e-===Fe2+ D.根据实验一的原理,实验二中m处能析出铜 解析:选B 根据a、d处试纸变蓝,可判断a、d两点都为电解池的阴极,发生的电极反应为2H2O+2e-===H2↑+2OH-,A选项正确;b处变红,局部退色,说明b为电解池的阳极,2Cl--2e-===Cl2↑,氯气溶于水生成盐酸和次氯酸:Cl2+H2OHCl+HClO,HCl溶液显酸性,HClO具有漂白性,B选项不正确;c处为阳极,铁失去电子生成亚铁离子,发生的电极反应为Fe-2e-===Fe2+,C选项正确;实验一中ac形成电解池,db形成电解池,所以实验二中也形成电解池,铜珠的左端为电解池的阳极,铜失电子生成铜离子,m、n是铜珠的右端,为电解池的阴极,开始时产生气体,后来铜离子移到m处,m处铜离子得到电子生成单质铜,故D选项正确。 2.(2014·海南高考)以石墨为电极,电解KI溶液(其中含有少量酚酞和淀粉)。下列说法错误的是( ) A.阴极附近溶液呈红色 B.阴极逸出气体 C.阳极附近溶液呈蓝色 D.溶液的pH变小 解析:选D 以石墨为电极,电解KI溶液的方程式是2KI+2H2O通电,I2+H2↑+2KOH。由于其中含有少量酚酞和淀粉,所以在阳极附近碘单质遇淀粉,溶液变为蓝色;在阴极由于产生氢气,溶液显碱性,遇酚酞溶液变为红色。因为产生了碱,溶液碱性增强,所以溶液的pH变大。 3.(1)(2017·江苏高考)电解Na2CO3溶液的原理如下图所示。阳极的电极反应式为______________________,阴极产生的物质A的化学式为________。 (2) (2015·山东高考)利用LiOH和钴氧化物可制备锂离子电池正极材料。LiOH可由电解法制备,钴氧化物可通过处理钴渣获得。 利用如图所示装置电解制备LiOH,两电极区电解液分别为LiOH和LiCl溶液。B极区电解液为____________溶液(填化学式),阳极电极反应式为________________________,电解过程中Li+向________电极迁移(填“A”或“B”)。 (3) (2014·江苏高考)将烧碱吸收H2S后的溶液加入到如图所示的电解池的阳极区进行电解。电解过程中阳极区发生如下反应: S2--2e-===S (n-1)S+S2-===S ①写出电解时阴极的电极反应式:_________________________________。 ②电解后阳极区的溶液用稀硫酸酸化得到硫单质,其离子方程式可写成________________________________________________________________________。 解析:(1)阳极上OH-失去电子生成O2,由H2O电离出的H+可以与CO反应生成HCO。阴极上H2O放电生成H2。(2)根据电解装置图,两电极区电解液分别为LiOH和LiCl溶液,B极区产生H2,电极反应式为2H2O+2e-===H2↑+2OH-,OH-与Li+结合生成LiOH,所以B极区电解液应为LiOH溶液,B电极为阴极,则A电极应为阳极,阳极区电解液应为LiCl溶液,电极反应式为2Cl--2e-===Cl2↑。电解过程中,阳离子向阴极迁移,则Li+向B电极迁移。(3)由题图知,阴极区的电解质溶液为NaOH溶液,且阴极生成H2,故阴极的电极反应式为2H2O+2e-===H2↑+2OH-。加入H2SO4后,S在酸性条件下发生歧化反应,生成硫单质和硫化氢气体,离子方程式为S+2H+===(n-1)S↓+H2S↑。 答案:(1)4CO+2H2O-4e-===4HCO+O2↑ H2 (2)LiOH 2Cl--2e-===Cl2↑ B (3)①2H2O+2e-===H2↑+2OH- ②S+2H+===(n-1)S↓+H2S↑ 考点二 电解原理的应用 [思维流程] 1.电解饱和食盐水 (1)电极反应 阳极:2Cl--2e-===Cl2↑(反应类型:氧化反应), 阴极:2H++2e-===H2↑(反应类型:还原反应)。 (2)总反应式 总反应方程式:2NaCl+2H2O2NaOH+H2↑+Cl2↑。 总反应离子方程式:2Cl-+2H2O2OH-+H2↑+Cl2↑。 (3)应用:氯碱工业制烧碱、氢气和氯气 装置 离子交换膜电解槽 阳极 钛网(涂有钛、钌等氧化物涂层) 阴极 碳钢网 阳离子交换膜 ①只允许阳离子通过,能阻止阴离子和气体通过 ②将电解槽隔成阳极室和阴极室 2.电镀铜 [注意] 一增(阴极),一减(阳极),一不变(电镀液的浓度),且阴极增加的质量与阳极减少的质量相等。 3.电解精炼铜 (1)电极材料:阳极为粗铜,阴极为纯铜。 (2)电解质溶液:含Cu2+的盐溶液。 (3)电极反应式 阳极:Zn-2e-===Zn2+、Fe-2e-===Fe2+、Ni-2e-===Ni2+、Cu-2e-===Cu2+; 阴极:Cu2++2e-===Cu。 (4)阳极泥的形成 在电解过程中,金属活动性顺序中位于铜之后的银、金等杂质,因为失去电子的能力比铜弱,难以在阳极失去电子变成阳离子而溶解,所以当阳极的铜及比铜活泼的金属失去电子变成阳离子溶解之后,它们以金属单质的形式沉积在电解槽底部,形成阳极泥。 (5)电解精炼必备条件 ①两极材料:含杂质的金属作阳极,纯金属作阴极。 ②电解质溶液的选取:含有相应金属离子的盐溶液。 4.电冶金 利用电解熔融盐(或氧化物)的方法来冶炼活泼金属Na、Ca、Mg、Al等。 总方程式 阳极、阴极反应式 冶炼钠 2NaCl(熔融)2Na+Cl2↑ 2Cl--2e-===Cl2↑、2Na++2e-===2Na 冶炼镁 MgCl2(熔融)Mg+Cl2↑ 2Cl--2e-===Cl2↑、Mg2++2e-===Mg 冶炼铝 2Al2O3(熔融)4Al+3O2↑ 6O2--12e-===3O2↑、4Al3++12e-===4Al [典例] (2017·全国卷Ⅱ)用电解氧化法可以在铝制品表面形成致密、耐腐蚀的氧化膜,电解质溶液一般为H2SO4H2C2O4混合溶液。下列叙述错误的是( ) A.待加工铝质工件为阳极 B.可选用不锈钢网作为阴极 C.阴极的电极反应式为Al3++3e-===Al D.硫酸根离子在电解过程中向阳极移动 [学审题析题] 第一步:审题干信息 ①由题干中铝制品表面形成致密、耐腐蚀的氧化膜,可推→2O3,故铝发生失电子的氧化反应,Al作阳极。则另一极为阴极,其电极材料只要是导电材料(如石墨、不锈钢网等)即可得出A、B两项均正确; ②由题干中电解质溶液为H2SO4H2C2O4混合溶液可知溶液呈酸性。 第二步:逐项分析定答案 由题干信息已推断出A、B两项正确;在酸性条件下,阴极中的H+得到电子生成H2,故阴极电极反应式为2H++2e-===H2↑,C项错误,符合题意;在电解过程中电解质溶液中的阴离子向阳极移动,阳离子向阴极移动,故D项正确。 [答案] C [对点训练] 1.利用如图所示装置模拟电解原理在工业生产上的应用。下列说法正确的是( ) A.氯碱工业中,X电极上反应式是4OH--4e-===2H2O+O2↑ B.电解精炼铜时,Z溶液中的Cu2+浓度不变 C.在铁片上镀铜时,Y是纯铜 D.制取金属镁时,Z是熔融的氯化镁 解析:选D 氯碱工业中阳极是Cl-放电生成Cl2;电解精炼铜时阳极粗铜溶解,阴极Cu2+放电析出Cu,溶液中Cu2+浓度变小;铁片上镀铜时,阴极应该是铁片,阳极是纯铜。 2.(2018·南昌一模)电化学在日常生活中用途广泛,图甲是镁-次氯酸钠燃料电池,电池总反应为Mg+ClO-+H2O===Cl-+Mg(OH)2↓,图乙是含Cr2O的工业废水的处理装置。下列说法正确的是( ) A.图甲中发生的氧化反应是Mg2++ClO-+H2O+2e-===Cl-+Mg(OH)2↓ B.图乙中惰性电极上有O2放出 C.图乙中Cr2O向惰性电极移动,与该极附近溶液中的OH-结合转化成Cr(OH)3除去 D.若图甲中3.6 g镁产生的电量用于图乙中废水处理,理论上图乙中有8.4 g阳极材料参与反应 解析:选D 该原电池中,镁作负极,负极上镁失去电子发生氧化反应,负极反应为Mg-2e-===Mg2+,电池总反应式为Mg+ClO-+H2O===Mg(OH)2↓+Cl-,正极上ClO-得电子发生还原反应,则总反应减去负极反应可得正极反应(还原反应)为Mg2++ClO-+H2O+2e-===Cl-+Mg(OH)2↓,故A错误;图乙中惰性电极为阴极,Fe电极为阳极,惰性电极附近溶液中的H+得电子发生还原反应生成H2,故B错误;图乙中惰性电极为阴极,Fe电极为阳极,则Cr2O向金属铁电极移动,与Fe2+发生氧化还原反应生成Cr3+,Cr3+与惰性电极附近的OH-结合生成Cr(OH)3除去,故C错误;由电子守恒可知Mg~2e-~Fe,n(Mg)==0.15 mol,则阳极氧化Fe的质量为0.15 mol×56 g·mol-1=8.4 g,故D正确。 3.氢氧化锂是制取锂和锂的化合物的原料,用电解法制备氢氧化锂的工作原理如图所示。 下列叙述不正确的是( ) A.b极附近溶液的pH增大 B.a极发生的反应为2H2O-4e-===O2↑+4H+ C.该法制备LiOH还可得到硫酸和氢气等产品 D.当电路中通过1 mol电子时,可得到2 mol LiOH 解析:选D 由图可知,Li+向b极移动,则b极为阴极,电极反应式为2H2O+2e-===2OH-+H2↑,由于b极生成OH-,故b极附近溶液的pH增大,A正确;a极为阳极,电极反应式为2H2O-4e-===O2↑+4H+,B正确;SO向a极移动,与a极产生的H+形成H2SO4,在b极上产生H2和LiOH,C正确;根据阴极反应式可知,电路中通过1 mol 电子时,生成1 mol OH-,可得到1 mol LiOH,D错误。 [真题验收] 1.(2016·天津高考节选)化工生产的副产氢也是氢气的来源。电解法制取有广泛用途的Na2FeO4,同时获得氢气:Fe+2H2O+2OH-FeO+3H2↑,工作原理如图1所示。装置通电后,铁电极附近生成紫红色FeO,镍电极有气泡产生。若氢氧化钠溶液浓度过高,铁电极区会产生红褐色物质。已知:Na2FeO4只在强碱性条件下稳定,易被H2还原。 (1)电解一段时间后,c(OH-)降低的区域在________(填“阴极室”或“阳极室”)。 (2)电解过程中,须将阴极产生的气体及时排出,其原因是__________________________。 (3)c(Na2FeO4)随初始c(NaOH)的变化如图2,任选M、N两点中的一点,分析c(Na2FeO4)低于最高值的原因:__________________________________________________________ ________________________________________________________________________。 解析:(1)根据电解总反应:Fe+2H2O+2OH-FeO+3H2↑,结合阳极发生氧化反应知,阳极反应式为Fe-6e-+8OH-===FeO+4H2O,结合阴极发生还原反应知,阴极反应式为2H2O+2e-===2OH-+H2↑,则阳极室消耗OH-且无补充,故c(OH-)降低。(2)结合题给信息“Na2FeO4易被氢气还原”知,阴极产生的氢气不能接触到Na2FeO4 ,故需及时排出。(3)图示中随着c(NaOH)增大,c(Na2FeO4)先增大后减小,结合已知信息“Na2FeO4只在强碱性条件下稳定”知,M点 c(Na2FeO4)低的原因是c(OH-)低,反应速率小且Na2FeO4稳定性差。结合已知信息“若氢氧化钠溶液浓度过高,铁电极区会产生红褐色物质”知,N点c(Na2FeO4)低的原因是c(OH-)过高,铁电极上产生Fe(OH)3或Fe2O3,使Na2FeO4产率降低。 答案:(1)阳极室 (2)防止Na2FeO4与H2反应使产率降低 (3)M点:c(OH-)低,Na2FeO4稳定性差,且反应慢; N点:c(OH-)过高,铁电极上有Fe(OH)3(或Fe2O3)生成,使Na2FeO4产率降低 2.(2015·上海高考节选)氯碱工业以电解精制饱和食盐水的方法制取氯气、氢气、烧碱和氯的含氧酸盐等系列化工产品。如图所示是离子交换膜法电解食盐水的示意图,图中的离子交换膜只允许阳离子通过。 完成下列填空: (1)写出电解饱和食盐水的离子方程式:________________________________________ ________________________________________________________________________。 (2)离子交换膜的作用为______________________________________________、 ________________________________________________________________________。 (3)精制饱和食盐水从图中________位置补充,NaOH溶液从图中________位置流出。(填“a”、“b”、“c”或“d”) 解析:(1)电解饱和食盐水时,溶液中的H+在阴极得到电子变为H2逸出,使附近的水溶液显碱性,溶液中的Cl-在阳极失去电子,发生氧化反应产生Cl2,电解反应的离子方程式是2Cl-+2H2OCl2↑+H2↑+2OH-。(2)图中的离子交换膜,只允许阳离子通过,不能使阴离子和气体通过,这样就可以阻止阴极溶液中的OH-进入阳极室,与Cl2发生反应,阻止Cl-进入阴极室,使在阴极区产生的NaOH纯度更高。同时可以阻止阳极产生的Cl2和阴极产生的H2混合发生爆炸。(3)随着电解的进行,溶质NaCl不断消耗,所以应该及时补充,精制饱和食盐水从与阳极连接的图中a位置补充,由于阴极H+不断放电,附近的溶液显碱性,NaOH溶液从图中d位置流出;水不断消耗,所以从b口不断加入蒸馏水,从c位置流出的是稀的NaCl溶液。 答案:(1) 2Cl-+2H2OCl2↑+H2↑+2OH- (2)阻止OH-进入阳极室,与Cl2发生副反应:2NaOH+Cl2===NaCl+NaClO+H2O 阻止阳极产生的Cl2和阴极产生的H2混合发生爆炸 (3)a d 3.(2014·全国卷Ⅰ节选)次磷酸(H3PO2)是一种精细磷化工产品,具有较强还原性,回答下列问题: H3PO2也可用电渗析法制备。“四室电渗析法” 工作原理如下图所示(阳膜和阴膜分别只允许阳离子、阴离子通过): (1)写出阳极的电极反应式:_________________________________________________。 (2)分析产品室可得到H3PO2的原因:__________________________________ ________________________________________________________________________。 (3)早期采用“三室电渗析法”制备H3PO2:将“四室电渗析法”中阳极室的稀硫酸用H3PO2稀溶液代替。并撤去阳极室与产品室之间的阳膜,从而合并了阳极室与产品室。其缺点是产品中混有__________杂质。该杂质产生的原因是 ________________________________________________________________________。 解析:(1)阳极为水电离出的OH-放电,电极反应式为2H2O-4e-===O2↑+4H+。(2)阳极室中的H+穿过阳膜进入产品室,原料室中的H2PO穿过阴膜扩散至产品室,二者反应生成H3PO2。(3)在阳极区H2PO或H3PO2可能失电子发生氧化反应,即生成物中会混有PO。 答案:(1)2H2O-4e-===O2↑+4H+ (2)阳极室的H+穿过阳膜扩散至产品室,原料室的H2PO穿过阴膜扩散至产品室,二者反应生成H3PO2 (3)PO H2PO或H3PO2被氧化 考点三 电化学定量计算 电化学的反应是氧化还原反应,各电极上转移电子的物质的量相等,无论是单一电池还是串联电解池,均可抓住电子守恒计算。 1.解题关键 (1)电极名称要区分清楚; (2)电极产物要判断准确; (3)各产物间量的关系遵循电子得失守恒。 2.三种计算方法 (式中M为金属,n为其离子的化合价数值) 该关系式具有总览电化学计算的作用和价值,熟记电极反应式,灵活运用关系式便能快速解答常见的电化学计算问题。 [注意] 在电化学计算中,还常利用Q=I·t和Q=n(e-)×NA×1.60×10-19 C来计算电路中通过的电量。 [题点全练] 1.以Pt为电极,电解含有0.10 mol M+和0.10 mol N3+(M+、N3+均为金属阳离子)的溶液,阴极析出金属单质或气体的总物质的量(y)与导线中通过电子的物质的量(x)的关系如图。对离子氧化能力的强弱判断正确的是(选项中H+为氢离子)( ) A.M+>H+>N3+ B.M+>N3+>H+ C.N3+>H+>M+ D.条件不足,无法确定 解析:选A 当通过电子为0.1 mol时,析出固体或气体的物质的量为0.1 mol,证明此时析出的固体,而不是氢气(若是氢气,那么氢气的物质的量应该为0.05 mol),第二阶段,失去电子0.2 mol,对应物质0.1 mol,可知该物质是氢气,后面失电子数和物质的量比例保持不变,说明X3+不放电,M+离子先于H+放电,故氧化能力为M+>H+>N3+。 2.电解100 mL含c(H+)=0.30 mol·L-1的下列溶液,当电路中通过0.04 mol电子时,理论上析出金属质量最大的是( ) A.0.10 mol·L-1 Ag+ B.0.20 mol·L-1 Zn2+ C.0.20 mol·L-1 Cu2+ D.0.20 mol·L-1 Pb2+ 解析:选C 在电解液中除金属离子外都含有H+(酸电离),电解时阴极是先析出金属还是先放出H2,这与金属的活动性顺序有关。题中Cu和Ag的活动性顺序在H的后面,它们的离子与H+共存时,首先被还原的是Cu2+和Ag+;而Pb和Zn的活动性顺序在H的前面,它们的离子与H+共存时,首先被还原的是H+。所以电解含有Zn2+、Pb2+ 的溶液时,H+先得电子生成H2,n(e-)=n(H+)=0.30 mol·L-1×0.1 L=0.03 mol,故Zn、Pb得到的电子为0.04 mol-0.03 mol=0.01 mol,生成的金属Zn、Pb的物质的量均为0.005 mol,其质量分别为0.325 g、1.035 g;电解含有Ag+的溶液,可得Ag的质量为0.1 mol·L-1×0.1 L×108 g·mol-1=1.08 g;电解含有Cu2+的溶液,可得铜的质量为0.2 mol·L-1×0.1 L×64 g·mol-1=1.28 g,C项符合题意。 3.将两个铂电极插入500 mL CuSO4溶液中进行电解,通电一段时间后,某一电极增重0.064 g(设电解时该电极无氢气析出,且不考虑水解和溶液体积变化),此时溶液中氢离子浓度约为( ) A.4×10-3 mol·L-1 B.2×10-3 mol·L-1 C.1×10-3 mol·L-1 D.1×10-7 mol·L-1 解析:选A 阴极反应:Cu2++2e-===Cu,增重0.064 g应是生成Cu的质量,设生成H+的物质的量为x,根据总反应离子方程式: 2Cu2++2H2O 2Cu+O2↑+4H+ 2×64 g 4 mol 0.064 g x x=0.002 mol c(H+)==4×10-3 mol·L-1。 4.(2017·成都七中阶段检测)在500 mL KNO3和Cu(NO3)2的混合溶液中,c(NO)=6 mol·L-1,用石墨电极电解此溶液,当通电一段时间后,两极均收集到22.4 L气体(标准状况),假定电解后溶液体积仍为500 mL,下列说法正确的是( ) A.电解得到的Cu的物质的量为0.5 mol B.向电解后的溶液中加入98 g的Cu(OH)2可恢复为原溶液 C.原混合溶液中c(K+)=4 mol·L-1 D.电解后溶液中c(H+)=2 mol·L-1 解析:选B 石墨作电极电解此溶液,当通电一段时间后,两极均收集到22.4 L气体(标准状况),n(O2)==1 mol,阳极发生2H2O-4e-===O2↑+4H+,生成1 mol氧气转移4 mol电子,阴极发生Cu2++2e-===Cu、2H++2e-===H2↑,生成1 mol氢气,转移2 mol 电子,因此还要转移2 mol电子生成1 mol铜。电解得到的Cu的物质的量为1 mol,故A错误;根据电解原理和原子守恒,溶液中减少的原子有铜、氧、氢,向电解后的溶液中加入Cu(OH)2,可恢复为原溶液,需要1 mol Cu(OH)2,质量为98 g,故B正确;c(Cu2+)==2 mol·L-1,由电荷守恒可知,原混合溶液中c(K+)为6 mol·L-1-2 mol·L-1×2=2 mol·L-1,故C错误;电解后溶液中c(H+)为=4 mol·L-1,故D错误。 [综合演练提能] [课堂巩固练] 1.如图是电解饱和NaCl溶液的实验装置,其中c、d为石墨电极。则下列有关判断中正确的是( ) A.a为正极、b为负极 B.c为阴极、d为阳极 C.电解过程中,d电极质量增加 D.电解过程中,Cl-浓度不变 解析:选A 由电子流向可知,a为正极,b为负极,c为阳极,d为阴极,c极:2Cl--2e-===Cl2↑;d极:2H++2e-===H2↑,因此,B、C、D项均错。 2.图1是电解饱和氯化钠溶液示意图。图2中,x轴表示实验时流入阴极的电子的物质的量,y轴表示( ) A.n(Na+) B.n(Cl-) C.c(OH-) D.c(H+) 解析:选C 电解饱和食盐水装置中,阳极Cl-放电生成氯气:2Cl--2e-===Cl2↑,阴极H+放电:2H++2e-===H2↑,总反应:2Cl-+2H2O2OH-+H2↑+Cl2↑。A项,阴极H+放电,n(Na+)不变;B项,阳极Cl-放电生成氯气,所以n(Cl-)减小;C项,阴极H+放电,所以溶液中c(OH-)增大;D项,阴极H+放电,所以c(H+)减小。 3.(2018·辛集中学测试)利用电解法可将含有Fe、Zn、Ag、Pt等杂质的粗铜提纯,下列叙述正确的是( ) A.电解时以精铜作阳极 B.电解时阴极发生氧化反应 C.粗铜连接电源负极,其主要的电极反应是Cu-2e-===Cu2+ D.电解后,电解槽底部会形成含少量Ag、Pt等金属的阳极泥 解析:选D 电解精炼铜时,粗铜作阳极,A项错误;电解时阴极发生还原反应,B项错误;粗铜连接电源正极,其主要的电极反应是Cu-2e-===Cu2+,C项错误;由于Ag、Pt不如Cu活泼,电解时不能失电子,最终以阳极泥的形式沉积下来,D项正确。 4.(2018·深圳中学考试)电解法处理酸性含铬(主要含有Cr2O )废水时,以铁板作阴、阳极,处理过程中存在反应Cr2O+6Fe2++14H+===2Cr3++6Fe3++7H2O,最后Cr3+以Cr(OH)3形式被除去,下列说法不正确的是( ) A.阳极反应为Fe-2e-===Fe2+ B.过程中有Fe(OH)3沉淀生成 C.电解过程中溶液pH不会变化 D.电路中每转移12 mol电子,最多有1 mol Cr2O被还原 解析:选C Fe板作阳极,为活性电极,Fe失电子,发生氧化反应生成Fe2+,阳极反应为Fe-2e-===Fe2+,A项正确;阴极发生还原反应,溶液中的H+得到电子生成氢气,H+浓度减小,铁离子水解生成Fe(OH)3沉淀,B项正确;由反应Cr2O+6Fe2++14H+===2Cr3++6Fe3++7H2O可知,处理过程中消耗H+,溶液的酸性减弱,溶液pH增大,C项错误;Fe-2e-===Fe2+,则电路中每转移12 mol 电子需要消耗6 mol Fe,再根据处理过程的反应方程式,得6Fe~12e-~6Fe2+~Cr2O,故被还原的Cr2O的物质的量为1 mol,D项正确。 5.(2017·海南高考)一种电化学制备NH3的装置如图所示,图中陶瓷在高温时可以传输H+。下列叙述错误的是( ) A.Pd电极b为阴极 B.阴极的反应式为N2+6H++6e-===2NH3 C.H+由阳极向阴极迁移 D.陶瓷可以隔离N2和H2 解析:选A 此装置为电解池,总反应式是N2+3H2===2NH3,Pd电极b上是氢气发生氧化反应,即氢气失去电子化合价升高,Pd电极b为阳极,故A说法错误;根据A选项分析,Pd电极a为阴极,反应式为N2+6H++6e-===2NH3,故B说法正确;根据电解池的原理,阳离子在阴极上放电,即H+由阳极移向阴极,故C说法正确;根据装置图,陶瓷可以隔离N2和H2,故D说法正确。 6.如图所示装置中,甲、乙、丙三个烧杯依次分别盛放100 g 5% NaOH溶液、足量CuSO4溶液和100 g 10% K2SO4溶液,电极均为石墨电极。 (1)接通电源,一段时间后,测得丙中K2SO4溶液的质量分数为10.47%,乙中c电极质量增加。则 ①电源的N端为________极; ②电极b上发生的电极反应为_______________________________________________; ③计算电极b上生成的气体在标准状况下的体积为______L; ④电解前后丙中溶液的pH________(填“增大”“减小”或“不变”)。 (2)乙装置中如果电解过程中铜全部析出,此时电解能否继续进行:________(填“能”或“不能”),原因是_______________________________________________________ ________________________________________________________________________。 解析:(1)①接通电源一段时间后,乙中c电极质量增加,说明c电极表面析出Cu,则该电极为阴极,从而推知M端为电源的负极,N端为电源的正极。 ②电极b为阳极,用惰性电极电解NaOH溶液相当于电解水,阳极上OH-放电生成O2,电极反应式为4OH--4e-===O2↑+2H2O。 ③用惰性电极电解K2SO4溶液相当于电解水,设电解过程中消耗水的质量为x g,据电解前后溶质的质量不变可得:100 g×10%=(100-x)g×10.47%,解得x=4.5,则电解过程中消耗水的物质的量为=0.25 mol,转移电子的物质的量为0.5 mol,故电极b上生成的O2在标准状况下的体积为V(O2)=0.5 mol××22.4 L·mol-1=2.8 L。 ④丙中用惰性电极电解K2SO4溶液相当于电解水,电解过程中c(K2SO4)增大,但溶液的pH不变。 (2)当电解过程中铜全部析出时,CuSO4溶液变为H2SO4溶液,继续电解则为电解H2SO4溶液,相当于电解水。 答案:(1)①正 ②4OH--4e-===O2↑+2H2O ③2.8 ④不变 (2)能 CuSO4溶液变为H2SO4溶液,可继续电解H2SO4溶液,相当于电解水 [课下提能练] 对应配套卷P309 1.(2018·绵阳模拟)下列表述不正确的是( ) A B C D 盐桥中的Cl-移向ZnSO4溶液 粗铜的电极反应式为Cu2++2e-===Cu 正极反应式为O2+4e-+2H2O===4OH a极附近产生的气体能使湿润的淀粉碘化钾试纸变蓝 - 解析:选C 根据原电池的工作原理,锌为负极,铜为正极,阴离子向负极移动,A正确;根据电解原理,a为阳极,其电极反应式为2Cl--2e-===Cl2↑,b为阴极,Cu2++2e-===Cu,因此a极产生的气体能使淀粉碘化钾试纸变蓝,B正确;粗铜作阳极,Cu-2e-===Cu2+,C错误;发生吸氧腐蚀,正极得电子,电极反应式为O2+2H2O+4e-===4OH-,D正确。 2.用饱和氯化钠溶液润湿的滤纸分别做甲、乙两个实验,下列判断错误的是( ) A.甲是原电池,乙是电解池 B.甲中铁棒比乙中铁棒更易腐蚀 C.d电极上的电极反应是Fe-2e-===Fe2+ D.b电极上的电极反应是O2+2H2O+4e-===4OH- 解析:选C 据原电池和电解池的构成条件可知,甲是原电池,乙是电解池,A正确;甲中铁为原电池的负极,发生反应Fe-2e-===Fe2+,乙中Fe为电解池阴极,发生反应2H++2e-===H2↑,Fe被保护,B正确;乙中d为阴极,阴极上电极反应式为2H++2e-===H2↑,C错误;甲中铁发生吸氧腐蚀,b为正极,正极上电极反应式为2H2O+O2+4e-===4OH-,D正确。 3.(2018·郑州一中月考)用石墨作电极电解溶有物质的量之比为3∶1的NaCl和H2SO4的水溶液。根据反应产物,电解可明显分为三个阶段,下列叙述不正确的是( ) A.电解的最后阶段为电解水 B.阳极先逸出氯气后逸出氧气 C.阴极逸出氢气 D.电解过程中溶液的pH不断增大,最后pH为7 解析:选D 根据离子放电顺序可知,电解此混合溶液时,在阳极,离子放电的先后顺序为Cl-、OH-、SO,在阴极,离子放电的先后顺序为H+、Na+,所以整个电解过程分三个阶段:电解HCl溶液、电解NaCl溶液、电解H2O,最后溶液呈碱性,D项错误。 4.(2018·汕头月考)在固态金属氧化物电解池中,高温电解H2O、CO2混合气体制备H2和CO是一种新的能源利用方式,基本原理如图所示。下列说法不正确的是( ) A.阴极的反应式: H2O+2e-===H2+O2-、CO2+2e-===CO+O2- B.X是电源的负极 C.总反应可表示为H2O+CO2===H2+CO+O2 D.阴、阳两极生成的气体的物质的量之比是1∶1 解析:选D 电解池阴极发生还原反应,电解H2O、CO2混合气体制备H2和CO,阴极发生的反应有水蒸气中的H得电子生成氢气:H2O+2e-===H2+O2-,二氧化碳中的C得电子生成CO:CO2+2e-===CO+O2-,A项正确;根据图示知,与X相连的电极发生还原反应产生CO和H2,故X为电源的负极,B项正确;根据图示可知,阴极产生H2、CO,阳极产生O2,总反应可表示为H2O+CO2===H2+CO+O2,C项正确;根据总反应可知,阴、阳两极生成的气体的物质的量之比是2∶1,D项错误。 5.(2018·昆明质检)某实验小组设计如图实验装置探究电化学原理,装置Ⅰ中Zn电极产生ZnO,下列说法正确的是( ) A.Cu电极质量增加 B.装置Ⅱ将化学能转变为电能 C.装置Ⅰ中OH-向多孔电极移动 D.多孔电极的电极反应式为O2+4e-+2H2O===4OH- 解析:选D 据实验装置可知Ⅰ装置为原电池,Ⅱ装置为电解池。A项,Cu电极为电解池的阳极:Cu-2e-===Cu2+,即Cu电极质量减少;B项,装置Ⅱ为电解池,将电能转化为化学能;C项,原电池中,电解质溶液中的阴离子向负极移动,故装置Ⅰ中OH-向Zn电极移动。 6.(2018·青岛模拟)假设图中原电池产生的电压、电流强度均能满足电解、电镀要求,即为理想化。①~⑧为各装置中的电极编号。下列说法错误的是( ) A.当K闭合时,装置A发生吸氧腐蚀,在电路中作电源 B.当K断开时,装置B锌片溶解,有氢气产生 C.当K闭合后,整个电路中电子的流动方向为①→⑧,⑦→⑥,⑤→④,③→② D.当K闭合后,装置A、B中溶液的pH均变大 解析: 选A 当K闭合时,装置B能自发进行氧化还原反应,所以装置B为原电池,则装置A、C、D都是电解池,装置B中Zn失去电子作负极、Cu作正极,所以装置A中C(石墨)、装置C中Cu、装置D中粗Cu都作阳极。装置A中Fe、装置C中Ag、装置D中纯Cu都作阴极;当K断开时,装置B不能形成闭合回路,所以不能构成原电池,则锌和稀硫酸发生化学腐蚀。当K闭合时,装置B能自发进行氧化还原反应,为原电池,在电路中作电源,装置A为电解池,A项符合题意;当K断开时,装置B不能构成原电池,锌片和稀硫酸发生化学腐蚀而溶解,有氢气产生,B项不符合题意;当K闭合后,装置B为原电池,装置A、C、D为电解池,电子从负极流向阴极,再从阳极流向阴极,所以整个电路中电子的流动方向为①→⑧,⑦→⑥,⑤→④,③→②,电子不进入电解质溶液,C项不符合题意;当K闭合后,装置A中阴极上H+放电,阳极上Cl-放电,导致溶液中OH-浓度增大,溶液的pH增大;装置B中正极上H+放电导致溶液中H+浓度减小,溶液的pH增大,D项不符合题意。 7.(2018·武汉调研)厨房垃圾发酵液通过电渗析法处理,同时得到乳酸的原理如图所示(图中HA表示乳酸分子,A-表示乳酸根离子)。下列说法正确的是( ) A.通电后,阳极附近pH增大 B.电子从负极经电解质溶液回到正极 C.通电后,A-通过阴离子交换膜从阴极区进入浓缩室 D.当电路中通过2 mol电子的电量时,会有1 mol O2生成 解析:选C 由题图可知,阳极上电解水产生H+和O2,所以通电后,阳极附近pH减小,A项错误;电子不进入电解质溶液,电解质溶液导电是通过带电离子的定向移动,B项错误;电解池中,阴离子向阳极方向移动,故通电后,A-通过阴离子交换膜从阴极区进入浓缩室,C项正确;根据阳极的电极反应式2H2O-4e-===O2↑+4H+,当电路中通过2 mol 电子的电量时,会有0.5 mol O2生成,D项错误。 8.在城市中,地下常埋有纵横交错的管道和输电线路,有些地面上还铺有地铁或城铁的铁轨,当有电流泄漏入潮湿的土壤中,并与金属管道或铁轨形成回路时,就会引起金属管道、铁轨的腐蚀,原理简化如图所示,则下列有关说法不正确的是( ) A.原理图可理解为两个串联的电解装置 B.溶液中铁丝被腐蚀时,左侧有无色气体产生,附近产生少量白色沉淀,随后变为灰绿色 C.地下管道被腐蚀,不易发现,也不便维修,故应将埋在地下的金属管道表面涂绝缘膜(或油漆等) D.溶液中铁丝左侧的电极反应式为Fe-2e-===Fe2+ 解析:选D 由图可知,左侧Fe电极与电源的正极相连为阳极,铁丝左侧为阴极,形成电解池;铁丝右侧为阳极,右侧Fe电极与电源负极相连为阴极,形成电解池,故该装置可看作两个串联的电解装置,A正确。铁丝左侧为阴极,发生还原反应:2H2O+2e-===2OH-+H2↑,左侧Fe电极生成的Fe2+与OH-结合生成Fe(OH)2白色沉淀,随后被氧化变成灰绿色,B正确,D错误。埋在地下的金属管道表面涂绝缘膜(或油漆等),可减缓金属管道的腐蚀,C正确。 9.按如图所示装置进行下列不同的操作,其中不正确的是( ) A.铁腐蚀的速率由快到慢的顺序:只闭合K3>只闭合K1>都断开>只闭合K2 B.只闭合K3,正极的电极反应式: 2H2O+O2+4e-===4OH- C.先只闭合K1,一段时间后,漏斗内液面上升,然后只闭合K2,漏斗内液面上升 D.只闭合K2,U形管左、右两端液面均下降 解析:选A 金属腐蚀速率:电解池的阳极>原电池的负极>化学腐蚀>原电池的正极>电解池的阴极,闭合K3,是原电池,铁作负极;闭合K2,是电解池,铁作阴极;闭合K1,铁作阳极,因此腐蚀速率由快到慢的顺序:只闭合K1>只闭合K3>都断开>只闭合K2,故A说法错误。只闭合K3,构成原电池,铁棒发生吸氧腐蚀,正极反应式:O2+2H2O+4e-===4OH-,故B说法正确。先只闭合K1,铁作阳极,阳极反应式为Fe-2e-===Fe2+,阴极反应式为2H++2e-===H2↑,U形管中气体压强增大,因此漏斗中液面上升;然后只闭合K2,铁作阴极,阴极反应式为2H++2e-===H2↑,阳极反应式为2Cl--2e-===Cl2↑,U形管中气体压强增大,漏斗中液面上升,故C说法正确。根据选项C的分析,只闭合K2,两极均有气体放出,气体压强增大,左、右两端液面均下降,故D说法正确。 10.(1)研究人员最近发现了一种“水”电池,这种电池能利用淡水与海水之间含盐量的差别进行发电,在海水中电池总反应可表示为5MnO2+2Ag+2NaCl===Na2Mn5O10+2AgCl,“水”电池在放电时: ①该电池负极的电极反应为____________________________________________。 ②Na+不断向“水”电池的________极移动。 ③每有1 mol电子转移,生成________ mol Na2Mn5O10。 (2)如图所示,将该“水”电池与某装置相连。 ①若X、Y为石墨,a为2 L一定物质的量浓度的KCl溶液,电解一段时间发现Y极附近产生了黄绿色气体,写出电解总反应的化学方程式:____________________________________________ ________________________________________________________________________。 ②若X、Y分别为铁、铜,a为CuCl2和Na2SO4的混合溶液,电池与X、Y的连接方式与①相同,Y极的电极反应为 ________________________________________________________________________。 解析:(1)①根据电池总反应可判断出Ag为该电池的负极,电极反应为Ag+Cl--e-===AgCl。②在原电池中,阴离子向负极移动,阳离子向正极移动,故Na+移向正极。③根据电池总反应和得失电子守恒知,生成1 mol Na2Mn5O10的同时生成2 mol AgCl,转移2 mol电子,故每有1 mol电子转移,生成0.5 mol Na2Mn5O10。(2)①用石墨作电极电解KCl溶液,阴极发生还原反应生成H2,阳极发生氧化反应生成Cl2,由于Y极附近出现黄绿色气体,故Y为阳极,电解总反应为2KCl+2H2OH2↑+Cl2↑+2KOH。②根据①可知此时铁作阴极,铜作阳极,故阳极金属铜放电,阳极反应为Cu-2e-===Cu2+。 答案:(1)①Ag+Cl--e-===AgCl ②正 ③0.5 (2)①2KCl+2H2OH2↑+Cl2↑+2KOH ②Cu-2e-===Cu2+ 11.金属铝在现代生产和日常生活中应用广泛。 (1)工业上用电解熔融氧化铝的方法来制取金属铝。纯净氧化铝的熔点很高(约2 045 ℃),在实际生产中,通过加入助熔剂冰晶石(Na3AlF6)得到熔融体,反应方程式为2Al2O34Al+3O2↑。 ①在电解过程中阴极反应式为____________________________________________; 阳极反应式为________________________________________________________。 ②由于电解产生的氧气全部与石墨电极反应生成CO和CO2气体,因此在电解过程中石墨电极需要不断补充。若生产中每生成a g Al,损失石墨b g,则理论上产生CO和CO2的物质的量分别是____________________。 (2)对金属制品进行抗腐蚀处理,可延长其使用寿命。如图所示,以铝片为阳极,在H2SO4溶液中电解,可使铝片表面形成氧化膜,则阳极电极反应式为___________________________ ______________________。在电解过程中,阴极附近溶液的pH________(填“增大”“减小”或“不变”)。 (3)“863”计划和中科院“百人计划”支持的环境友好型铝-碘电池已研制成功,电解质为AlI3溶液,已知电池总反应式为2Al+3I2===2AlI3 。该电池负极的电极反应式为________________________________________________________________________, 当负极质量减少27 g时,在导线中有________个电子通过。 解析:(1)①分析电解熔融Al2O3的反应方程式可知,Al3+在阴极发生还原反应生成Al,电极反应式为Al3++3e-===Al;O2-在阳极发生氧化反应生成O2,电极反应式为2O2--4e-===O2↑。 ②根据电解总反应式可知,生成a g Al时,生成O2的物质的量为 mol;据O原子守恒可得:n(CO)+2n(CO2)=2× mol;据C原子守恒可得:[n(CO)+n(CO2)]×12 g·mol-1=b g;联立两式可得n(CO)= mol,n(CO2)= mol。 (2)用铝片为阳极,电解H2SO4溶液使铝片表面形成氧化膜,即生成Al2O3,则阳极反应式为2Al+3H2O-6e-===Al2O3+6H+。电解过程中,阴极上H+放电生成H2,电极反应式为2H++2e-===H2↑,反应中消耗H+,溶液中c(H+)减小,溶液的pH增大。 (3)分析铝-碘电池总反应可知,Al失去电子被氧化成Al3+,则Al作负极,电极反应式为Al-3e-===Al3+。负极质量减少27 g时,负极上消耗1 mol Al,结合负极反应式可知导线中转移电子的物质的量为3 mol,即1.806×1024(或3NA)个电子。 答案:(1)①Al3++3e-===Al 2O2--4e-===O2↑ ② mol、 mol (2)2Al+3H2O-6e-===Al2O3+6H+ 增大 (3)Al-3e-===Al3+ 1.806×1024(或3NA) 12.能源是国民经济发展的重要基础,我国目前使用的能源主要是化石燃料。 (1)熔融盐燃料电池具有高的发电效率,因而受到重视。可用熔融的碳酸盐作为电解质,向负极充入燃料气CH4,用空气与CO2的混合气作为正极的助燃气,以石墨为电极材料,制得燃料电池。工作过程中,CO移向________极(填“正”或“负”),已知CH4发生反应的电极反应式为CH4+4CO-8e-===5CO2+2H2O,则另一极的电极反应式为________________________________________________________________________。 (2)利用上述燃料电池,按图1所示装置进行电解,A、B、C、D均为铂电极,回答下列问题。 Ⅰ.甲槽电解的是200 mL一定浓度的NaCl与CuSO4 的混合溶液,理论上两极所得气体的体积随时间变化的关系如图2所示(气体体积已换算成标准状况下的体积,电解前后溶液的体积变化忽略不计)。 ①原混合溶液中NaCl的物质的量浓度为______ mol·L-1,CuSO4的物质的量浓度为________ mol·L-1。 ②t2时所得溶液的pH=________。 Ⅱ.乙槽为200 mL CuSO4溶液,乙槽内电解的总离子方程式:______________。 ①当C极析出0.64 g物质时,乙槽溶液中生成的H2SO4为________mol。电解后,若使乙槽内的溶液完全复原,可向乙槽中加入________(填字母)。 A.Cu(OH)2 B.CuO C.CuCO3 D.Cu2(OH)2CO3 ②若通电一段时间后,向所得的乙槽溶液中加入0.2 mol的Cu(OH)2才能恰好恢复到电解前的浓度,则电解过程中转移的电子数为________。 解析:(1)燃料电池工作过程中,熔融盐中的阴离子向负极移动,即CO移向负极。CH4在负极发生氧化反应生成CO2和H2O,该燃料电池的总反应式为CH4+2O2===CO2+2H2O,结合得失电子守恒、负极反应式和电池总反应式推知,正极反应式为O2+2CO2+4e-===2CO。 (2)Ⅰ.①A、B、C、D均为惰性电极Pt,甲槽电解NaCl和CuSO4的混合液,阳极上离子放电顺序为Cl->OH->SO,阴极上离子放电顺序为Cu2+>H+>Na+,开始阶段阴极上析出Cu,阳极上产生Cl2,则图中曲线a代表阴极产生气体体积的变化,曲线b代表阳极产生气体体积的变化。阳极上发生的反应依次为2Cl--2e-===Cl2↑、4OH--4e-===2H2O+O2↑,由曲线b可知,Cl-放电完全时生成224 mL Cl2,根据Cl原子守恒可知,溶液中c(NaCl)==0.1 mol·L-1;阴极上发生的反应依次为Cu2++2e-===Cu、2H++2e-===H2↑,由曲线b可知Cu2+放电完全时,阳极上产生224 mL Cl2和112 mL O2,则电路中转移电子的物质的量为0.01 mol×2+0.005 mol×4=0.04 mol,据得失电子守恒可知n(Cu2+)=0.04 mol×=0.02 mol,故混合液中c(CuSO4)==0.1 mol·L-1。②0~t1时间内相当于电解CuCl2,电解反应式为CuCl2Cu+Cl2↑,t1~t2时间内相当于电解CuSO4,而电解CuSO4溶液的离子反应为2Cu2++2H2O2Cu+O2↑+4H+,则生成H+的物质的量为0.005 mol×4=0.02 mol,则有c(H+)==0.1 mol·L-1,故溶液的pH=1。Ⅱ.电解CuSO4 溶液时,Cu2+在阴极放电,水电离的OH-在阳极放电,电解的总离子方程式为2Cu2++2H2O2Cu+O2↑+4H+。①C极为阴极,电极反应式为Cu2++2e-===Cu,析出0.64 g Cu(即0.01 mol)时,生成H2SO4的物质的量也为0.01 mol。电解CuSO4 溶液时,阴极析出Cu,阳极上产生O2,故可向电解质溶液中加入CuO、CuCO3等使电解质溶液完全复原。②加入0.2 mol Cu(OH)2相当于加入0.2 mol CuO和0.2 mol H2O,则电解过程中转移电子的物质的量为0.2 mol×2+0.2 mol×2=0.8 mol,即0.8NA个电子。 答案:(1)负 O2+2CO2+4e-===2CO (2)Ⅰ.①0.1 0.1 ②1 Ⅱ.2Cu2++2H2O2Cu+O2↑+4H+ ①0.01 BC ②0.8NA 13.(2018·长春质检)纳米级Cu2O由于具有优良的催化性能而受到关注,下表为制取Cu2O的两种方法: 方法a 用炭粉在高温条件下还原CuO 方法b 电解法,反应为2Cu+H2OCu2O+H2↑ (1)已知: ①2Cu(s)+O2(g)===Cu2O(s) ΔH=-169 kJ·mol-1 ②C(s)+O2(g)===CO(s) ΔH=-110.5 kJ·mol-1 ③Cu(s)+O2(g)===CuO(s) ΔH=-157 kJ·mol-1 则方法a中反应的热化学方程式是_______________________________________。 (2)方法b是用肼燃料电池为电源,通过离子交换膜电解法控制电解液中OH-的浓度而制备纳米Cu2O,装置如图所示: ①上述装置中B电极应连________电极(填“C”或“D”)。 ②该离子交换膜为________离子交换膜(填“阴”或“阳”),该电解池的阳极反应式为________________________________________________________________________ ________________________________________________________________________。 ③原电池中负极反应式为____________________________________________________。 解析:(1)据盖斯定律②-③×2+①得:C(s)+2CuO(s)===Cu2O(s)+CO(g) ΔH=+34.5 kJ·mol-1。 (2)①B电极为Cu,需将Cu转化为Cu2O,则B电极为阳极,故接电源负极C;②由于离子交换膜用于控制c(OH-),防止c(OH- )过大,故应选用阴离子交换膜;阳极Cu失电子在碱性条件下转化为Cu2O:2Cu+2OH--2e-===Cu2O+H2O;③负极N2H4失电子转化为N2:N2H4+4OH--4e-===N2↑+4H2O。 答案:(1)2CuO(s)+C(s)===Cu2O(s)+CO(g) ΔH=+34.5 kJ·mol-1 (2)①C ②阴 2Cu+2OH--2e-===Cu2O+H2O ③N2H4+4OH--4e-===N2↑+4H2O查看更多