- 2021-04-21 发布 |
- 37.5 KB |
- 17页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
高中化学选修4课件_20金属的电化学腐蚀与防护
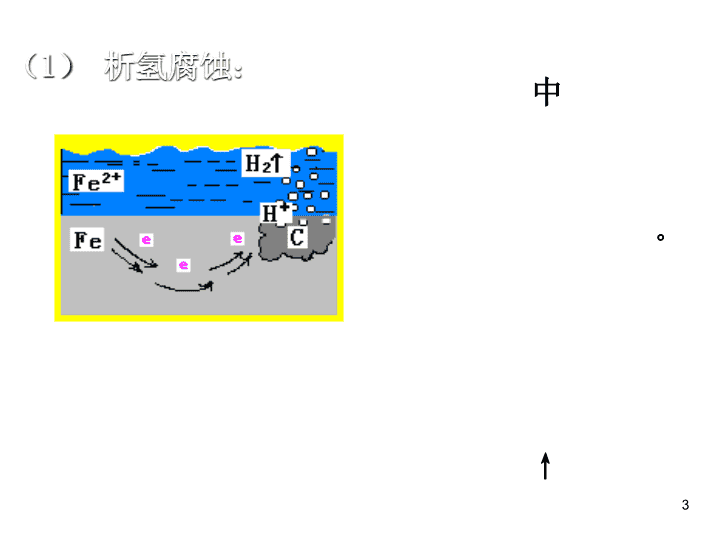
第四章 电化学基础 11 二月 2021 第四节 金属的电化学腐蚀与防护 是指金属或合金跟接触的气体或液体 发生氧化还原反应而腐蚀 损耗的过程。 金属阳离子 失 e - (氧化反应) 金属腐蚀的类型 化学腐蚀 电化学腐蚀 一、金属的电化学腐蚀(主要指铁的腐蚀 金属原子 金属腐蚀的本质: 1. 金属腐蚀 M – ne - → M n+ — 直接反应 — 原电池反应 接触到的气体或液体不同 2 2H + + 2e - =H 2 ↑ Fe - 2e - = Fe 2+ Fe + 2H + =Fe 2+ + H 2 ↑ (1) 析氢腐蚀: 负极: 正极: 电池反应: 当钢铁处于酸性环境 中 ★析氢腐蚀和吸氧腐蚀都属于电化学腐蚀 。 3 [ 实验探究 ] 将经过酸洗除锈的铁钉,用饱和食盐水浸泡一下,放入下图具支试管中,观察导管中水柱变化,并思考引起变化的原因? 吸氧腐蚀 ( 2) 吸氧腐蚀 4 吸氧腐蚀: 发生条件: 中性 或 酸性很弱 条件下 5 2Fe - 4e - = 2Fe 2+ O 2 + 2H 2 O + 4e - = 4OH - 2Fe+ O 2 +2H 2 O =2Fe(OH) 2 4Fe(OH) 2 +O 2 + 2H 2 O = 4 Fe(OH) 3 2Fe(OH) 3 =Fe 2 O 3 ·xH 2 O+(3-x) H 2 O 进一步反应: 负极: 正极: 电池反应: 6 更多时候写成立 Fe(OH) 3 →Fe 2 O 3 ·xH 2 O 这就是 铁锈 化学腐蚀 电化学腐蚀 条件 现象 本质 影响 因素 联系 金属跟干燥气体或非电解质液体直接接触 不纯金属或合金 跟电解质溶液接触 无电流产生 有 微弱电流 产生 金属被氧化 较活泼金属被氧化 化学腐蚀与电化学腐蚀的比较 与接触物质的氧化性及温度有关 与电解质溶液的酸碱性及金属活性有关 两者往往同时发生,电化学腐蚀更普遍 7 下列各情况下,其中 Fe 片腐蚀由 快 到 慢 的顺序是 。 (5) (2) (1) (3) (4) 讨论与交流 8 结论 判断金属腐蚀快慢的规律 电解池 → 外界力量 → 外力无法抗拒 电解池的阳极>原电池的负极>化学腐蚀>原电池的正极>电解池的阴极 1 、电解原理引起的腐蚀 > 原电池原理引起的腐蚀 > 化学腐蚀>防腐措施的腐蚀 2 、对同一种金属来说,腐蚀的快慢: 强电解质溶液 > 弱电解质溶液 > 非电解质溶液 3 、活泼性不同的两金属,活泼性差别越大,腐蚀越快。 4 、对同一种电解质溶液来说,电解质溶液浓度越大,腐蚀越快。 9 金属的防护方法: 1、 添加保护层 ① 刷油漆 ② 包一层塑料 ③ 镀上一层耐腐蚀的金属 2、 改变金属结构即制成合金 3、 原电池保护法:牺牲阳极的阴极保护法 4、 外加电源的阴极保护法 本节内容只解释后二种方法! 原理 : 形成原电池时,让 被保护金属 作 正极 ( 阴极 ) ,不反应受到保护;而 活泼金属 作 负极 ( 阳极 ) ,反应受到腐蚀。 1. 牺牲阳极的阴极保护法 二、金属的电化学防护 11 12 科学探究 验证牺牲阳极的阴极保护法 13 辅助阳极(不溶性) 2. 外加电流的阴极保护法 原理 : 将 被保护金属 与另一 附加电极 作为电解池的两个极,使 被保护的金属 作为 阴极 ,在外加直流电的作用下使阴极得到保护。此法主要用于防止土壤、海水及水中金属设备的腐蚀。 14 除此以外还有哪些防护方法? 15 金属防护的几种重要方法 : ① 在金属表面覆盖保护层。 ② 改变金属内部的组成结构,制成合金。 ③ 电化学保护法,即将金属作为原电池的正极或电解池的阴极而受到保护。 归纳与整理 16 1 、如图 , 水槽中试管内有一枚铁钉,放置数天观察: ( 1 ) 若液面上升,则溶液呈 性,发生 腐蚀,电极反应式为:负极: 正极: 若液面下降,则溶液呈 性, 发生 腐蚀,电极反应式为: 负极: 正极: ( 2 ) 中性或碱性 吸氧 Fe–2e - = Fe 2+ O 2 +2H 2 O+4e - = 4OH - 酸性 析氢 Fe–2e - = Fe 2+ 2H + +2e - = H 2 ↑ 课堂练习 17查看更多