- 2021-04-21 发布 |
- 37.5 KB |
- 12页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2020届高考化学一轮复习第六单元第3讲电解池 金属的电化学腐蚀与防护作业
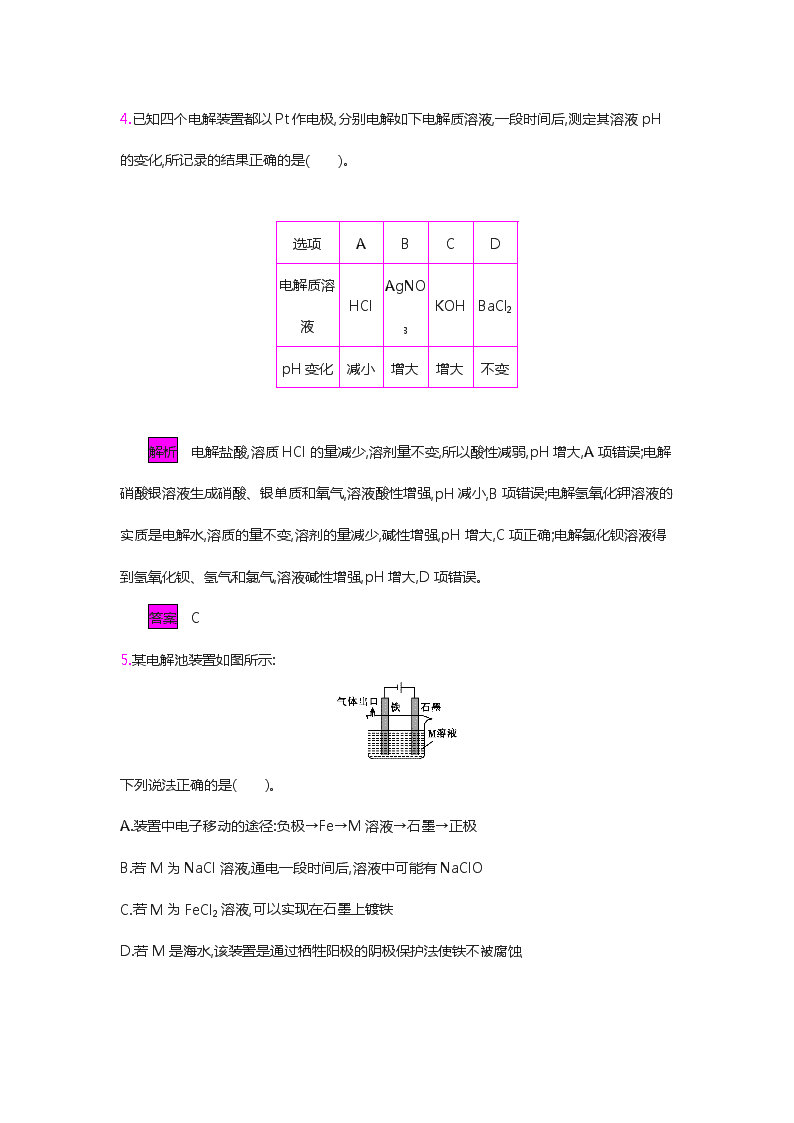
1.(2018年合肥调研)下列做法有利于金属防护的是( )。 A.钢铁零件表面进行烤蓝处理 B.将钢铁制成的闸门与直流电源正极相连 C.菜刀切菜后不洗净就放回刀架 D.埋在地下的钢管与铜块相连 解析 一般钢铁容易生锈,如果将钢铁零件的表面进行烤蓝处理,就能大大增强抗腐蚀能力,延长使用寿命,A项正确;钢铁制成的闸门与直流电源的正极相连,闸门成为电解池的阳极,会加快腐蚀,B项错误;菜刀切菜后不洗净,容易发生吸氧腐蚀,C项错误;铁比铜活泼,当埋在地下的钢管与铜块相连时,钢管成为原电池的负极,加快了腐蚀,应该使钢管与锌块相连,D项错误。 答案 A 2.用铁铆钉固定两个铜质零件的示意图如图所示,若将该零件置于潮湿的空气中,下列说法正确的是( )。 A.发生电化学腐蚀,铜为负极,铜极产生H2 B.铜易被腐蚀,铜极上发生还原反应,吸收O2 C.铁易被腐蚀,铁发生氧化反应:Fe-2e-Fe2+ D.发生化学腐蚀:Fe+Cu2+Cu+Fe2+ 解析 A项,铜应为正极,电极反应式为O2+2H2O+4e-4OH-;B项,铁易被腐蚀;D项,发生的是电化学腐蚀。 答案 C 3.利用如图所示装置,可以完成很多电化学实验。下列有关此装置的叙述中,正确的是( )。 A.若X为锌棒,Y为NaCl溶液,开关K置于M处,可减缓铁的腐蚀,这种方法称为牺牲阴极保护法 B.若X为碳棒,Y为NaCl溶液,开关K置于N处,可减缓铁的腐蚀,溶液中的阴离子向铁电极移动 C.若X为铜棒,Y为硫酸铜溶液,开关K置于M处,铜棒质量将增加,此时外电路中的电子向铜电极移动 D.若X为铜棒,Y为硫酸铜溶液,开关K置于N处,铁棒质量将增加,溶液中铜离子浓度将减小 解析 若X为锌棒,Y为NaCl溶液,开关K置于M处,则构成了锌-铁原电池,由于锌比铁活泼,所以可以防止铁被腐蚀,而锌被腐蚀,该方法称为牺牲阳极的阴极保护法,故A项错误;若X为碳棒,Y为NaCl溶液,开关K置于N处,则组成了一个电解池,X为阳极,铁为阴极,同样可以减缓铁的腐蚀,铁电极上发生的电极反应为2H2O+2e-2OH-+H2↑,所以溶液中的阴离子向碳电极移动,故B项错误;若X为铜棒,Y为硫酸铜溶液,开关K置于M处,则构成了铁-铜原电池,在铜极上析出铜,所以铜棒的质量将增加,此时外电路中的电子向铜电极移动,故C项正确;若X为铜棒,Y为硫酸铜溶液,开关K置于N处,则构成了电解池,这时铜电极溶解,铁电极上有铜生成,所以铁棒质量将增加,但是溶液中铜离子浓度不变,故D项错误。 答案 C 4.已知四个电解装置都以Pt作电极,分别电解如下电解质溶液,一段时间后,测定其溶液pH的变化,所记录的结果正确的是( )。 选项 A B C D 电解质溶液 HCl AgNO3 KOH BaCl2 pH变化 减小 增大 增大 不变 解析 电解盐酸,溶质HCl的量减少,溶剂量不变,所以酸性减弱,pH增大,A项错误;电解硝酸银溶液生成硝酸、银单质和氧气,溶液酸性增强,pH减小,B项错误;电解氢氧化钾溶液的实质是电解水,溶质的量不变,溶剂的量减少,碱性增强,pH增大,C项正确;电解氯化钡溶液得到氢氧化钡、氢气和氯气,溶液碱性增强,pH增大,D项错误。 答案 C 5.某电解池装置如图所示: 下列说法正确的是( )。 A.装置中电子移动的途径:负极→Fe→M溶液→石墨→正极 B.若M为NaCl溶液,通电一段时间后,溶液中可能有NaClO C.若M为FeCl2溶液,可以实现在石墨上镀铁 D.若M是海水,该装置是通过牺牲阳极的阴极保护法使铁不被腐蚀 解析 装置中电子通过导线从铁电极移向石墨电极,A项错误;若M为NaCl溶液,通电一段时间后,阳极产生Cl2,溶液中的NaOH与阳极产生的Cl2发生反应生成NaCl和NaClO,所以溶液中可能有NaClO,B项正确;若M为FeCl2溶液,在阳极,溶液中的Fe2+失去电子变为Fe3+,所以不可能实现在石墨上镀铁,C项错误;若M是海水,该装置是电解池,是通过外加电流的阴极保护法使铁不被腐蚀,不是通过牺牲阳极的阴极保护法,D项错误。 答案 B 6.如图所示,某同学设计了一种燃料电池来探究氯碱工业原理和粗铜的精炼原理,乙装置中X为阳离子交换膜。 下列有关说法正确的是( )。 A.反应一段时间后,乙装置中生成的氢氧化钠在铁极区 B.乙装置中铁电极为阴极,电极反应式为Fe-2e-Fe2+ C.通入氧气的一极为负极,发生的电极反应为O2+4e-+2H2O4OH- D.反应一段时间后,丙装置中硫酸铜溶液浓度保持不变 解析 甲装置为甲醚燃料电池,投放氧气的一极发生还原反应,为正极,投放甲醚的一极为负极;乙装置为电解饱和氯化钠溶液的装置,根据串联电池中电子的转移,可知Fe电极为阴极,C电极为阳极,丙装置为电解精炼铜的装置,粗铜为阳极,纯铜为阴极。乙装置中铁电极的电极反应为2H++2e-H2↑,所以反应一段时间后,装置中生成的氢氧化钠在铁极区,A项正确,B项错误;通入氧气的一极发生还原反应,为原电池的正极,发生的电极反应为O2+2H2O+4e-4OH-,C项错误;丙装置中,粗铜电极除了铜发生氧化反应外,活动性强于 铜的金属也要反应,但是在纯铜电极,除铜离子被还原外,没有其他离子被还原,根据得失电子相等可知,硫酸铜溶液浓度减小,D项错误。 答案 A 7.25 ℃时,用两个质量相同的铜棒作电极,电解500 mL 0.1 mol·L-1 H2SO4溶液,电解过程中,电解液的pH变化如表所示(假定溶液温度保持不变)。电解2 h后,取出电极,对电极进行干燥,并称量,测得两电极的质量差为9.6 g。已知25 ℃时,0.1 mol·L-1 CuSO4溶液的pH为4.17。 时间/h 0.5 1 1.5 2 pH 1.3 2.4 3.0 3.0 (1)实验刚开始阶段,电解池的阴极所发生的电极反应为 。 (2)电解进行到1.5 h后,电解质溶液的pH不再发生变化的原因是 ; 0.1 mol·L-1 CuSO4溶液的pH为4.17的原因是 (用离子方程式表示)。 (3)电解进行到2 h时,转移电子的总物质的量 (填“<”“=”或“>”)0.15 mol。 (4)欲使所得电解质溶液恢复到500 mL 0.1 mol·L-1 H2SO4溶液,应对溶液进行的处理是 。 解析 由题中信息可知,电解刚开始阶段,阳极反应式为Cu-2e-Cu2+,阴极反应式为2H++2e-H2↑;随着电解的继续,溶液中Cu2+的浓度增大,此时阳极反应不变,阴极反应则变成Cu2++2e-Cu;若电解过程中只有电镀铜的过程,则阳极溶解的铜与阴极生成的铜质量应相同,溶液的组成保持不变,则阳极铜减少的质量为9.6 g2=4.8 g,转移电子的物质的量为0.15 mol,而实际上先有H2产生,后有电镀铜的过程,故实际转移电子的物质的量大于0.15 mol;要使电解后的溶液恢复到原溶液,则需要通入H2S:H2S+CuSO4CuS↓+H2SO4。 答案 (1)2H++2e-H2↑ (2)电解过程发生转变,阳极反应式为Cu-2e-Cu2+,阴极反应式为Cu2++2e-Cu,电解质溶液的组成、浓度不再发生变化,溶液的pH也不再发生变化;Cu2++2H2OCu(OH)2+2H+ (3)> (4)向溶液中通入约0.05 mol H2S 8.某学习小组将“电解饱和食盐水”的相关内容进行梳理,形成如下问题(电极材料均为石墨)。 (1)图1中,电解一段时间后,气球b中的气体是 (填化学式),U形管 (填“左”或“右”)边的溶液变红。 (2)利用图2制作一种环保型消毒液发生器,通过电解可制备“84”消毒液的有效成分,则c为电源的 极;该发生器中反应的总离子方程式为 。 (3)二氧化氯(ClO2)为一种黄绿色气体,是国际上公认的高效、广谱、快速、安全的杀菌消毒剂。如图所示是目前已开发出的用电解法制取ClO2的新工艺。 ①阳极产生ClO2的电极反应式为 。 ②当阴极产生标准状况下112 mL气体时,通过阳离子交换膜的离子的物质的量为 。 解析 (1)图1中,根据电子流向知,左边电极是电解池阳极,右边电极是电解池阴极,阳极上氯离子放电生成氯气,阴极上氢离子放电生成氢气,同时阴极附近产生NaOH。 (2)要制取“84”消毒液,应创造氯气和氢氧化钠反应生成NaClO的环境,为了使反应更充分,则下边电极生成氯气,上边电极附近有NaOH生成,上边电极生成氢气,为阴极,则c为负极,d为正极。 (3)①依据题干信息,阳极Cl-被氧化为ClO2,根据电子守恒和电荷守恒,写出电极反应式。②电极上每得到或失去一个电子,电解质溶液中必然有一个阳离子通过阳离子交换膜。 答案 (1)H2;右 (2)负;Cl-+H2OClO-+H2↑ (3)①Cl--5e-+2H2OClO2↑+4H+ ②0.01 mol 9.工业上用电解法处理含镍酸性废水并得到单质Ni的原理如图所示。 已知:①Ni2+在弱酸性溶液中发生水解。 ②氧化性:Ni2+(高浓度)>H+>Ni2+(低浓度)。 下列说法不正确的是( )。 A.碳棒上发生的电极反应为4OH--4e-O2↑+2H2O B.电解过程中,B室中NaCl溶液的物质的量浓度将不断减小 C.为了提高Ni的产率,电解过程中需要控制废水的pH D.若将图中阳离子膜去掉,将A、B两室合并,则电解反应的总方程式将发生改变 解析 阳极反应式为4OH--4e-2H2O+O2↑,阴极反应式为Ni2++2e-Ni、2H++2e-H2↑,因此A项正确;B项,由于C室中Ni2+、H+不断减少,Cl-通过阴离子膜从C室移向B室,A室中OH-不断减少,Na+通过阳离子膜从A室移向B室,所以B室中NaCl溶液的物质的量浓度不断增大,错误;C项,由于H+的氧化性大于Ni2+(低浓度)的氧化性,所以为了提高Ni的产率,电解过程需要控制废水的pH,正确;D项,若去掉阳离子膜,则阳极为Cl-放电生成Cl2,反应的总方程式将发生改变,正确。 答案 B 10.H2O2是一种弱酸,在强碱溶液中主要以HO2-的形式存在。已知:Al-H2O2碱性燃料电池的总反应为2Al+3NaHO22NaAlO2+NaOH+H2O。以Al-H2O2燃料电池电解尿素[CO(NH2)2]的碱性溶液制备氢气(电解池中隔膜仅阻止气体通过,c、d均为惰性电极)的装置如图所示。下列说法不正确的是( )。 A.电极a发生的反应为Al+4OH--3e-AlO2-+2H2O B.电极b是正极,且反应后该电极区的pH增大 C.电解过程中,电子的流向为a→b→c→d D.电解时,消耗2.7 g Al,则产生标准状况下的氮气1.12 L 解析 a为负极,电极反应为Al+4OH--3e-AlO2-+2H2O。b为正极,电极反应可由总反应-负极反应得到,所以b极反应为3HO2-+6e-+3H2O9OH-。反应后溶液的pH增大,A、B两项正确;C项,根据上述分析,a为负极,故电子流向为a→d,c→b,错误;D项,由CO(NH2)2→N2,可知每生成1 mol N2,转移6 mol电子,需要消耗2 mol Al,故消耗2.7 g (0.1 mol)Al时,转移0.3 mol电子,生成0.05 mol N2,换算成标准状况下的体积为1.12 L,正确。 答案 C 11.用惰性电极电解NaHSO3溶液可以得到硫酸,装置如图所示。 电解过程中①②③④处的生成物依次是( )。 A.硫酸、氧气和二氧化硫、氢气、亚硫酸钠 B.硫酸、氢气、氧气和二氧化硫、亚硫酸钠 C.亚硫酸钠、氧气和二氧化硫、氢气、硫酸 D.亚硫酸钠、氢气、氧气和二氧化硫、硫酸 解析 阴极区存在电离平衡HSO3-SO32-+H+,阴极的电极反应式为2H++2e-H2↑,c(H+)减小,促使HSO3-的电离平衡正向移动,所以①处的生成物为Na2SO3,②处的生成物为H2;阴极区生成的SO32-部分通过阴离子交换膜进入阳极区,部分与加入的H2SO4反应生成SO2逸出,阳极的电极反应式为4OH--4e-O2↑+2H2O,生成的O2将另一部分SO32-氧化生成SO42-,所以③处的生成物为O2和SO2,④处的生成物为H2SO4。 答案 D 12.(2018年重庆巴蜀中学二模)NaClO2是重要的消毒剂和漂白剂,可用如图所示装置制备。下列说法正确的是( )。 A.b极为电源负极 B.阳极区溶液的pH增大 C.D电极的电极反应式为ClO2+e- ClO2- D.E电极上生成标准状况下22.4 L气体时,理论上阴极区溶液质量增加135 g 解析 D极区通入的ClO2发生还原反应生成ClO2-,则D极区为阴极区,a为电源的负极,b为电源正极,A项错误;阳极区为溶液中的Cl-失电子,被氧化生成氯气,部分氯气会溶于水中使阳极区溶液的pH减小,B项错误;D电极上发生还原反应的电极反应式为ClO2+e-ClO2-,C项正确;E电极上生成标准状况下22.4 L氯气时,转移2 mol电子,阴极发生还原反应的ClO2的物质的量为2 mol,阴极区溶液质量增加135 g,但由于阳极区的Na+会向阴极区移动,故理论上阴极区质量增加应大于135 g,D项错误。 答案 C 13.对工业废水和生活污水进行处理是防止水体污染、改善水质的主要措施。 (1)含乙酸钠和对氯苯酚()的废水可以通过构成微生物电池除去,其原理如图所示。 ①B是电池的 (填“正”或“负”)极; ②A极的电极反应式为 。 (2)电渗析法处理厨房垃圾发酵液,同时得到乳酸的原理如图所示(图中“HA”表示乳酸分子,A-表示乳酸根离子)。 ①阳极的电极反应式为 。 ②简述浓缩室中得到浓乳酸的原理: 。 ③电解过程中,采取一定的措施可控制阴极室的pH为6~8,此时进入浓缩室的OH-可忽略不计。 400 mL 10 g·L-1乳酸溶液通电一段时间后,浓度增至145 g·L-1(溶液体积变化忽略不计),则阴极上产生的H2在标准状况下的体积约为 L(乳酸的摩尔质量为90 g·mol-1)。 答案 (1)①负 ②+H++2e-+Cl- (2)①4OH--4e-2H2O+O2↑ ②阳极上OH-放电,c(H+)增大,H+从阳极室通过阳离子交换膜进入浓缩室,同时A-通过阴离子交换膜从阴极室进入浓缩室,发生反应H++A-HA,乳酸浓度增大 ③6.72查看更多