- 2021-04-21 发布 |
- 37.5 KB |
- 5页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2020高中化学 每日一题之快乐暑假 第09天 甲烷的分子结构(含解析)新人教版
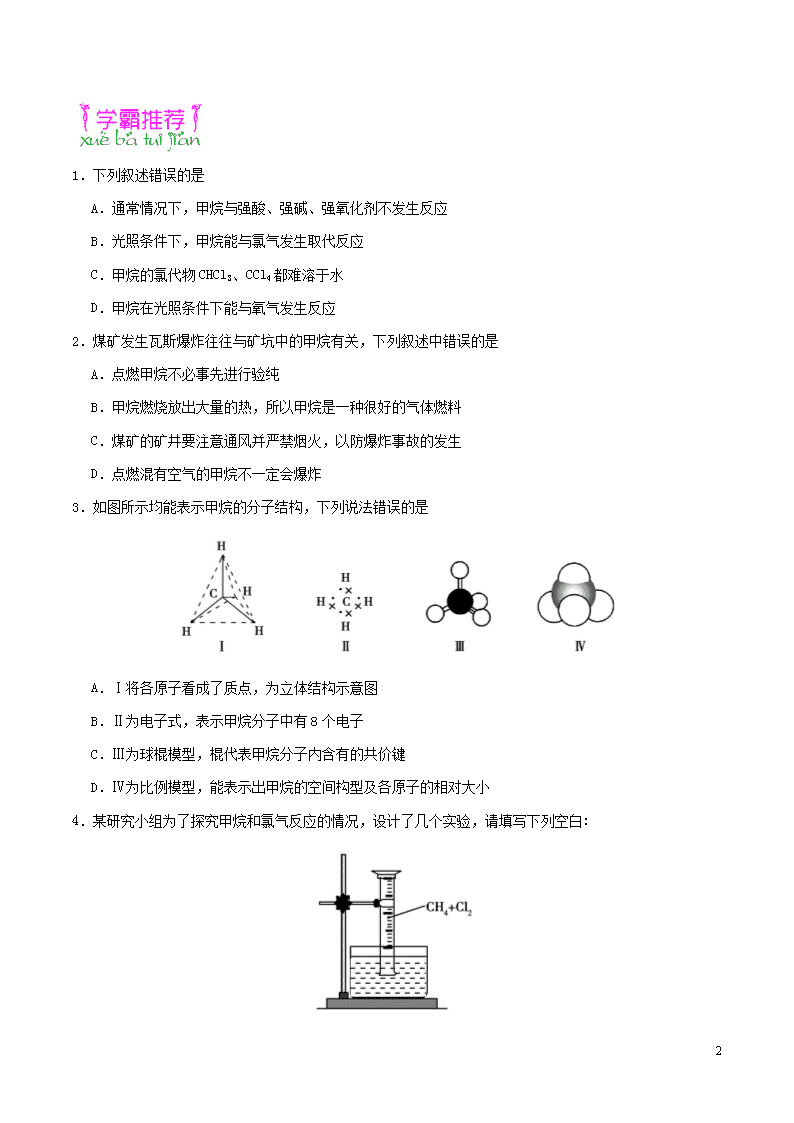
第09天 甲烷的分子结构 高考频度:★★★☆☆ 难易程度:★★☆☆☆ 光照条件下,下列各组混合物中几乎没有发生反应的是 A.甲烷和溴蒸气 B.氢气和氯气 C.甲烷和氧气 D.甲烷和氯气 【参考答案】C 【试题解析】甲烷与氧气反应的条件是点燃。 (1)组成与结构 名称 分子式 电子式 结构式 分子模型 甲烷 CH4 (2)空间结构 ①分子结构示意图 ②结构特点及空间构型 具有正四面体结构,其中,4个C—H键的长度和强度相同,夹角相等;碳原子位于正四面体的中心,4个氢原子位于4个顶点。 甲烷分子中4个C—H键相同,在空间可能有两种对称分布即正四面体结构和平面正方形结构。假设甲烷是平面正方形结构,则CH2Cl2分子中的5个原子必在同一平面上,应有两种结构:、。若CH2Cl2有两种结构,则必然有熔、沸点等物理性质不同的两种物质,而科学研究发现,CH2Cl2只有一种熔、沸点。故甲烷为正四面体结构。 5 1.下列叙述错误的是 A.通常情况下,甲烷与强酸、强碱、强氧化剂不发生反应 B.光照条件下,甲烷能与氯气发生取代反应 C.甲烷的氯代物CHCl3、CCl4都难溶于水 D.甲烷在光照条件下能与氧气发生反应 2.煤矿发生瓦斯爆炸往往与矿坑中的甲烷有关,下列叙述中错误的是 A.点燃甲烷不必事先进行验纯 B.甲烷燃烧放出大量的热,所以甲烷是一种很好的气体燃料 C.煤矿的矿井要注意通风并严禁烟火,以防爆炸事故的发生 D.点燃混有空气的甲烷不一定会爆炸 3.如图所示均能表示甲烷的分子结构,下列说法错误的是 A.Ⅰ将各原子看成了质点,为立体结构示意图 B.Ⅱ为电子式,表示甲烷分子中有8个电子 C.Ⅲ为球棍模型,棍代表甲烷分子内含有的共价键 D.Ⅳ为比例模型,能表示出甲烷的空间构型及各原子的相对大小 4.某研究小组为了探究甲烷和氯气反应的情况,设计了几个实验,请填写下列空白: 5 【实验一】 用如图所示装置,收集一试管甲烷和氯气的混合气体, 光照后观察到量筒内形成一段水柱,认为有氯化氢生成。 (1)该反应的反应类型为 ,反应的化学方程式为 (只写第一步)。 (2)水槽中盛放的液体应为 (填序号)。 A.水 B.饱和石灰水 C.饱和食盐水 D.饱和NaHCO3溶液 【实验二】 收集一试管甲烷和氯气的混合气体,光照反应后,滴加AgNO3溶液,看到有白色沉淀生成,认为有氯化氢生成。 (3)该实验设计的错误之处是 。 【实验三】 步骤一:收集半试管氯气,加入10 mL 蒸馏水,充分振荡,用仪器测得溶液的pH=3.26。 步骤二:收集一试管甲烷和氯气的混合气体(各占50%),在40 W的日光灯下光照6 min后,加入10 mL 蒸馏水,充分振荡,用仪器测得pH=1.00。 (4)判断该反应中有氯化氢生成的依据是 。 步骤三:用5支试管充满甲烷和氯气的混合气体(各占50%),分别放在40 W的日光灯下光照不同时间后,加入10 mL 蒸馏水,充分振荡,测得pH如下表: 编号 1 2 3 4 5 光照时间 2 min 4 min 6 min 8 min 10 min 反应后pH 1.86 1.62 1.00 1.00 1.00 (5)该实验可得到结论: 。 步骤四:探究不同光照条件对甲烷与氯气反应的影响。 (6)试设计一个可行的实验方案:_________________________________________________________。 1.【答案】D 5 2.【答案】A 【解析】如果甲烷中混有空气,点燃时可能会发生爆炸,因此点燃之前必须验纯。 3.【答案】B 【解析】Ⅱ表示电子式,但略去了碳原子的内层电子,甲烷分子中应含有10个电子。 4.【答案】(1)取代反应 CH4+Cl2CH3Cl+HCl (2)C (3)氯水中加入AgNO3溶液也会产生白色沉淀,从而无法确定反应中有氯化氢生成 (4)步骤二测得的pH的具体值比步骤一的低 (5)相同条件下,一定时间内,光照时间越长,甲烷与氯气反应的越充分,生成的HCl越多(其他合理答案也可) (6)用5支试管充满甲烷和氯气的混合气体(各占50%),分别放在不同功率的日光灯下照射相同时间后,加入10 mL 蒸馏水,充分振荡,测pH 【解析】(1)CH4在光照下与Cl2发生取代反应生成CH3Cl等,第一步反应方程式为CH4+Cl2CH3Cl+HCl。 (2)由于量筒中的Cl2能与水、饱和石灰水、饱和NaHCO3溶液反应,所以水槽中盛放的液体应为饱和食盐水。 (3)该实验的目的是通过AgNO3溶液来验证HCl的生成,但由于Cl2溶解在水中时也会产生Cl-,从而无法确定生成的白色AgCl沉淀是否是由于生成HCl引起的,所以该实验设计存在错误。 (4)步骤一、二中氯气体积相同,氯气溶于水中生成HCl、HClO,HClO是弱酸,且Cl2与H2O不能完全反应,所以步骤一测定出的pH=3.26。步骤二中测定出溶液的pH=1.00<3.26,说明步骤二中产生的酸的浓度更大,即步骤二中CH4与Cl2发生了取代反应而生成了HCl。 (5)从表中数据可以看出,随着时间的推移,反应后所得溶液的pH逐渐变小,说明甲烷与氯气反应的光照时间越长,甲烷取代反应的转化率越高。从表中数据还可看出,6 min、8 min、10 min时所得溶液pH相同,说明6 min后CH4与Cl2反应发生完全。 (6)类比步骤三的方法,步骤三是时间为变量,步骤四用光照强度为变量,从而可设计出相应的方案。 5 你正走在学霸的路上! _____________________________________________________________________________ _____________________________________________________________________________ _____________________________________________________________________________ _____________________________________________________________________________ _____________________________________________________________________________ _____________________________________________________________________________ _____________________________________________________________________________ _____________________________________________________________________________ _____________________________________________________________________________ 5查看更多