- 2024-05-07 发布 |
- 37.5 KB |
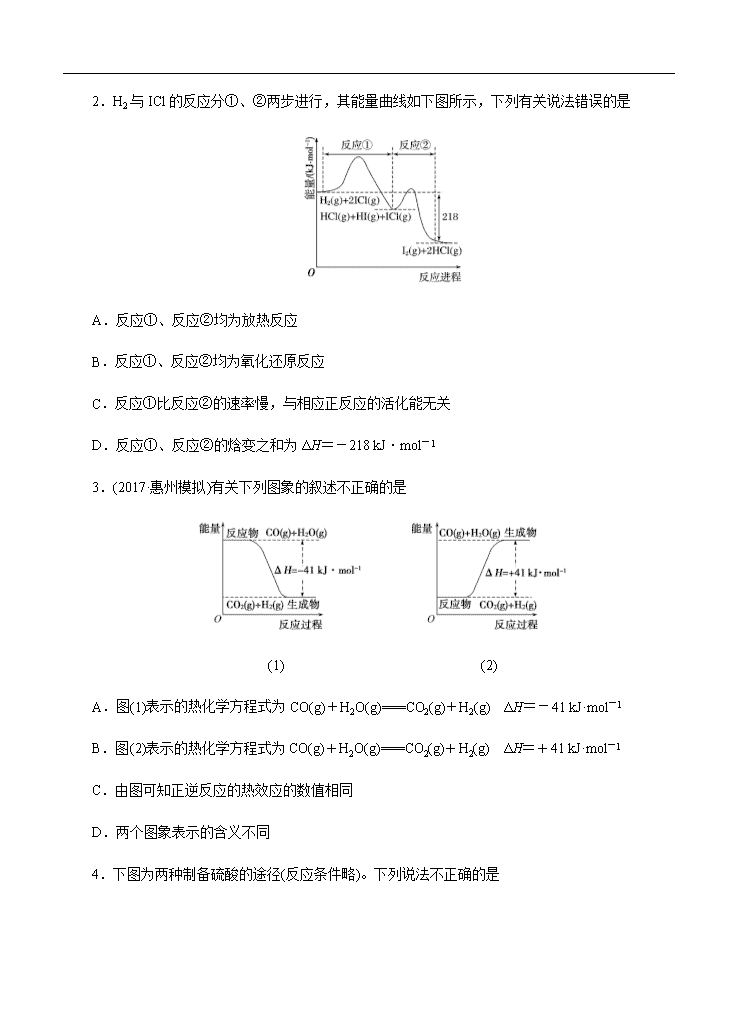
- 19页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
高三化学一轮单元卷:第九单元 化学反应与能量 A卷
一轮单元训练金卷·高三·化学卷(A) 第九单元 化学反应与能量 注意事项: 1.答题前,先将自己的姓名、准考证号填写在试题卷和答题卡上,并将准考证号条形码粘贴在答题卡上的指定位置。 2.选择题的作答:每小题选出答案后,用2B铅笔把答题卡上对应题目的答案标号涂黑,写在试题卷、草稿纸和答题卡上的非答题区域均无效。 3.非选择题的作答:用签字笔直接答在答题卡上对应的答题区域内。写在试题卷、草稿纸和答题卡上的非答题区域均无效。 4.考试结束后,请将本试题卷和答题卡一并上交。 一、选择题(每小题3分,共48分) 1.为消除目前燃料燃烧时产生的环境污染,同时缓解能源危机,有关专家提出了利用太阳能制取氢能的构想。下列说法正确的是 A.H2O的分解反应是放热反应 B.氢能源已被普遍使用 C.2 mol 液态H2O具有的总能量低于2 mol H2和1 mol O2的能量 D.氢气不易贮存和运输,无开发利用价值 2.H2与ICl的反应分①、②两步进行,其能量曲线如下图所示,下列有关说法错误的是 A.反应①、反应②均为放热反应 B.反应①、反应②均为氧化还原反应 C.反应①比反应②的速率慢,与相应正反应的活化能无关 D.反应①、反应②的焓变之和为ΔH=-218 kJ·mol-1 3.(2017·惠州模拟)有关下列图象的叙述不正确的是 (1) (2) A.图(1)表示的热化学方程式为CO(g)+H2O(g)===CO2(g)+H2(g) ΔH=-41 kJ·mol-1 B.图(2)表示的热化学方程式为CO(g)+H2O(g)===CO2(g)+H2(g) ΔH=+41 kJ·mol-1 C.由图可知正逆反应的热效应的数值相同 D.两个图象表示的含义不同 4.下图为两种制备硫酸的途径(反应条件略)。下列说法不正确的是 A.途径②增大O2浓度可提高SO2转化率 B.含1 mol H2SO4的浓溶液与足量NaOH反应,放出的热量即为中和热 C.途径②中SO2和SO3均属于酸性氧化物 D.若ΔH1<ΔH2+ΔH3,则2H2O2(aq)===2H2O(l)+O2(g)为放热反应 5.(2017·珠海模拟)已知:2H2(g)+O2(g)===2H2O(g) ΔH1 3H2(g)+Fe2O3(s)===2Fe(s)+3H2O(g) ΔH2 2Fe(s)+O2(g)===Fe2O3(s) ΔH3 2Al(s)+O2(g)===Al2O3(s) ΔH4 2Al(s)+Fe2O3(s)===Al2O3(s)+2Fe(s) ΔH5 下列关于上述反应焓变的判断正确的是 A.ΔH1<0,ΔH3>0 B.ΔH5<0,ΔH4<ΔH3 C.ΔH1=ΔH2+ΔH3 D.ΔH3=ΔH4+ΔH5 6.(2018·枣阳一中月考)BeCl2是有机反应的催化剂。铍和氯气反应的能量变化如图所示。下列说法正确的是 A.E2是正反应的活化能 B.该反应的ΔH<0 C.加入催化剂,ΔH减小 D.ΔH=E2-E1 7.(2018届河北石家庄辛集中学期中)已知: 2CO(g)+O2(g)===2CO2(g) ΔH=-566 kJ·mol-1 Na2O2(s)+CO2(g)===Na2CO3(s)+O2(g) ΔH=-226 kJ·mol-1 根据以上热化学方程式判断,下列说法正确的是 A.CO的燃烧热为283 kJ B.下图可表示由CO生成CO2的反应过程和能量关系 C.2Na2O2(s)+2CO2(s)===2Na2CO3(s)+O2(g) ΔH>-452 kJ·mol-1 D.CO(g)与Na2O2(s)反应放出509 kJ热量时,转移电子数为6.02×1023 8.下列有关能量的判断和表示方法正确的是 A.由C(s,石墨)===C(s,金刚石) ΔH=+1.9 kJ·mol-1,可知:石墨比金刚石更稳定 B.等质量的硫蒸气和硫固体分别完全燃烧,后者放出的热量更多 C.由H+(aq)+OH-(aq)===H2O(l) ΔH=-57.3 kJ·mol-1,可知:含1 mol CH3COOH 的溶液与含1 mol NaOH的溶液混合,放出热量等于57.3 kJ D.2 g H2完全燃烧生成液态水放出285.8 kJ热量,则氢气燃烧的热化学方程式为2H2(g)+O2(g)===2H2O(l) ΔH=-285.8 kJ 9.参考下表键能数据,估算晶体硅在氧气中燃烧生成的二氧化硅晶体的热化学方程式:Si(s)+O2(g)===SiO2(s)中,ΔH的值为 化学键 Si-O O=O Si-Si Si-Cl Si-C 键能/(kJ·mol-1) 460 498.8 176 360 347 A.-989.2 kJ·mol-1 B.+989.2 kJ·mol-1 C.-61.2 kJ·mol-1 D.-245.2 kJ·mol-1 10.(2018·太原五中月考)燃烧a g C2H5OH(l),生成二氧化碳气体和液态水,放出的热量为Q kJ,经测定,生成的CO2与足量澄清石灰水反应得到5 g沉淀,则表示乙醇燃烧的热化学方程式是 A.C2H5OH(l)+3O2(g)===2CO2(g)+3H2O(l) ΔH=-20Q kJ·mol-1 B.C2H5OH(l)+3O2(g)===2CO2(g)+3H2O(l) ΔH=-40Q kJ·mol-1 C.C2H5OH(l)+O2(g)===CO2(g)+H2O(g) ΔH=-20Q kJ·mol-1 D.C2H5OH(l)+3O2(g)===2CO2(g)+3H2O(g) ΔH=-40Q kJ·mol-1 11.油酸甘油酯(相对分子质量884)在体内代谢时可发生如下反应: C57H104O6(s)+80O2(g)===57CO2(g)+52H2O(l) 已知燃烧1 kg该化合物释放出热量3.8×104 kJ。油酸甘油酯的燃烧热ΔH为 A.3.8×104 kJ·mol-1 B.-3.8×104 kJ·mol-1 C.3.4×104 kJ·mol-1 D.-3.4×104 kJ·mol-1 12.已知H2O2 在催化剂作用下分解速率加快,其能量随反应进程的变化如图所示。下列说法正确的是 A.加入催化剂,减小了反应的热效应 B.加入催化剂,可提高H2O2的平衡转化率 C.H2O2分解的热化学方程式:H2O2===H2O+O2 ΔH<0 D.反应物的总能量高于生成物的总能量 13.最新报道:科学家首次用X射线激光技术观察到CO与O在催化剂表面形成化学键的过程。反应过程的示意图如下: 下列说法正确的是 A.CO和O生成CO2是吸热反应 B.在该过程中,CO断键形成C和O C.CO和O形成了具有极性共价键的CO2 D.状态Ⅰ→状态Ⅲ表示CO与O2反应的过程 14.黑火药是中国古代的四大发明之一,其爆炸的热化学方程式为S(s)+2KNO3(s)+3C(s)===K2S(s)+N2(g)+3CO2(g) ΔH= x kJ·mol-1。 已知:碳的燃烧热ΔH1=a kJ·mol-1 S(s)+2K(s)===K2S(s) ΔH2=b kJ·mol-1 2K(s)+N2(g)+3O2(g)===2KNO3(s) ΔH3=c kJ·mol-1 则x为 A.3a+b-c B.c-3a-b C.a+b-c D.c-a-b 15.已知下列热化学方程式: (1)CH3COOH(l)+2O2(g)===2CO2(g)+2H2O(l) ΔH1=-870.3 kJ·mol-1 (2)C(s)+O2(g)===CO2(g) ΔH2=-393.5 kJ·mol-1 (3)H2(g)+O2(g)===H2O(l) ΔH3=-285.8 kJ·mol-1 则反应2C(s)+2H2(g)+O2(g)===CH3COOH(l)的ΔH为 A.-488.3 kJ·mol-1 B.-244.15 kJ·mol-1 C.+488.3 kJ·mol-1 D.+244.15 kJ·mol-1 16.(2018届江西赣州十四校联考)下列说法正确的是 A.常温下,反应C(s)+CO2(g)===2CO(g)不能自发进行,则该反应的ΔH>0 B.已知2CO(g)+O2(g)===2CO2(g) ΔH=-566 kJ·mol-1,则CO的燃烧热ΔH=-283 kJ C.已知H+(aq)+OH-(aq)===H2O(l) ΔH=-57.3 kJ·mol-1,则稀H2SO4溶液和稀Ba(OH)2溶液反应的反应热ΔH=2×(-57.3) kJ·mol-1 D.500 ℃、30 MPa下,将0.5 mol N2和1.5 mol H2置于密闭的容器中充分反应生成NH3(g),放热19.3 kJ,热化学方程式为N2(g)+3H2(g)2NH3(g) ΔH=-38.6 kJ·mol-1 二、非选择题(共52分) 17.Ⅰ.已知下列反应: SO2(g)+2OH- (aq) ===SO (aq)+H2O(l) ΔH1 ClO- (aq)+SO(aq)===SO(aq)+Cl-(aq) ΔH2 CaSO4(s)===Ca2+(aq)+SO(aq) ΔH3 则反应SO2(g)+Ca2+(aq)+ClO-(aq)+2OH- (aq) === CaSO4(s)+H2O(l)+Cl- (aq)的ΔH=________________。 Ⅱ.①2O2(g)+N2(g)===N2O4(l) ΔH1 ②N2(g)+2H2(g)===N2H4(l) ΔH2 ③O2(g)+2H2(g)===2H2O(g) ΔH3 ④2N2H4(l)+N2O4(l)===3N2(g)+4H2O(g) ΔH4=-1 048.9 kJ·mol-1 上述反应热效应之间的关系式为ΔH4=____________,联氨和N2O4可作为火箭推进剂的主要原因为_______________________________________________________________。 Ⅲ.甲醇既是重要的化工原料,又可作为燃料,利用合成气(主要成分为CO、CO2和H2)在催化剂作用下合成甲醇。发生的主要反应如下: ①CO(g)+2H2(g) CH3OH(g) ΔH1 ②CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH2 ③CO2(g)+H2(g) CO(g)+H2O(g) ΔH3 已知反应①中相关的化学键键能数据如下: 化学键 H—H C—O H—O C—H E/(kJ·mol-1) 436 343 1 076 465 413 由此计算ΔH1=________kJ·mol-1;已知ΔH2=-58 kJ·mol-1,则ΔH3=________kJ·mol-1。 18.催化剂是化工技术的核心,绝大多数的化工生产均需采用催化工艺。 (1)①人们常用催化剂来选择反应进行的方向。下图所示为一定条件下1 mol CH3OH与O2发生反应时,生成CO、CO2或HCHO的能量变化图[反应物O2(g)和生成物H2O(g)略去]。在有催化剂作用下,CH3OH与O2反应主要生成________(填“CO”“CO2”或“HCHO”)。 ②2HCHO(g)+O2(g)===2CO(g)+2H2O(g) ΔH=________。 (2)反应A(g)+B(g) C(g)+D(g)过程中的能量变化如图所示,回答下列问题: ①该反应是________(填“吸热”或“放热”)反应。 ②在反应体系中加入催化剂,反应速率增大,E1和E2的变化:E1__________(填“增大”“减小”或“不变”,下同),E2________。 ③反应体系中加入催化剂对反应热是否有影响?________,原因是_______________________________________________________。 19.(1)在一定条件下N2与H2反应生成NH3,请回答: ①若反应物的总能量为E1,生成物的总能量为E2,且E1>E2,则该反应为________(填“吸热”或“放热”)反应。 ②已知拆开1 mol H—H键、1 mol N—H键、1 mol N≡N键分别需要的能量是436 kJ、391 kJ、946 kJ,则N2与H2反应生成NH3的热化学方程式为_____________________________。 (2)N2H4和H2O2混合可作火箭推进剂,已知:16 g液态N2H4和足量氧气反应生成N2(g)和H2O(l),放出310.6 kJ 的热量;2H2O2(l)===O2(g)+2H2O(l) ΔH=-196.4 kJ·mol-1。反应N2H4(l)+O2(g)===N2(g)+2H2O(l)的ΔH=________kJ·mol-1。N2H4和H2O2反应生成N2(g)和H2O(l)的热化学方程式为__________________________________________。 (3)实验室用50 mL 0.50 mol·L-1盐酸与50 mL某浓度的NaOH溶液在如图所示装置中反应,通过测定反应过程中所放出的热量可计算中和热。该装置有一处明显的错误,该处错误是缺少一种玻璃仪器,该仪器的名称为______________________;实验室提供了0.50 mol·L-1和0.55 mol·L-1两种浓度的NaOH溶液,应选择______ mol·L-1的溶液进行实验。 20.碳是形成化合物种类最多的元素,其单质及化合物是人类生产生活的主要能源物质。请回答下列问题: (1)有机物M经过太阳光光照可转化成N,转化过程如下:ΔH=+88.6 kJ/mol则M、N相比,较稳定的是________。 (2)已知CH3OH(l)的燃烧热ΔH=-238.6 kJ/mol,CH3OH(l)+O2(g)===CO2(g)+2H2(g) ΔH=-a kJ/mol,则a________238.6(填“>”“<”或“=”)。 (3)使Cl2和H2O(g)通过灼热的炭层,生成HCl和CO2,当有1 mol Cl2参与反应时释放出145 kJ热量,写出该反应的热化学方程式:__________________________________________________。 (4)火箭和导弹表面的薄层是耐高温物质。将石墨、铝粉和二氧化钛按一定比例混合在高温下煅烧,所得物质可作耐高温材料,4Al(s)+3TiO2(s)+3C(s)===2Al2O3(s)+3TiC(s) ΔH=-1 176 kJ/mol,则反应过程中,每转移1 mol电子放出的热量为________。 21.(1)有关研究需要得到反应C3H8(g)===3C(石墨,s)+4H2(g)的ΔH,但测定实验难进行。设计下图可计算得到: ①ΔH______0(填“>”“<”或“=”)。 ②ΔH=____________________(用图中其他反应的反应热表示)。 (2)已知在压强为a MPa下,该反应在不同温度、不同投料比时,CO2的转化率如下图所示。若在a MPa和500 K时,2 mol H2和1 mol CO2在某密闭容器中反应达到平衡,此过程中容器与外界的热交换总量为0.3Q kJ。请补充完整热化学方程式:CO2转化为二甲醚的反应为2CO2(g)+6H2(g)CH3OCH3(g)+3______(g) ΔH=________。 22.联氨可用作火箭燃料,回答下列问题: (1)在发射“神舟”十一号的火箭推进器中装有肼(N2H4)和过氧化氢,当两者混合时即产生气体,并放出大量的热。 已知:N2H4(l)+2H2O2(l)===N2(g)+4H2O(g) ΔH=-641.6 kJ·mol-1; H2O(l)===H2O(g) ΔH=+44.0 kJ·mol-1 若用6.4 g液态肼与足量过氧化氢反应生成氮气和液态水,则整个过程中放出的热量为________。 (2)“嫦娥二号”卫星使用液态四氧化二氮和液态偏二甲肼(C2H8N2)作推进剂。N2O4与偏二甲肼燃烧产物只有CO2(g)、H2O(g)、N2(g),并放出大量热,已知10.0 g液态偏二甲肼与液态四氧化二氮完全燃烧可放出425 kJ热量,该反应的热化学方程式为________________________________________________________________________。 (3)火箭的常规燃料是液态四氧化二氮和液态肼(N2H4),N2O4作氧化剂,有人认为若用氟气代替四氧化二氮作氧化剂,反应释放的能量更大(两者反应生成氮气和氟化氢气体)。 已知: ①N2H4(l)+O2(g)===N2(g)+2H2O(g)ΔH=-534.0 kJ·mol-1 ②H2(g)+F2(g)===HF(g)ΔH=-269.0 kJ·mol-1 ③H2(g)+O2(g)===H2O(g) ΔH=-242.0 kJ·mol-1 请写出肼和氟气反应的热化学方程式:_____________________________________。 (4)已知:①H2(g)===H2(l) ΔH=-0.92 kJ·mol-1 ②O2(g)===O2(l) ΔH=-6.84 kJ·mol-1 ③H2O(l)===H2O(g) ΔH=+44.0 kJ·mol-1 ④H2(g)+O2(g)===H2O(l) ΔH=-285.8 kJ·mol-1 请写出液氢和液氧生成气态水的热化学方程式:____________________________。 一轮单元训练金卷·高三·化学卷(A) 第九单元 化学反应与能量 答 案 一、选择题(每小题3分,共48分) 1.【答案】C 【解析】2H2O(l)===2H2(g)+O2(g)是吸热反应,说明2 mol 液态H2O的能量低于2 mol H2和1 mol O2的能量。因由水制取H2耗能多且H2不易贮存和运输,所以氢能源利用并未普及,但发展前景广阔。 2.【答案】C 【解析】根据图象可知,反应①和反应②中反应物总能量都大于生成物,则反应①、②均为放热反应,A正确;反应①、②中都存在元素化合价变化,所以反应①、②都是氧化还原反应,B正确;反应①比反应②的速率慢,说明反应①中正反应的活化能较大,反应②中正反应的活化能较小,C错误;反应①、反应②总的能量变化为218 kJ,根据盖斯定律可知,反应①、反应②的焓变之和为ΔH =-218 kJ·mol-1,D正确。 3.【答案】B 【解析】图(1)表示CO(g)+H2O(g)===CO2(g)+H2(g) ΔH=-41 kJ·mol-1,A正确;图(2)表示的热化学方程式为CO2(g)+H2(g)===CO(g)+H2O(g) ΔH=+41 kJ·mol-1,B错误;由图知C正确;两个图象的反应物、生成物正好相反,D正确。 4.【答案】B 【解析】增大一种反应物的浓度可以增大另一种反应物的转化率,故A正确;中和热的定义为强酸与强碱的稀溶液混合生成1 mol水放出的热量,含1 mol H2SO4的浓溶液与足量NaOH反应生成2 mol水,且浓溶液溶于水放热,故B错误;二氧化硫与三氧化硫均属于酸性氧化物,故C正确;ΔH1-(ΔH2+ΔH3)<0,故为放热反应,故D正确。 5.【答案】B 【解析】燃烧反应都是放热反应,故ΔH3<0,A错误;将上述反应分别编号为①②③④⑤,反应⑤是铝热反应,显然是放热反应,ΔH5<0,将反应④-反应③可得反应⑤,即ΔH5=ΔH4-ΔH3<0,B正确、D错误;将反应②+反应③可得反应3H2(g)+O2(g)===3H2O(g),故ΔH1=(ΔH2+ΔH3),C错误。 6.【答案】B 【解析】E1是正反应活化能,E2是逆反应活化能,A项错误;该反应是放热反应,B项正确;加入催化剂,减小E2和E1,不改变ΔH,C项错误;ΔH=E1-E2,D项错误。 7.【答案】C 【解析】A项,CO的燃烧热为283 kJ·mol-1,故A错误;B项,CO和CO2的化学计量数不对且未标明物质状态,故B错误;C项,题目中第二个热化学方程式乘以2为2Na2O2(s)+2CO2(g)===2Na2CO3(s)+O2(g) ΔH=-452 kJ·mol-1,本选项中多一步CO2(s)气化吸热的过程,所以放出的热量就少于452 kJ,即ΔH>-452 kJ·mol-1,故C正确;D项, 将题目中第一个热化学方程式除以2再加上第二个热化学方程式可得:Na2O2(s)+CO(g)===Na2CO3(s) ΔH=-509 kJ·mol-1,放热509 kJ时,反应的CO是1 mol,所以转移电子数是2×6.02×1023,故D错误。 8.【答案】A 【解析】石墨转化为金刚石的过程是吸热反应,金刚石能量高,石墨比金刚石稳定,A正确;等质量的硫蒸气和硫固体分别完全燃烧,固体硫变为蒸气需要吸收热量,前者放出热量更多,B错误;含1 mol CH3COOH的溶液与含1 mol NaOH的溶液混合,醋酸为弱酸,溶于水电离需要吸热,放出热量小于57.3 kJ,C错误;2 g H2的物质的量为1 mol,此反应为放热反应,ΔH<0,故氢气燃烧的热化学方程式为2H2(g)+O2(g)===2H2O(l) ΔH=2×(-285.8 kJ·mol-1)=-571.6 kJ·mol-1,D错误。 9.【答案】A 【解析】硅和二氧化硅均是原子晶体,其中在晶体硅中每个硅原子形成4÷2=2个Si—Si键,在二氧化硅晶体中每个硅原子形成4个Si—O键。由于反应热等于断键吸收的能量与形成化学键所放出的能量的差值,则该反应的反应热ΔH=2×176 kJ·mol-1+498.8 kJ·mol-1-4×460 kJ·mol-1=-989.2 kJ·mol-1,故选A。 10.【答案】B 【解析】由关系式:CaCO3~CO2~C2H5OH可知,a g 乙醇的物质的量为n(CaCO3)=0.025 mol,所以1 mol C2H5OH(l)燃烧生成二氧化碳气体和液态水,放出的热量是40Q kJ,热化学方程式为C2H5OH(l)+3O2(g)===2CO2(g)+3H2O(l) ΔH=-40Q kJ·mol-1。 11.【答案】D 【解析】燃烧热是指1 mol可燃物完全燃烧生成稳定的氧化物所放出的热量。燃烧1 kg该化合物释放出热量3.8×104 kJ,则1 mol油酸甘油酯完全燃烧生成稳定的氧化物所放出的热量为×1 mol×884 g·mol-1=3.4×104 kJ,所以ΔH=-3.4×104 kJ·mol-1。 12.【答案】D 【解析】 加入催化剂,减小了反应的活化能,使反应在较低的温度下发生,但是反应的热效应不变,A项错误;加入催化剂,可提高H2O2分解的反应速率,但不能改变平衡状态,对转化率无影响,B项错误;热化学方程式要符合质量守恒定律,且要注明聚集状态,C项错误;根据图示可知反应物的总能量高于生成物的总能量,该反应是放热反应,D项正确。 13.【答案】C 【解析】A.状态Ⅰ总能量为反应物总能量,状态Ⅲ总能量为生成物总能量,由图示知反应物的总能量大于生成物的总能量,故该反应为放热反应。B.从状态Ⅰ、Ⅱ、Ⅲ的图示可以看出,反应中CO并未断裂成C和O,C、O原子间一直有化学键。C.由图示可以看出,CO和O生成了CO2,CO2分子中C与O形成极性共价键。D.状态Ⅰ→状态Ⅲ表示CO与O反应生成CO2的过程,并不是CO与O2反应的过程。 14.【答案】A 【解析】已知碳的燃烧热为ΔH1=a kJ·mol-1,则表示碳燃烧热的热化学方程式为①C(s)+O2(g)===CO2 (g) ΔH1=a kJ·mol-1,将另外两个热化学方程式进行编号,②S(s)+2K(s) ===K2S(s) ΔH2=b kJ·mol-1,③2K(s)+N2(g)+3O2(g)===2KNO3(s) ΔH3= c kJ·mol-1,根据盖斯定律,由①×3+②-③得ΔH=3ΔH1+ΔH2-ΔH3,即x=3a+b-c。 15.【答案】A 【解析】根据已知的反应可知,(2)×2+(3)×2-(1)即得到2C(s)+2H2(g)+O2(g) === CH3COOH(l),所以其反应热ΔH=-393.5 kJ·mol-1×2-285.8 kJ·mol-1×2+870.3 kJ·mol-1=-488.3 kJ·mol-1。 16.【答案】A 【解析】A项,该反应的ΔS>0,若不能自发进行,ΔH-TΔS>0,则ΔH>0,故A正确;B项,燃烧热的单位为kJ·mol-1,故B错误;C项,稀H2SO4溶液和稀Ba(OH)2 溶液反应生成硫酸钡沉淀,也要放出热量,反应热ΔH <2×(-57.3) kJ·mol-1,故C错误;D项,该反应属于可逆反应,不可能完全反应,当完全反应时,放出的热量应大于19.3 kJ,即ΔH<-38.6 kJ·mol-1,故D错误。 二、非选择题(共52分) 17.【答案】Ⅰ.ΔH1+ΔH2-ΔH3 Ⅱ.2ΔH3-2ΔH2-ΔH1 反应放热量大、产生大量气体 Ⅲ.-99 +41 【解析】Ⅰ.设三个反应依次是a、b、c,根据盖斯定律,由a+b-c得:SO2(g)+Ca2+(aq)+ClO-(aq)+2OH-(aq)===CaSO4(s)+H2O(l)+Cl-(aq) ΔH=ΔH1+ΔH2-ΔH3。 Ⅱ.根据盖斯定律,由③×2-②×2-①可得④,则ΔH4=2ΔH3-2ΔH2-ΔH1;联氨和N2O4反应释放出大量热、产物无污染、产生大量气体等,故联氨和N2O4可作为火箭推进剂。 Ⅲ.根据键能与反应热的关系可知,ΔH1=反应物的键能之和-生成物的键能之和=(1 076 kJ·mol-1+2×436 kJ·mol-1)-(413 kJ·mol-1×3+343 kJ·mol-1+465 kJ·mol-1)=-99 kJ·mol-1。 根据盖斯定律可得:ΔH3=ΔH2-ΔH1=(-58 kJ·mol-1)-(-99 kJ·mol-1)=+41 kJ·mol-1。 18.【答案】(1)①HCHO ②-470 kJ·mol-1 (2)①放热 ②减小 减小 ③否 反应物和生成物的能量差是不变的 【解析】(1)①使用催化剂可以降低反应的活化能,活化能越低,普通分子越容易转化成活化分子,反应越容易,反应速率越快,生成HCHO的活化能最低。 ②根据图表可知2HCHO(g)+O2(g)===2CO(g)+2H2O(g)中反应物能量高,生成物能量低,故该反应为放热反应,然后依据图中给出数据可得ΔH=-[(676-158-283)×2] kJ·mol-1=-470 kJ·mol-1。 (2)①反应物总能量高于生成物总能量,为放热反应。 ②反应体系中加入催化剂,降低反应所需的活化能,所以E1、E2均减小,但ΔH不变。 19.【答案】(1)①放热 ②N2(g)+3H2(g)===2NH3(g) ΔH=-92 kJ·mol-1 (2)-621.2 N2H4(l)+2H2O2(l)===N2(g)+4H2O(l) ΔH=-817.6 kJ·mol-1 (3)环形玻璃搅拌棒 0.55 【解析】(1)①若反应物的总能量为E1,生成物的总能量为E2,且E1>E2,则ΔH=E2-E1<0,该反应为放热反应。②ΔH=反应物的总键能-生成物的总键能,已知拆开1 mol H—H键、1 mol N—H键、1 mol NN键分别需要的能量是436 kJ、391 kJ、946 kJ,则N2(g)+3H2(g)===2NH3(g) ΔH=946 kJ·mol-1+3×436 kJ·mol-1-2×3×391 kJ·mol-1=-92 kJ·mol-1。(2)16 g液态N2H4和足量氧气反应生成N2(g)和H2O(l),放出310.6 kJ 的热量,故N2H4(l)和足量氧气反应的热化学方程式为N2H4(l)+O2(g)===N2(g)+2H2O(l) ΔH=-621.2 kJ·mol-1。已知:N2H4(l)+O2(g)===N2(g)+2H2O(l) ΔH=-621.2 kJ·mol-1 a,2H2O2(l)===2H2O(l)+O2(g) ΔH=-196.4 kJ·mol-1 b,根据盖斯定律,由a+b得:N2H4(l)+2H2O2(l)===N2(g)+4H2O(l) ΔH=-817.6 kJ·mol-1。(3)由题图可知该装置缺少的仪器是环形玻璃搅拌棒,应加入过量的氢氧化钠溶液以保证盐酸反应完全,故应选择0.55 mol·L-1的溶液进行实验。 20.【答案】(1)M (2)< (3)2Cl2(g)+2H2O(g)+C(s)===4HCl(g)+CO2(g) ΔH=-290 kJ/mol (4)98 kJ 【解析】(1)M转化为N是吸热反应,所以N的能量高,不稳定。 (2)甲醇燃烧生成CO2(g)和H2(g)属于不完全燃烧,放出的热量少,故a<238.6。 (3)反应的化学方程式为2Cl2(g)+2H2O(g)+C(s)===4HCl(g)+CO2(g),当有2 mol Cl2参与反应时释放出290 kJ热量,所以该反应的热化学方程式为2Cl2(g)+2H2O(g)+C(s)===4HCl(g)+CO2(g) ΔH=-290 kJ/mol。 (4)所给反应中转移12个电子,故每转移1 mol电子放出的热量为1 176 kJ÷12=98 kJ。 21.【答案】(1)①> ②ΔH1-ΔH2-ΔH3 (2)H2O -Q kJ·mol-1 【解析】(1)读图可见反应吸热,ΔH>0;读图可见-ΔH+ΔH1=ΔH2+ΔH3。(2)读图可知温度越高,CO2转化率越低,说明正反应为放热反应。当500 K、=2时,CO2的转化率为60%,放热0.3Q kJ,则当消耗2 mol CO2时放热Q kJ。 22.【答案】(1)163.52 kJ (2)C2H8N2(l)+2N2O4(l)===2CO2(g)+4H2O(g)+3N2(g) ΔH=-2 550.0 kJ·mol-1 (3)N2H4(l)+2F2(g)===N2(g)+4HF(g) ΔH=-1 126.0 kJ·mol-1 (4)H2(l)+O2(l)===H2O(g) ΔH=-237.46 kJ·mol-1 【解析】(1)6.4 g液态肼的物质的量为0.2 mol。由盖斯定律可知:液态肼与H2O2反应生成N2和液态水的热化学方程式:N2H4(l)+2H2O2(l)===N2(g)+4H2O(l) ΔH=-(641.6+4×44)kJ·mol-1=-817.6 kJ·mol-1,故0.2 mol 液态肼放出的热量为0.2 mol×817.6 kJ·mol-1=163.52 kJ。 (2)N2O4与偏二甲肼反应的产物为CO2、N2和气态水,1 mol C2H8N2(l)与N2O4完全燃烧放出的热量为×60 g=2 550.0 kJ。热化学方程式为C2H8N2(l)+2N2O4(l)===2CO2(g)+4H2O(g)+3N2(g) ΔH=-2 550.0 kJ·mol-1。 (3)根据盖斯定律,由①+②×4-③×2得: N2H4(l)+2F2(g)===N2(g)+4HF(g)ΔH=-1 126.0 kJ·mol-1。 (4)根据盖斯定律,由④+③-①-②×得: H2(l)+O2(l)===H2O(g)ΔH=-237.46 kJ·mol-1。查看更多