- 2024-04-12 发布 |
- 37.5 KB |
- 78页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
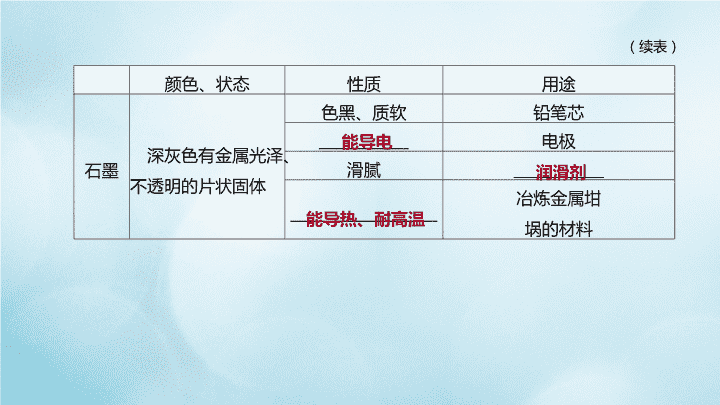
2020中考化学复习方案第一篇基础过关第09课时碳和碳的氧化物课件
第 9 课时 碳和碳的氧化物 第一篇 基础过关 颜色、状态 性质 用途 金刚石 无色、透明的正八 面体形状的固体 自然界中最硬 、作钻探机钻头 折光性强 用作装饰品 考点一 碳单质的性质和用途 1.碳单质的物理性质和用途 (1)金刚石、石墨的物理性质和用途 切割玻璃 颜色、状态 性质 用途 石墨 深灰色有金属光泽、 不透明的片状固体 色黑、质软 铅笔芯 电极 滑腻 冶炼金属坩 埚的材料 (续表) 能导热、耐高温 能导电 润滑剂 (2)无定形碳 无定形碳包括木炭、活性炭、焦炭和炭黑。木炭和 有吸附性,可用 作吸附剂。如 可作防毒面具滤毒罐里的滤毒剂、净水过滤器的吸附 材料。炭黑可用于制造油墨、鞋油、颜料、油漆等。焦炭用来冶炼金属。 (3)C60:又称“富勒烯”,新合成的碳单质,在材料科学、电子工业等方面有广阔 的应用前景。 活性炭 活性炭 2.碳单质的化学性质 (1)碳的单质在常温下化学性质 。在高温下碳能与多种物 质发生反应。 (2)可燃性(写出下列反应的化学方程式) C+O2 (O2充足) C+O2 (O2不充足) 稳定(或不活泼) CO2 2 2CO (3)还原性 木炭还原氧化铜的实验(如图9-1所示): 木炭还能与二氧化碳反应,其反应的化学方程式为 。 图9-1 碳的化学性质可用图9-2表示(即“碳三角”)。 它们之间转化的化学方程式为: ① ; ② ; ③ ; ④ 。 图9-2 考点二 一氧化碳性质和用途 1.物理性质 通常情况下,CO是一种 的气体, 溶于水,密度比空气 , 只能用 法收集。 2.化学性质 (1)可燃性:一氧化碳燃烧发出 火焰,并放出热量,生成的气体能使 变浑浊。反应的化学方程式为 。 无色无味 难 略小 排水 浅蓝色 澄清石灰水 (2)还原性(以一氧化碳还原氧化铜为例): 图9-3 现象: 。 化学方程式: 。 (3)毒性:CO有剧毒,它能跟血液中的 结合,使血红蛋白不能很好地与 O2结合,造成生物体内缺氧,严重时会危及生命。 黑色粉末变成红色,澄清石灰水变浑浊,装置末端导管口火焰的颜色为浅蓝色 血红蛋白 [注意]①在CO还原CuO的实验里,尾气中含有一定量的CO,为防止其污染空气, 应将尾气点燃或用气球收集。 ②工业上可利用CO的还原性来炼铁: Fe2O3+3CO 2Fe+3CO2。 ③防治CO中毒应从两方面进行:一使碳(或含碳燃料)充分燃烧,少产生或不产 生CO;二要注意空气的流通,经常换气。 3.一氧化碳的用途 (1)燃料。 (2)冶炼金属。 考点三 二氧化碳的性质和用途 1.物理性质 通常状况下是 色、 味的气体;密度比空气的 , 溶于 水,固态二氧化碳叫 。 无 无 大 能 干冰 2.化学性质 (1)不可燃,不助燃:不燃烧,也不 。 (2)与水反应:CO2与水反应生成 ,它可使紫色石蕊溶液变 。 反应的化学方程式为 。 (3)与可溶性碱反应:CO2通入澄清石灰水中可观察到 ,反 应的化学方程式为 ,此反应可用来检验CO2。 CO2与NaOH溶液反应的化学方程式为 ,此 反应可用来吸收CO2。 支持燃烧 碳酸 红 澄清石灰水变浑浊 3.用途 可用来 ;制碳酸饮料;植物 作用的原料;用作气体肥料等。灭火 光合 [拓展](1)干冰易升华吸热,故可用作制冷剂和用于人工降雨。 (2)实验室检验二氧化碳一般用澄清石灰水;吸收二氧化碳一般用氢氧化钠溶液。 考点四 二氧化碳的制取 1.二氧化碳的实验室制法 药品 和 (或 ) 反应原理 CaCO3+ HCl 实验 装置 ①A、B装置比较:B装置的优点是 ; B、C装置比较:C装置的优点是 稀盐酸 大理石 石灰石 2 CaCl2+H2O+CO2↑ 能随时添加液体药品 能随时控制反应的发生与停止 (续表) 实验 装置 ②B装置中长颈漏斗下端应_________________, 目的是_____________________ 。检查B装置的气密性:用弹簧夹夹住胶皮管,向长颈漏斗内 加水,若 ,说 明气密性良好 ③因为二氧化碳 、 ,所以用向上排空气 法收集,收集时导管伸入集气瓶 ,目的是 伸到液面以下 防止产生的气体从 长颈漏斗内能形成一段稳定的液柱,且一段时间后,液柱不下降 密度比空气大 能溶于水 底部 排尽集气瓶中的空气 长颈漏斗逸出 检验 将气体通入 中,若 ,说明是二氧化碳 验满 将 放在 ,若 ,则说明已收集满 选择 药品 时的 注意 事项 ①不可用稀硫酸,因为硫酸与碳酸钙反应生成 的硫酸钙 ,一段时间后反应会停止 ②一般不用浓盐酸,因为浓盐酸 ,使制得的气体中混有 杂 质 ③一般不用碳酸钠、碳酸钾等物质,因为 ,不易收集气体 (续表) 澄清石灰水 澄清石灰水变浑浊 燃着的木条 集气瓶口 木条熄灭 覆盖在大理石(或石灰石)的表面 微溶于水 易挥发 氯化氢 反应速率太快 2.工业制法 CaCO3 。 CaO+CO2↑ 考点五 自然界中的碳循环 1.碳循环 图9-4 O2 CO2 2.温室效应的危害与防治 (1)危害 地球温度上升,导致两极冰川融化,使海平面升高,淹没部分沿海城市;引起气候反 常;使土地沙漠化;影响自然生态系统,改变生物多样性等。 (2)减缓温室效应的措施 减少含碳燃料的燃烧,开发新能源,大力植树造林等。 (3)“低碳生活”是指人们生活作息时所消耗的能量尽量减少,从而降低二氧化 碳的排放。日常生活中符合“低碳生活”的做法有:采用骑自行车或步行的方式 出行;节约纸张;拒绝使用一次性木筷等。 化学方程式网络构建 图9-5 考向一 碳单质的性质和用途 1.[原创]判断下列说法是否正确(正确的打“√”,错误的打“×”)。 (1)金刚石是天然存在的最硬的物质 ( ) (2)金刚石、石墨和C60都是碳元素的单质 ( ) (3)活性炭能除去冰箱中的异味是利用了活性炭的稳定性 ( ) (4)C60是一种新型化合物 ( ) (5)金刚石、石墨和C60都是由碳原子构成的,碳原子排列方式不同,性质相同 ( ) (6)石墨具有优良的导电性,可作电极材料 ( ) (7)金刚石属于有机物,它具有可燃性 ( ) √ √ × × × √ × 1.[原创]判断下列说法是否正确(正确的打“√”,错误的打“×”)。 (8)碳具有还原性,可用于冶金工业 ( ) (9)石墨可用于制作铅笔芯是由于石墨具有优良的导电性 ( ) (10)木炭燃烧时吸收大量的热 ( ) (11)用活性炭除去冰箱中的异味是发生了化学反应 ( ) (12)石墨转化为金刚石属于物理变化 ( ) (13)金刚石和石墨均属于碳单质,所以二者性质完全相同 ( ) (14)碳在空气中充分燃烧生成CO2,不充分燃烧生成CO ( ) (15)用墨书写或绘制的字画多年不褪色是因为碳的化学性质稳定 ( ) (16)仅由碳元素组成的物质不一定是单质 ( ) √ × × × √ × × × √ 考向二 一氧化碳的性质和用途 2.[原创]判断下列说法是否正确(正确的打“√”,错误的打“×”)。 (1)CO中碳元素与氧元素的质量比为3∶4 ( ) (2)一氧化碳是无色、有毒、有刺激性气味的气体 ( ) (3)一氧化碳难溶于水,可用排水法收集 ( ) (4)一氧化碳具有可燃性,是常用的气体燃料 ( ) (5)煤气泄漏时可以闻到臭味,说明一氧化碳是一种有臭味的气体 ( ) (6)为了防止一氧化碳中毒,最好放一盆水在房间里吸收一氧化碳 ( ) (7)过多燃烧煤气会加剧温室效应 ( ) √ × √ √ √ × × 2.[原创]判断下列说法是否正确(正确的打“√”,错误的打“×”)。 (8)夜间厨房里的煤气泄漏时,应立即开灯,迅速关闭煤气开关,并打开窗户通风 ( ) (9)一氧化碳能降低血红蛋白的输氧能力,有剧毒 ( ) (10)煤气燃烧有时火焰呈黄色,那就是一氧化碳燃烧的火焰颜色 ( ) (11)一氧化碳燃烧产物是形成酸雨的主要气体 ( ) (12)检验CO时,可将CO通入澄清石灰水中 ( ) (13)炼铁时,一氧化碳与铁矿石发生了置换反应 ( ) (14)一氧化碳能使紫色石蕊溶液变为红色 ( ) √ × × × × × × 3.[2019·潍坊]如图9-6是CO与CuO反应的实验装置,下列关于该实验说法正 确的是 ( ) ①玻璃管中黑色固体变成了红色 ②CO被还原为CO2 ③玻璃管中发生的反应为置换反应 ④既有效地防止了CO对空气的污染, 又充分利用了能源 A.①② B.①④ C.②④ D.③④ 图9-6 [答案] B [解析] ①一氧化碳具有还原性,能与氧化铜反应生成铜和二氧化碳,会观察到 玻璃管中黑色固体变成了红色;②一氧化碳夺取了氧化铜中的氧,CO被氧化为 CO2;③一氧化碳与氧化铜反应生成铜和二氧化碳,该反应的反应物均为化合 物,不属于置换反应;④一氧化碳燃烧生成二氧化碳,利用一氧化碳燃烧的热量 给玻璃管加热,既有效地防止了CO对空气的污染,又充分利用了能源。 考向三 二氧化碳的性质与用途 4.[原创]判断下列关于二氧化碳的说法是否正确(正确的打“√”,错误的打 “×”)。 (1)二氧化碳是由碳原子和氧原子构成的 ( ) (2)二氧化碳可用于制碳酸类饮料 ( ) (3)二氧化碳溶于雨水形成酸雨 ( ) (4)二氧化碳和碳反应生成一氧化碳是放热反应 ( ) (5)人长时间待在二氧化碳含量过高的空间里会中毒 ( ) (6)二氧化碳可以作气体肥料 ( ) (7)二氧化碳和一氧化碳的组成元素相同,在一定条件下可以相互转化 ( ) × √ × √ × × √ 4.[原创]判断下列关于二氧化碳的说法是否正确(正确的打“√”,错误的打 “×”)。 (8)二氧化碳的过度排放会加剧温室效应,因此应禁止使用煤等燃料的燃烧( ) (9)二氧化碳通入紫色石蕊溶液,溶液变为红色,说明二氧化碳具有酸性 ( ) (10)二氧化碳不供给呼吸,也不能作为植物养料 ( ) (11)实验室常用大理石和稀硫酸制取二氧化碳 ( ) (12)干冰可用作制冷剂还可用于人工降雨 ( ) (13)通常二氧化碳密度比空气大,所以二氧化碳可用向上排空气法收集( ) (14)二氧化碳能灭火,是因为它不能燃烧、不支持燃烧、密度比空气大( ) (15)进入久未开启的菜窖之前,必须做灯火试验,是因为二氧化碳有毒 ( ) × × × × √ √ √ × 5.[2019·连云港]化学的基本特征是研究和 创造物质。试从科学家认识物质的视角认 识CO2。 (1)分类角度 CO2属于 (填字母)。 a.单质 b.氧化物 c.有机物 [答案] (1)b [解析] (1)氧化物的定义是由两种 元素组成,其中一种元素是氧元素 的化合物。CO2由C和O元素组成, 是氧化物。 5.[2019·连云港]化学的基本特征是研究和创造物质。试从科学家认识物质的视 角认识CO2。 (2)微观角度 我国研制的一种新型催化剂可将CO2和H2转化为甲醇(CH3OH)和X。若用“ ” 表示氢原子,“ ”表示氧原子,“ ”表示碳原子,该反应的微观示意图如下: 画出X分子的微观示意图: 。 图9-7 [答案] (2) [解析] (2)根据题目所给的微观示意图,化学反应方程式为CO2+3H2 CH3OH+X,结合质量守恒定律,反应前后原子个数不变,可知X为H2O。 5.[2019·连云港]化学的基本特征是研究和 创造物质。试从科学家认识物质的视角认 识CO2。 (3)性质角度 三百多年前,人们发现一些洞穴内有一种能 使燃烧的木柴熄灭的气体,后来该气体被证 实是CO2。据此推测CO2具有的化学性质 是 。 [答案] (3)不可燃、不助燃 [解析] (3)CO2能使燃烧的木柴熄 灭,说明CO2具有不可燃和不助燃 的化学性质。 5.[2019·连云港]化学的基本特征是研究和创造物质。试从科学家认识物质的视 角认识CO2。 (4)变化角度 图9-8是某同学整理的物质间转化图。实验室中常用CO2→CaCO3检验CO2气 体,写出该化学反应方程式: 。 图9-8 [答案] (4)CO2+Ca(OH)2 CaCO3↓+H2O [解析] (4)实验室用澄清石灰水检验CO2,澄清石灰水的溶质是氢氧化钙,CO2 通入澄清石灰水中能使澄清石灰水变浑浊,化学反应方程式为CO2+Ca(OH)2 CaCO3↓+H2O。 5.[2019·连云港]化学的基本特征是研究和创造物质。试从科学家认识物质的视 角认识CO2。 (5)应用角度 Ⅰ.可用图9-9所示方法自制汽水来消暑解热。 制汽水时,NaHCO3与柠檬酸反应生成柠檬酸钠、二氧化碳和水。 ①据此推测,通常条件下不能与柠檬酸反应的物质是 (填字母)。 a.镁带 b.氯化钠 c.烧碱 图9-9 ②打开汽水瓶盖时汽水会自动喷出来。说明气体在水中的溶解度与 有关 Ⅱ.Al-CO2电池是一种新型电池。 ③电池的工作原理:在O2的催化下,Al与CO2发生化合反应生成Al2(C2O4)3。写出 此反应的化学方程式: 。 [答案] (5)①b ②压强 ③2Al+6CO2 Al2(C2O4)3 [解析] (5)①柠檬酸可以跟NaHCO3反应生成二氧化碳和水,可以推测柠檬酸 具有酸性,根据酸的化学性质可知,酸可以跟氢前金属反应;酸可以与碱发生中 和反应;酸可以跟某些盐发生复分解反应,可以得知柠檬酸不能与氯化钠发生 反应。②打开汽水瓶盖,压强减小,汽水自动喷出,说明压强减小,气体溶解度减 小。③根据题目可知,反应物是铝和二氧化碳,反应条件是在催化剂氧气作用 下,生成物是Al2(C2O4)3,故该反应的化学方程式是2Al+6CO2 Al2(C2O4)3。 5.[2019·连云港]化学的基本特征是研究和创 造物质。试从科学家认识物质的视角认识CO2。 (6)环保角度 全球参与控制CO2的排放量是防止温室效应进 一步增强的根本对策。下列限制CO2排放量的 做法不合理的是 (填字母)。 a.制定旨在限制CO2排放的国际规定 b.减少化石能源的使用,开发太阳能等新能源 c.工厂通过加高烟囱直接排放含CO2的废气 [答案] (6)c [解析] (6)废气不经过处理, 直接排放,会造成空气中二氧 化碳含量增加,温室效应加剧。 考向四 探究二氧化碳的有关性质实验 6.在学习酸的化学性质之前,小芳曾用四朵紫色干燥的石蕊小花做了如图9-10 所示的四个探究实验,得出了“CO2溶于水生成酸”的结论。 图9-10 (1)请将各实验的有关内容填入下表空格中: 实验序号 Ⅰ Ⅱ Ⅲ Ⅳ 实验现象 小花变红色 小花不变色 小花不变色 小花 色 实验目的 和结论 目的:证明酸溶液 能使石蕊变红色 目的:证明水不 能使石蕊变红色 目的:证明 结论:CO2和水 反应生成酸 [答案] (1)Ⅲ:二氧化碳不能使石蕊变红色 Ⅳ:变红 [解析] (1)题中指出实验Ⅱ,水不能使石蕊变色,作为对比实验,还应排除二氧化 碳能否使石蕊变色,所以实验Ⅲ的目的是证明二氧化碳不能使石蕊变红色。 6.在学习酸的化学性质之前,小芳曾用四朵紫色干燥的石蕊小花做了如图9- 10所示的四个探究实验,得出了“CO2溶于水生成酸”的结论。 图9-10 (2)写出二氧化碳和水反应的化学方程式: 。 [答案] (2)CO2+H2O H2CO3 [解析] (2)二氧化碳和水反应的化学方程式为CO2+H2O H2CO3。 6.在学习酸的化学性质之前,小芳曾用四朵紫色干燥的石蕊小花做了如图9- 10所示的四个探究实验,得出了“CO2溶于水生成酸”的结论。 图9-10 (3)小芳若不做实验Ⅰ, (填“能”或“否”)得出CO2和水发生反应的 结论。 [答案] (3)能 [解析] (3)对照实验的目的是证明碳酸使石蕊变红色,而实验Ⅰ与对照实验没 有关系,可以不做。 6.在学习酸的化学性质之前,小芳曾用四朵紫色干燥的石蕊小花做了如图9- 10所示的四个探究实验,得出了“CO2溶于水生成酸”的结论。 图9-10 (4)小芳在上述实验探究中,采用了实验 的方法。 对照(或对比) 6.在学习酸的化学性质之前,小芳曾用四朵紫色干燥的石蕊小花做了如图9- 10所示的四个探究实验,得出了“CO2溶于水生成酸”的结论。 图9-10 (5)写出二氧化碳使石灰水变浑浊的化学方程式: 。 [答案] (5)CO2+Ca(OH)2 CaCO3↓+H2O [解析] (5)二氧化碳与澄清石灰水反应生成碳酸钙沉淀和水,反应的化学方程 式为CO2+Ca(OH)2 CaCO3↓+H2O。 考向五 一氧化碳和二氧化碳的性质对比 7.[原创]判断下列关于碳的氧化物的说法是否正确(正确的打“√”,错误的打 “×”)。 (1)通常情况下,CO2能溶于水,且能与水反应,CO难溶于水,也不与水反应( ) (2)CO和CO2的组成元素相同,所以它们的化学性质也相同 ( ) (3)CO可用于冶炼金属、作气体燃料;CO2可用于人工降雨、灭火 ( ) (4)CO2无毒,CO易与血液中的血红蛋白结合引起中毒 ( ) (5)CO2会导致“温室效应”增强;CO会形成酸雨 ( ) (6)一氧化碳和二氧化碳的化学性质不同,是因为它们的含碳量不同 ( ) (7)CO和CO2的化学性质差异很大,是因为分子的构成不同 ( ) √ × √ √ √ × × 7.[原创]判断下列关于碳的氧化物的说法是否正确(正确的打“√”,错误的打 “×”)。 (8)CO2可用作气体肥料;CO可用作气体燃料 ( ) (9)干冰(固态二氧化碳)升华时吸热,可用于灭火,降低可燃物的着火点 ( ) (10)除去CO2中的CO,可以将气体点燃 ( ) (11)CO和CO2都有毒,都是大气污染物 ( ) (12)区分一氧化碳与二氧化碳,可分别向两瓶气体中倒入氢氧化钠溶液并振荡 ( ) (13)在一定条件下二氧化碳与一氧化碳之间可以相互转化 ( ) × × × √ × √ 8.某科学兴趣小组探究某混合气体(无色无味)是否含有CO2和CO,实验仪器及 部分装置如图9-11所示。请回答下列问题。 (1)请把实验装置组装完整:混合气体→ (填导管口字母,每个装 置不重复使用)→e。 图9-11 [答案] (1)d→c→a→b [解析] (1)需要先检验混合气体中的二氧化碳,然后再检验一氧化碳转化的产 物,所以连接顺序为:混合气体→d→c→a→b→e。 8.某科学兴趣小组探究某混合气体(无色无味)是否含有CO2和CO,实验仪器及 部分装置如图9-11所示。请回答下列问题。 (2)根据图中提供的仪器,组装完的实验装置还有不足之处,请提出: 。 图9-11 [答案] (2)没有尾气处理装置 [解析] (2)一氧化碳有毒,需要进行尾气处理,所以不足之处是没有尾气处理装 置。 8.某科学兴趣小组探究某混合气体(无色无味)是否含有CO2和CO,实验仪器及 部分装置如图9-11所示。请回答下列问题。 (3)证明原混合气体中CO存在的实验现象是 ,并写出使黑色 粉末CuO变成亮红色固体的化学方程式: 。 图9-11 [答案] (3)C中黑色粉末变成亮红色固体,D中澄清石灰水变浑浊 CO+CuO Cu+CO2 [解析] (3)一氧化碳和氧化铜在加热的条件下生成铜和二氧化碳,二氧化碳和 氢氧化钙反应会生成碳酸钙沉淀和水,所以证明原混合气体中CO存在的实验 现象是C中黑色粉末变成亮红色固体,D中澄清石灰水变浑浊;使黑色粉末CuO 变成亮红色固体的化学方程式是CO+CuO Cu+CO2。 考向六 实验室制取二氧化碳 9.[2019·广州改编]图9-12是实验室制取CO2及进行性质实验的部分装置。 (1)CaCO3固体与稀盐酸反应生成CO2气体的化学方程式是 。 图9-12 [答案] (1)CaCO3+2HCl CaCl2+H2O+CO2↑ [解析] (1)碳酸钙与稀盐酸反应生成氯化钙、水和二氧化碳,化学方程式为 CaCO3 +2HCl CaCl2+H2O+CO2↑。 9.[2019·广州改编]图9-12是实验室制取CO2及进行性质实验的部分装置。 (2)检验装置气密性,按图甲连接装置,先 ,再加水至 A下端形成一段水柱,静置,若观察到 , 说明气密性良好。 图9-12 [答案] (2)用弹簧夹夹紧胶皮塞 长颈漏斗内水柱不下降 [解析] (2)检查装置的气密性,按图甲连接装置,先用弹簧夹夹紧胶皮管,再加水 至A下端形成一段水柱,静置,若观察到长颈漏斗内水柱不下降,说明气密性良好。 9.[2019·广州改编]图9-12是实验室制取CO2及进行性质实验的部分装置。 (3)加入药品。添加块状CaCO3固体时,为避免打破锥形瓶,应将锥形瓶 , 再放入固体。添加盐酸时,将稀盐酸从 (填仪器A的名称)倒入锥形瓶 至 。 图9-12 [答案] (3)横放 长颈漏斗 浸没长颈漏斗下端管口 [解析] (3)添加块状CaCO3固体时,为避免打破锥形瓶,应将锥形瓶横放,再放入 固体。添加盐酸时,将稀盐酸从长颈漏斗倒入锥形瓶至浸没长颈漏斗下端管口。 9.[2019·广州改编]图9-12是实验室制取CO2及进行性质实验的部分装置。 (4)如图乙所示,向放置有燃着的蜡烛的烧杯中倒入CO2,观察到的现象是 。 图9-12 [答案] (4)蜡烛一开始持续燃烧,之后熄灭 [解析] (4)装置中间有隔板,底部有空隙,二氧化碳的密度比空气大,二氧化碳不 燃烧也不支持燃烧,向放置有燃着的蜡烛的烧杯中倒入CO2,观察到的现象是 蜡烛一开始持续燃烧,之后熄灭。 9.[2019·广州改编]图9-12是实验室制取CO2及进行性质实验的部分装置。 图9-12 拓展延伸 某同学用浓盐酸和石灰石制取二氧化碳并将生成的气体通入图9- 13 D装置,未看到石灰水变浑浊,其原因是 ;如果用上述原料制取并 收集一瓶较纯净且干燥的二氧化碳气体,所选用装置的连接顺序是 (填 序号)。 图9-13 [答案] 拓展延伸 浓盐酸具有挥发性,二氧化碳气体中混有氯化氢气体 AEGB [解析] 拓展延伸 某同学用浓盐酸和石灰石制取二氧化碳并将生成的气体通 入D装置,未看到石灰水变浑浊,其原因是浓盐酸具有挥发性,二氧化碳气体中 混有氯化氢气体;如果用浓盐酸和石灰石制取并收集一瓶较纯净且干燥的二 氧化碳气体,所选用装置的连接顺序是AEGB,要先除杂质再干燥。 考向七 自然界中的碳循环 10.[2019·云南]“绿色发展”“低碳生活”等理念逐渐深 入民心,下列做法或认识与之不相符的是 ( ) A.在空旷的地方焚烧大量的废旧塑料 B.鼓励乘坐公交车或骑自行车出行 C.购物时提倡用布袋等环保袋代替塑料袋 D.植树造林 [答案] A [解析] 用焚烧的方 法处理废旧塑料,会 产生有毒、有害的 物质,污染空气。 推断链接 11.[2019·徐州]A~F是初中化学常见物质,它们之间的反应及转化关系如图9- 14所示(部分反应物、生成物及反应条件未标出),其中A是一种建筑材料的主要 成分,在高温下分解为B和C;通常情况下,C是一种无色气体,可用于生产汽水;E俗 称纯碱,D、F都是常见的碱。 (1)A的化学式是 。 图9-14 [答案] (1)CaCO3 [解析] A能用作建筑材料,且高温下可分解为B和C,故A为碳酸钙;由于C是气 体,则C是二氧化碳,B为氧化钙;E俗称纯碱,E是碳酸钠;由于D是碱,能与碳酸钠 反应,故D为氢氧化钙;碳酸钠与氢氧化钙反应生成氢氧化钠和碳酸钙,故F为氢 氧化钠。代入验证,推导合理。(1)A是碳酸钙,化学式为CaCO3。 11.[2019·徐州]A~F是初中化学常见物质,它们之间的反应及转化关系如图9- 14所示(部分反应物、生成物及反应条件未标出),其中A是一种建筑材料的主要 成分,在高温下分解为B和C;通常情况下,C是一种无色气体,可用于生产汽水;E俗 称纯碱,D、F都是常见的碱。 (2)B→D的反应类型是 。 图9-14 [答案] (2)化合反应 [解析] A能用作建筑材料,且高温下可分解为B和C,故A为碳酸钙;由于C是气 体,则C是二氧化碳,B为氧化钙;E俗称纯碱,E是碳酸钠;由于D是碱,能与碳酸钠 反应,故D为氢氧化钙;碳酸钠与氢氧化钙反应生成氢氧化钠和碳酸钙,故F为氢 氧化钠。代入验证,推导合理。(2)氧化钙与水反应生成氢氧化钙,该反应的反 应类型是化合反应。 11.[2019·徐州]A~F是初中化学常见物质,它们之间的反应及转化关系如图9- 14所示(部分反应物、生成物及反应条件未标出),其中A是一种建筑材料的主要 成分,在高温下分解为B和C;通常情况下,C是一种无色气体,可用于生产汽水;E俗 称纯碱,D、F都是常见的碱。 (3)D的一种用途是 。 图9-14 [答案] (3)改良酸性土壤 [解析] A能用作建筑材料,且高温下可分解为B和C,故A为碳酸钙;由于C是气 体,则C是二氧化碳,B为氧化钙;E俗称纯碱,E是碳酸钠;由于D是碱,能与碳酸钠 反应,故D为氢氧化钙;碳酸钠与氢氧化钙反应生成氢氧化钠和碳酸钙,故F为氢 氧化钠。代入验证,推导合理。(3)氢氧化钙能用于改良酸性土壤、作建筑材 料、配制波尔多液等。 11.[2019·徐州]A~F是初中化学常见物质,它们之间的反应及转化关系如图9- 14所示(部分反应物、生成物及反应条件未标出),其中A是一种建筑材料的主要 成分,在高温下分解为B和C;通常情况下,C是一种无色气体,可用于生产汽水;E俗 称纯碱,D、F都是常见的碱。 (4)C与F反应生成E的化学方程式为 。 图9-14 [答案] (4)CO2+2NaOH Na2CO3+H2O [解析] A能用作建筑材料,且高温下可分解为B和C,故A为碳酸钙;由于C是气 体,则C是二氧化碳,B为氧化钙;E俗称纯碱,E是碳酸钠;由于D是碱,能与碳酸钠 反应,故D为氢氧化钙;碳酸钠与氢氧化钙反应生成氢氧化钠和碳酸钙,故F为氢 氧化钠。代入验证,推导合理。(4)二氧化碳与氢氧化钠反应生成碳酸钠和水, 化学方程式为CO2+2NaOH Na2CO3+H2O。查看更多