- 2024-03-24 发布 |
- 37.5 KB |
- 6页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2019届一轮复习苏教版氧化还原反应教案(1)
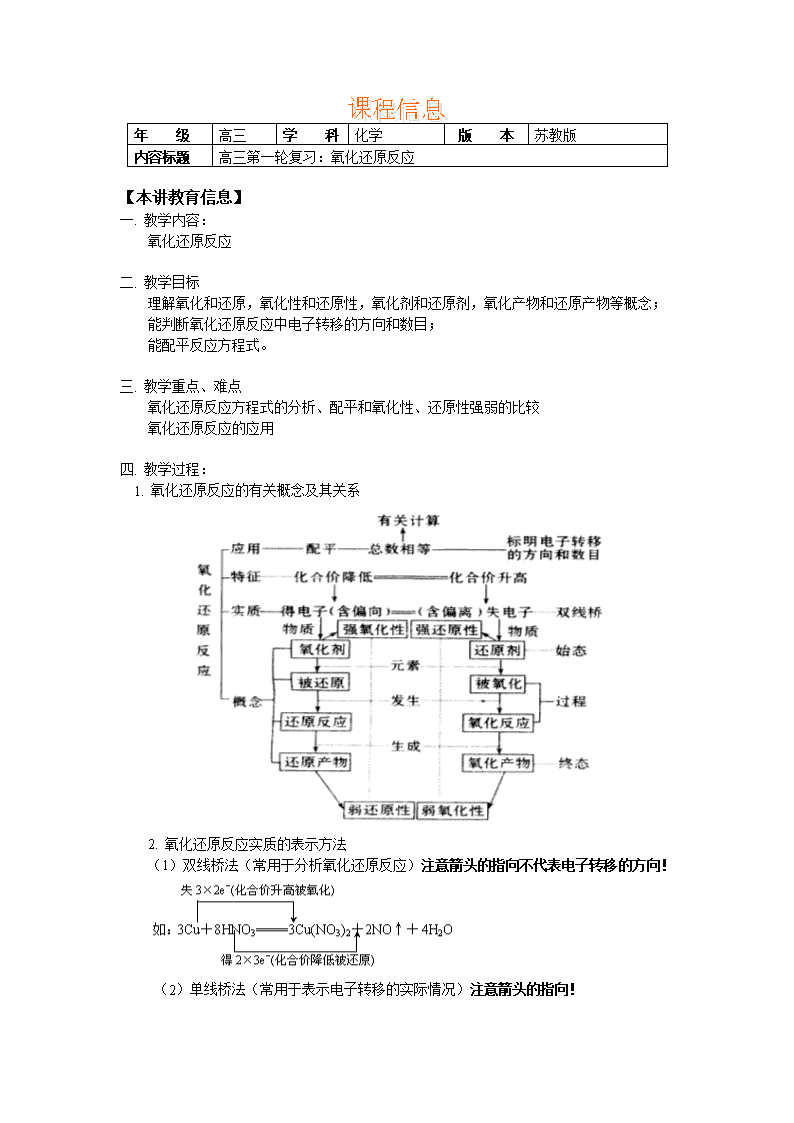
年 级 高三 学 科 化学 版 本 苏教版 内容标题 高三第一轮复习:氧化还原反应 【本讲教育信息】 一. 教学内容: 氧化还原反应 二. 教学目标 理解氧化和还原,氧化性和还原性,氧化剂和还原剂,氧化产物和还原产物等概念; 能判断氧化还原反应中电子转移的方向和数目; 能配平反应方程式。 三. 教学重点、难点 氧化还原反应方程式的分析、配平和氧化性、还原性强弱的比较 氧化还原反应的应用 四. 教学过程: 1. 氧化还原反应的有关概念及其关系 2. 氧化还原反应实质的表示方法 (1)双线桥法(常用于分析氧化还原反应)注意箭头的指向不代表电子转移的方向! (2)单线桥法(常用于表示电子转移的实际情况)注意箭头的指向! 3. 氧化还原反应的一般规律 ⑴守恒律:对于一个完整的氧化还原反应,化合价升高总数与降低总数相等,失电子总数与得电子总数相等。 ⑵价态律:元素处于最高价,只有氧化性;元素处于最低价,只有还原性;元素处于中间价态,既有氧化性又有还原性,但主要呈现一种性质。即:“高价氧化低价还,中间价态两头转” ⑶强弱律:强制弱:强氧化剂+强还原剂=弱还原剂+弱氧化剂。主要应用: ①比较物质间氧化性或还原性的强弱; ②在适宜条件下,用氧化性强的物质制备氧化性弱的物质或用还原性强的物质制备还原性弱的物质。 ⑷转化律:氧化还原反应中,以元素相邻价态间的转化最容易;同种元素不同价态之间的氧化反应,化合价的变化遵循“只靠拢,不交叉”(即价态归中 ) ;同种元素相邻价态间不发生氧化还原反应。 歧化律-—处于中间价态的元素同时升降 归中律-—同种元素不同价态反应时,化合价向中间靠拢,且一般符合邻位转化和互不换位规律,同种元素相邻价态不发生氧化还原反应 ⑸优先律:一种氧化剂同时和几种还原剂相遇时,还原性最强的优先发生反应。一种还原剂与多种氧化剂时,氧化性最强的优先发生反应。即“先强后弱”原则。 ⑹难易律:越易失电子的物质,失后就越难得电子;越易得电子的物质,得后就越难失电子。 4. 氧化性、还原性强弱的比较: 氧化性、还原性的强弱取决于得、失电子的能力,与得失电子的多少无关。一般从元素的价态考虑时:元素处于最高价态,则只有氧化性;处于最低价态,则只有还原性;而处于中间价态时,既有氧化性,又有还原性。 常用的判断方法有: (1)根据金属活动顺序表:单质失电子能力逐渐增强,还原性逐渐增强,其简单阳离子得电子能力逐渐减弱,氧化性逐渐减弱。 注:Fe3+氧化能力介于Hg2+、Ag+之间 (2)根据非金属活动顺序判断:一般情况下,F2、Cl2、Br2、I2、S单质的氧化性逐渐减弱,F-、Cl-、Br-、I-、S2-,其简单阴离子的还原性逐渐增强。 (3)从元素化合价的高低来判断:一般地说,同一种变价元素的几种物质,它们的氧化能力是由高价态到低价态逐渐减弱,还原能力则依次逐渐增强。特殊性:氧化、还原能力还与物质的稳定性、温度、浓度、酸碱性等有关。 如:氧化性HClO > HClO4; H2SO3 > H2SO4(稀) KMnO4氧化性:酸性 > 中性 > 碱性 (4)根据化学方程式:自发进行的氧化还原反应中: 强氧化剂+ 强还原剂=弱还原剂+弱氧化剂 氧化性:氧化剂>氧化产物;还原性: 还原剂>还原产物 另外大多数情况下,在氧化还原反应中:氧化性:氧化剂 > 还原剂;还原性:还原剂 > 氧化剂 (5)根据元素周期表判断:同主族元素:金属单质的还原性随金属性增强而增强,其简单离子的氧化性相应减弱;非金属单质的氧化性随非金属性增强而增强,其简单阴离子的还原性相应减弱 (6)根据反应进行的难易判断:不同氧化剂与同一还原剂反应,越容易进行的反应其中氧化剂的氧化性越强;不同还原剂与同一氧化剂反应,越容易进行的反应其中还原剂的还原性越强。 (7)根据电极反应判断:a、两种不同的金属构成原电池时,作负极的金属的还原性比正极金属的还原性强。b、用惰性电极电解混合溶液时,在阴极先放电的金属离子的氧化性强;在阳极先放电的阴离子的还原性强。 5. 氧化还原方程式的配平 配平步骤:“一标、二等、三定、四配、五查”。 配平技法:要注意以下方法的适用范围。 ①奇数配偶法:如S+C+KNO3-CO2+N2+K2S。 ②逆向配平法:适用于歧化反应。如:S+KOH(热、浓)=K2S+K2SO3+H2O ③零价法:适用于还原剂中两种元素价态难以确定但均属于升高的氧化还原反应。 例如:Fe3P+HNO3-Fe(NO3)3+NO+H3PO4+H2O(把Fe、P皆看成零价) 说明: 1、氧化还原反应的本质是电子的偏移和得失,即电子的转移;而氧化还原反应的特征是:所含元素的化合价发生变化。但并不是所有元素的化合价发生变化。 2、常见的氧化剂、还原剂: 3、物质的氧化性和还原性是指得失电子的能力,因此,氧化性、还原性的强弱取决于得、失电子的能力大小,与得失电子的多少无关。 4、一标是标出化合价发生变化的元素的化合价;二等是化合价升高与降低的总数相等;三定是指确定氧化剂、还原剂、氧化产物、还原产物前面的系数,这类系数称为氧化还原系数;四配是指用观察法配平方程式其他物质前面的系数;五查,要求从质量守恒、电荷守恒和得失电子守恒三个方面检查方程式配平是否正确。 【典型例题】 例1. 已知反应:①Cl2+2KBr=2KCl+Br2,②KClO3+6HCl=3Cl2+KCl+3H2O, ③2KBrO3 +Cl2=Br2+2KClO3,下列说法正确的是: A. 上述三个反应都有单质生成,所以都是置换反应 B. 氧化性由强到弱顺序为 KBrO3>KClO3>Cl2>Br2 C. 反应②中还原剂与氧化剂的物质的量之比为6:1 D. ③中1 mol还原剂反应则氧化剂得到电子的物质的量为2mol 解析:该题主要考查氧化还原反应的规律、氧化剂和还原剂的判断、对化学计量数的理解以及得失电子守恒的简单应用。氧化性的强弱①中:Cl2>Br2;②中KClO3>Cl2;③中KBrO3>KClO3,综合考虑得B正确;A中②选项不属于置换反应;C中作还原剂的HCl为5mol,故还原剂与氧化剂的物质的量之比为5:1,还有1mol起酸的作用;D③中1 mol还原剂反应则氧化剂得到电子的物质的量为10 mol。故正确选项为B 答案:B 例2. 用0.1mol·L的Na2SO3溶液30 mL,恰好将1×10-3mol的X04-还原,则元素X在还原产物中的化合价是: A. +1 B. +2 C. +3 D. +4 解析:该题主要考查氧化还原反应的规律、氧化剂和还原剂的判断、对化学计量数的理解以及得失电子守恒的简单应用。 由,,由得失电子数相等,, 答案:A 例3. 配平以下氧化还原反应方程式: 当KMnO4消耗0.05mol时,产生的CO2的体积为________L(标准状况)。 解析:这是一道关于有机氧化还原反应方程式的配平的题,有机氧化还原反应方程式的配平与无机氧化还原反应方程式相似,关键是正确标定有机物中碳的化合价。为了方便地标出碳的化合价,在遇到有机物用结构简式表示时,一定要把它写成分子式。 则有:2KMnO4+5H2C2O4+3H2SO4=10CO2+K2SO4+2MnSO4+8H2O 生成CO2的体积为5.6L 答案:2KMnO4+5H2C2O4+3H2SO4=10CO2+K2SO4+2MnSO4+8H2O 生成CO2的体积为5.6L 例4. 三聚氰酸C3N3(OH)3,可用于消除汽车尾气中的氮氧化物(如NO2)。当加热至一定温度时,它发生如下分解:C3N3(OH)3=3HNCO ;HNCO(异氰酸,其结构是H—N=C=0)能和NO2反应生成N2、C02和H20。 (1)写出HNCO和N02反应的化学方程式。分别指明化合物中哪种元素被氧化?哪种元素被还原?标出电子转移的方向和数目。 (2)如按上述反应式进行反应,试计算吸收1.0 kg NO2气体所消耗的三聚氰酸的质量。 解析:首先应根据HNCO的结构,判断HNCO中N的化合价为-3。故有: 其中氮元素的化合价既升高又降低,既被氧化又被还原,转移的电子数目为24e-。 根据关系式: 129 9×46/4 x 0.1kg 得:x=0.125 kg 答案 : (1) 其中氮元素的化合价既升高又降低,既被氧化又被还原,转移的电子数目为24e- (2)吸收1.0 kg NO2气体所消耗的三聚氰酸的质量为0.125 kg 例5. 化学实验中,如使某步中的有害产物作为另一步的反应物,形成一个循环,就可不再向环境排放该种有害物质。例如: (l)在上述有编号的步骤中,需用还原剂的是 ,需用氧化剂的是 。 (2)在上述循环中,既能与强酸反应又能与强碱反应的两性物质是 (填化学式) (3)完成并配平步骤①的化学方程式,标出电子转移的方向和数目: □Na2Cr2O7+□KI+□HCl→□CrCl3+□NaCl+□KCl+□I2+□ 解析:根据氧化还原反应的判断规律:步骤①中Cr元素化合价降低,需用还原剂;④中Cr元素化合价升高,需用氧化剂。其中Cr(OH)3与强酸反应生成:CrCl3,与强碱反应生成:CrO2-,属于两性氢氧化物。 根据氧化还原反应的配平的基本步骤:“一标、二等、三定、四配、五查”得: 得方程式为:Na2Cr2O7+6KI+14HCl=2CrCl3+2NaCl+6KCl+3I2+7H2O 答案:(1)①、④;(2)Cr(OH)3;(3)1 6 14 2 2 6 3 7H2O 例6. 已知反应:10AgF+5Cl2+5H2O=9AgCl+AgClO3+10HF+O2,试回答: (1) 反应中氧化剂和还原剂的物质的量之比是____________; (2) 当转移1 mol电子时,被氧化的Cl2的物质的量是___________; (3) 每产生1 mol O2时,被氧元素还原的Cl2的物质的量是___________; (4)反应消耗的水是( ) A. 全部被氧化 B. 全部被还原 C. 被氧化 D. 被还原 解析:此反应的电子转移的方向和总数的表示法如下: (1) 有4.5 mol Cl2 作氧化剂,作还原剂的有0.5 mol Cl2和2 mol O2,为4.5∶2.5=9∶5; (2)根据分析,每转移9mol电子,被氧化的Cl2的物质的量为1/2mol,则转移1 mol电子时,被氧化的Cl2的物质的量为1/18mol; (3)O元素由-2价转变为0价,失去2个电子。每生成1 mol O2共失去4 mol电子,则被氧元素还原的Cl2共得到4mol电子,每摩Cl2得到2mol电子,则有2摩Cl2被氧元素还原; (4)在该反应中5mol H2O参与反应,只有被氧化 答案:(1) 9∶5 (2) mol (3) 2 mol (4) C查看更多