- 2024-03-01 发布 |
- 37.5 KB |
- 10页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2018-2019学年江苏省邗江中学高二下学期期中考试化学试题 Word版
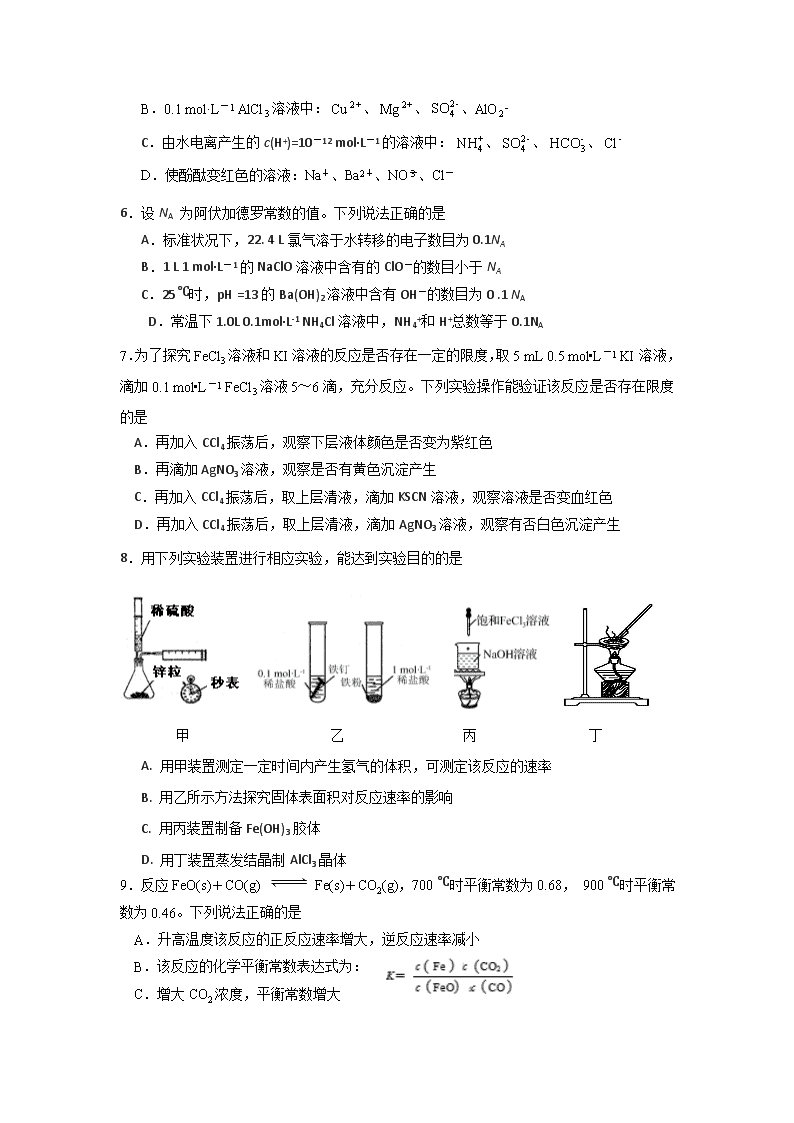
江苏省邗江中学2018-2019学年度第二学期 高二化学期中试卷(选修) 命题人:杨丽娟 说明:本试卷分第I卷(选择题)和第II卷(非选择题)两部分,全卷满分120分,考试时间100分钟。 第I卷(选择题共40分) 单项选择题(本题包括10小题,每小题2分,共20分。每小题只有一个选项符合题意) 1. 下列说法一定正确的是 A.工业通过焦炭与水蒸气反应制水煤气,增加焦碳的量,可加快化学反应速率 B.用HNO2作导电实验,灯泡较暗,说明HNO2是弱酸 C.反应速率越快,反应现象越明显 D.平衡常数K的大小能说明反应进行的程度,K越大,说明反应进行的越彻底 2.下列不能用勒夏特列原理解释的是 A.工业合成氨:500℃比室温更有利 B.SO2催化氧化成SO3的反应,往往加入过量的空气 C.可用浓氨水和氢氧化钠固体快速制取氨气 D.实验室中常用排饱和食盐水的方法收集氯气 3.下列有关物质的性质与用途正确,且具有对应关系的是 A.Fe2(SO4)3易溶于水,可用作净水剂 B.Na2CO3受热不易分解,可用于去油污 C.NaHCO3的水溶液呈弱碱性,可用于治疗胃酸过多 D.石英坩埚耐高温,可用来加热熔化烧碱、纯碱等固体 4.下列说法正确的是 A.NaHCO3中HCO3—的水解方程式可写为:HCO3—+H2OCO32—+H3O+ B.H2S在水溶液中的电离:H2S S2-+2H+ C.泡沫灭火器的灭火原理:Al3+ +3HCO3-= Al(OH)3↓+ 3CO2↑ D. 向0.1mol/L、pH=1的NaHA溶液中加入NaOH溶液:HA-+OH-=A2-+H2O 5.常温下,下列各组离子一定能在指定溶液中大量共存的是 A.pH=1的无色溶液中:、、、 B.0.1 mol·L-1 AlCl3溶液中:、、、AlO2- C.由水电离产生的c(H+)=10-12 mol·L-1的溶液中:、、、 D.使酚酞变红色的溶液:Na+、Ba2+、NO、Cl- 6.设NA 为阿伏加德罗常数的值。下列说法正确的是 A.标准状况下,22. 4 L氯气溶于水转移的电子数目为0.1NA B.1 L 1 mol·L-1的NaClO溶液中含有的ClO-的数目小于NA C.25℃时,pH =13的Ba(OH)2溶液中含有OH-的数目为0 .1 NA D.常温下1.0L 0.1mol·L-1 NH4Cl溶液中,NH4+和H+总数等于0.1NA 7.为了探究FeCl3溶液和KI溶液的反应是否存在一定的限度,取5 mL 0.5 mol•L-1 KI溶液,滴加0.1 mol•L-1 FeCl3溶液5~6滴,充分反应。下列实验操作能验证该反应是否存在限度的是 A.再加入CCl4振荡后,观察下层液体颜色是否变为紫红色 B.再滴加AgNO3溶液,观察是否有黄色沉淀产生 C.再加入CCl4振荡后,取上层清液,滴加KSCN溶液,观察溶液是否变血红色 D.再加入CCl4振荡后,取上层清液,滴加AgNO3溶液,观察有否白色沉淀产生 8.用下列实验装置进行相应实验,能达到实验目的的是 甲 乙 丙 丁 A. 用甲装置测定一定时间内产生氢气的体积,可测定该反应的速率 B. 用乙所示方法探究固体表面积对反应速率的影响 C. 用丙装置制备Fe(OH)3胶体 D. 用丁装置蒸发结晶制AlCl3晶体 9.反应FeO(s)+CO(g) Fe(s)+CO2(g),700 ℃时平衡常数为0.68, 900 ℃时平衡常数为0.46。下列说法正确的是 A.升高温度该反应的正反应速率增大,逆反应速率减小 B.该反应的化学平衡常数表达式为: C.增大CO2浓度,平衡常数增大 D.该反应的正反应是放热反应 10. 下列关于各图的叙述正确的是 甲 乙 丙 丁 A.图甲表示某可逆反应中物质浓度随时间的变化,反应在t时刻达到平衡状态 B.图乙表示镁条放入盐酸中生成氢气的速率受温度和浓度的影响 C.图丙表示常温下,稀释HA、HB两种酸的稀溶液时,溶液pH随加水量的变化,则NaA溶液的pH大于同浓度NaB溶液的pH D.丁表示向氨水中通入HCl气体,溶液的导电能力变化 不定项选择题:本题包括5小题,每小题4分,共20分。每小题只有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该题得0分;若正确答案包括两个选项,只选一个且正确的得2分,选两个且都正确的得满分,但只要选错一个,该小题就得0分。 11. 对于可逆反应A(g)+2B(g)2C(g)(正反应放热),下列图象中正确的是 12.已知温度T时水的离子积常数为Kw,该温度下,将浓度为a mol·L-1的一元酸HA与b mol·L-1的一元碱BOH等体积混合。可判定该溶液呈中性的依据是 A.a=b B.混合溶液的pH=7 C.混合溶液中,c(H+)= mol·L-1 D.混合溶液中,c(H+)+c(B+)=c(OH-)+c(A-) 13.下列说法正确的是 A. C(s) + H2O(g)CO(g) + H2(g)在室温下不能自发进行,说明该反应的△H>0 B. 25 ℃,向0.1 mol·L-1的NH4Cl溶液中加水,会增大 C. 用pH均为2的盐酸和甲酸中和等物质的量的NaOH溶液,盐酸消耗的体积多 D.合成氨生产中将氨气液化分离,可加快正反应速率,提高H2的转化率 14. 下列溶液中各微粒的浓度关系正确的是 A.物质的量浓度相等的①(NH4)2CO3②(NH4)2SO4③(NH4)2Fe(SO4)2三种溶液, c (NH4+)的大小顺序为:①>②>③ B. 等浓度的Na2CO3与NaHCO3溶液等体积混合,所得溶液中: c (Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+) C. 0.1 mol·L-1的CH3COOH与0.05 mol·L-1 NaOH溶液等体积混合: c(H+)+c(CH3COOH) < c(OH-)+c(Na+) D. pH相等的NaF与CH3COOK溶液:c(Na+)-c(F —) = c(K+)-c(CH3COO—) 15. 在三个容积相同的恒容密闭容器中,起始时按表中相应的量加入物质,在相同温度下发生反应CH4(g)+H2O(g)CO(g)+3H2(g)(不发生其他反应),CH4的平衡转化率与温度、压强的关系如右下图所示。 下列说法错误的是 A. 该反应的ΔH>0,图中压强P1>P2 B. 起始时,容器Ⅱ中v(CH4)正查看更多