- 2023-12-26 发布 |
- 37.5 KB |
- 11页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2020学年高二化学下学期期末考试试题(新版)人教新目标版
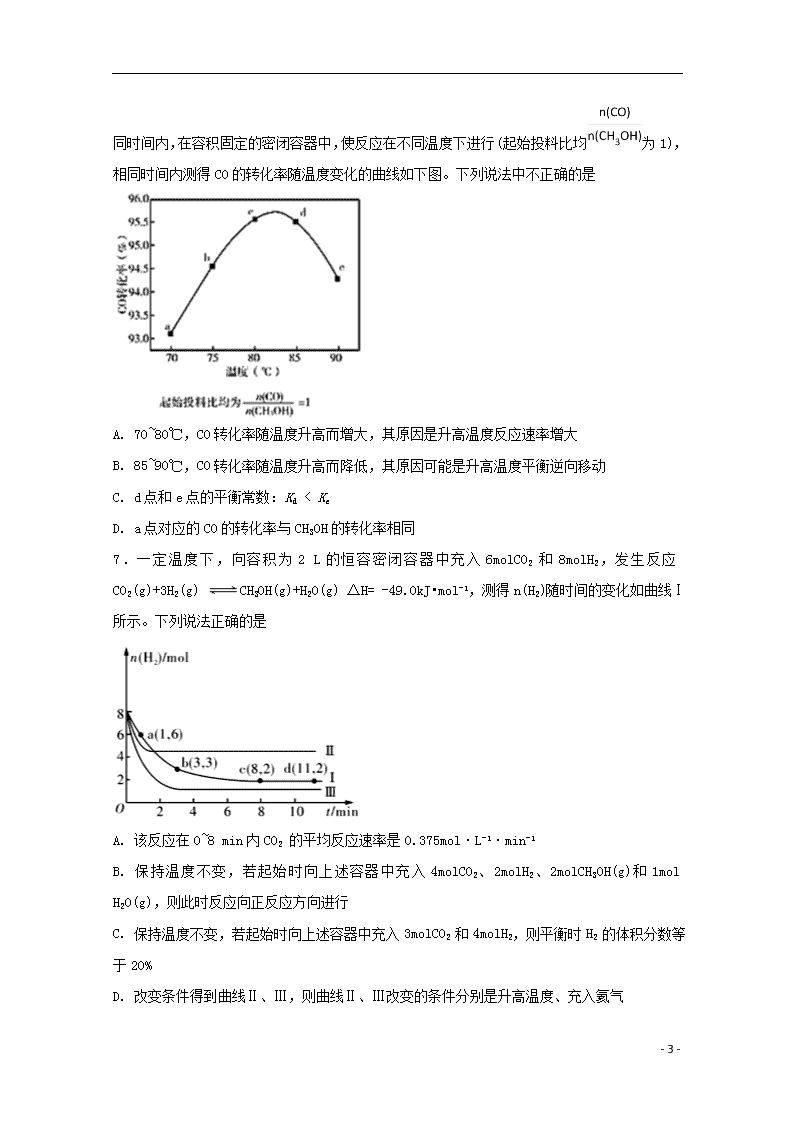
2019学年度第二学期期末考试 高二年级 化学试卷 一、单选题 1.工业上用丁烷催化脱氢侧备丁烯:C4H10(g)CH4(g)+H2(g)(正反应吸热)。将丁烷和氢气以一定的配比通过填充有催化剂的反应器(氢气的作用是活化催化剂),反应的平衡转化率、产率与温度、投料比有关。下列判断不正确的是 A. 由图甲可知,x小于0.1 B. 由图乙可知,丁烯产率先增大后减小,减小的原因是氢气是产物之一,随着n(氢气)/n(丁烷)增大,逆反应速 率减小 C. 由图丙可知产率在590℃之前随温度升高面增大的原因可能是溫度升高平衡正向移动 D. 由图丙可知,丁烯产率在590℃之后快速降低的主要原因为丁烯高温分解生成副产物 2.一定温度下,在2L的密闭容器中发生反应:xA(g) +B(g)2C(g) △H<0,A、 C的物质的量随时间变化的关系如图。下列有关说法正确的是 A. x=1 B. 反应进行到1min时,反应体系达到化学平衡状态 C. 2min后,A的正反应速率一定等于C的逆反应速率 D. 2min后,容器中A与B的物质的量之比一定为2∶1 3.某溶液中可能含有K+、 Na+、 Mg2+、 NH4+、 Fe2+、Br-、 CO32-、SO42-、SO32-中的若干种离子。某同学做了如下实验: ① 取少量溶液,滴加足量氯水,有气泡产生且溶液颜色变成黄色 - 11 - ② 另取少量溶液,滴加盐酸酸化的氯化钡溶液,无沉淀生成 ③ 蘸取原溶液,做焰色反应,透过蓝色钴玻璃观察到火焰呈紫色。 为进一步确定该溶液的组成,无 需进行的实验是 A. 上述实验③不透过蓝色钴玻璃观察火焰颜色 B. 取少量溶液,滴加氯水和CCl4,振荡、静置 C. 取少量溶液,滴加适量的稀硫酸和品红溶液 D. 取少量溶液,滴加适量的NaOH浓溶液,加热,用湿润的红色石蕊试纸检验气体 4.黄铜矿(主要成分CuFeS2)是提取Cu的主要原料。 已知:2CuFeS2+4O2Cu2S+3SO2+2FeO(Ⅰ) 产物Cu2S在1200 ℃高温下继续反应:2Cu2S+3O2==2Cu2O+2SO2 (Ⅱ) 2Cu2O+Cu2S==6Cu +SO2↑ (Ⅲ) 假定各步反应都完全。则下列说法正确的是 A. 反应Ⅰ中CuFeS2仅作还原剂 B. 取12.5g黄铜矿样品,经测定含3.60g硫,则矿样中CuFeS2质量分数一定为82.8% C. 由6molCuFeS2生成6molCu消耗O2的物质的量为14.25mol D. 6molCuFeS2和15.75molO2反应,理论上可得到铜的物质的量为3mol 5.利用电导法测定某浓度醋酸电离的ΔH、Ka随温度变化曲线关系如图。已知整个电离过程包括氢键断裂、醋酸分子解离、离子水合。下列有关说法不正确的是 A. 理论上ΔH=0时,Ka最大 B. 25℃时,[CH3COOH]最大 C. 电离的热效应较小是因为分子解离吸收的能量与离子水合放出的能量相当 D. CH3COOH溶液中存在氢键是ΔH随温度升高而减小的主要原因 6.甲酸甲酯是重要有机化工原料,制备反应为CH3OH(g)+CO(g) HCOOCH3(g) Δ - 11 - H<0;相同时间内,在容积固定的密闭容器中,使反应在不同温度下进行(起始投料比均为1),相同时间内测得CO的转化率随温度变化的曲线如下图。下列说法中不正确的是 A. 70~80℃,CO转化率随温度升高而增大,其原因是升高温度反应速率增大 B. 85~90℃,CO转化率随温度升高而降低,其原因可能是升高温度平衡逆向移动 C. d点和e点的平衡常数:Kd < Ke D. a点对应的CO的转化率与CH3OH的转化率相同 7.一定温度下,向容积为2 L的恒容密闭容器中充入6molCO2 和8molH2,发生反应CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H= -49.0kJ•mol-1,测得n(H2)随时间的变化如曲线Ⅰ所示。下列说法正确的是 A. 该反应在0~8 min内CO2 的平均反应速率是0.375mol·L-1·min-1 B. 保持温度不变,若起始时向上述容器中充入4molCO2、2molH2、2molCH3OH(g)和1mol H2O(g),则此时反应向正反应方向进行 C. 保持温度不变,若起始时向上述容器中充入3molCO2 和4molH2,则平衡时H2 的体积分数等于20% D. 改变条件得到曲线Ⅱ、Ⅲ,则曲线Ⅱ、Ⅲ改变的条件分别是升高温度、充入氦气 - 11 - 8.下列说法正确的是 A. 的一溴代物和的一溴代物都有4种(不考虑立体异构) B. CH3CH=CHCH3分子中的四个碳原子在同一直线上 C. 按系统命名法,化合物的名称是2,3,4-三甲基-2-乙基戊烷 D. 与都是α-氨基酸且互为同系物 9.下列反应的离子方程式书写正确的是 ( ) A. 氢氧化钠溶液与稀醋酸反应:OH-+H+=H2O B. 碳酸钙与足量稀硝酸反应:CaCO3+2H+=Ca2++H2O+CO2↑ C. 氯化铝溶液与过量氨水反应:Al3++4NH3·H2O=AlO2-+4NH4++2H2O D. 钠与水反应:Na+2H2O=Na++2OH-+H2↑ 10.全固态锂硫电池能量密度高、成本低,其工作原理如图所示,其中电极a常用掺有石墨烯的S8材料,电池反应为:16Li+xS8=8Li2Sx(2≤x≤8)。下列说法错误的是 A. 电池工作时,正极可发生反应:2Li2S6+2Li++2e−=3Li2S4 B. 电池工作时,外电路中流过0.02 mol电子,负极材料减重0.14 g C. 石墨烯的作用主要是提高电极a的导电性 D. 电池充电时间越长,电池中Li2S2的量越多 11.温度为T1时,在三个容积均为1 L的恒容密闭容器中仅发生反应:2NO2(g)2NO(g)+O2 (g) (正反应吸热)。实验测得: v正= v(NO2)消耗=k正c2(NO2 ),v逆= v(NO)消耗=2v(O2)消耗= k逆c2 (NO)·c(O2 ),k正、k逆为速率常数,受温度影响。下列说法正确的是 物质的起始浓度(mol·L-1) 物质的平衡浓度(mol·L-1) - 11 - 容器编号 c(NO2) c(NO) c(O2) c(O2) I 0.6 0 0 0.2 II 0.3 0.5 0.2 Ⅲ 0 0.5 0.35 A. 达平衡时,容器I与容器Ⅱ中的总压强之比为 4∶5 B. 达平衡时,容器中Ⅱ中 c(O2)/ c(NO2) 比容器I中的大 C. 达平衡时,容器Ⅲ中NO的体积分数小于50% D. 当温度改变为 T2时,若 k正=k逆,则 T2查看更多
相关文章
您可能关注的文档
- 2020学年高二化学下学期期末考试试题(新版)人教新目标版
- 城管局新冠肺炎防控实施方案
- 观看2020春天纪事心得体会_2020春天纪事观后感精选5篇
- 在政治合格方面存在的问题的原因分析
- 2017-2018学年甘肃省兰州第一中学高二上学期第一次月考(9月)地理试题
- 2018届《创新设计》(人教版)高三大一轮复习课件:9-2世界主要农业地域类型
- 2020版高考英语一轮巩固达标练 Unit 4 Pygmalion(含解析)新人教版选修8
- 2020二年级班主任年度总结报告
- 数学卷·2018届四川省绵阳市南山中学试验学校高二上学期10月月考数学试卷(理科) (解析版)
- 2018-2019学年北京市顺义区杨镇第一中学高二上学期第一次月考地理试题(Word版)