- 2023-12-21 发布 |
- 37.5 KB |
- 12页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
【化学】江苏省泰州市2020届高三第二次模拟考试(5月)
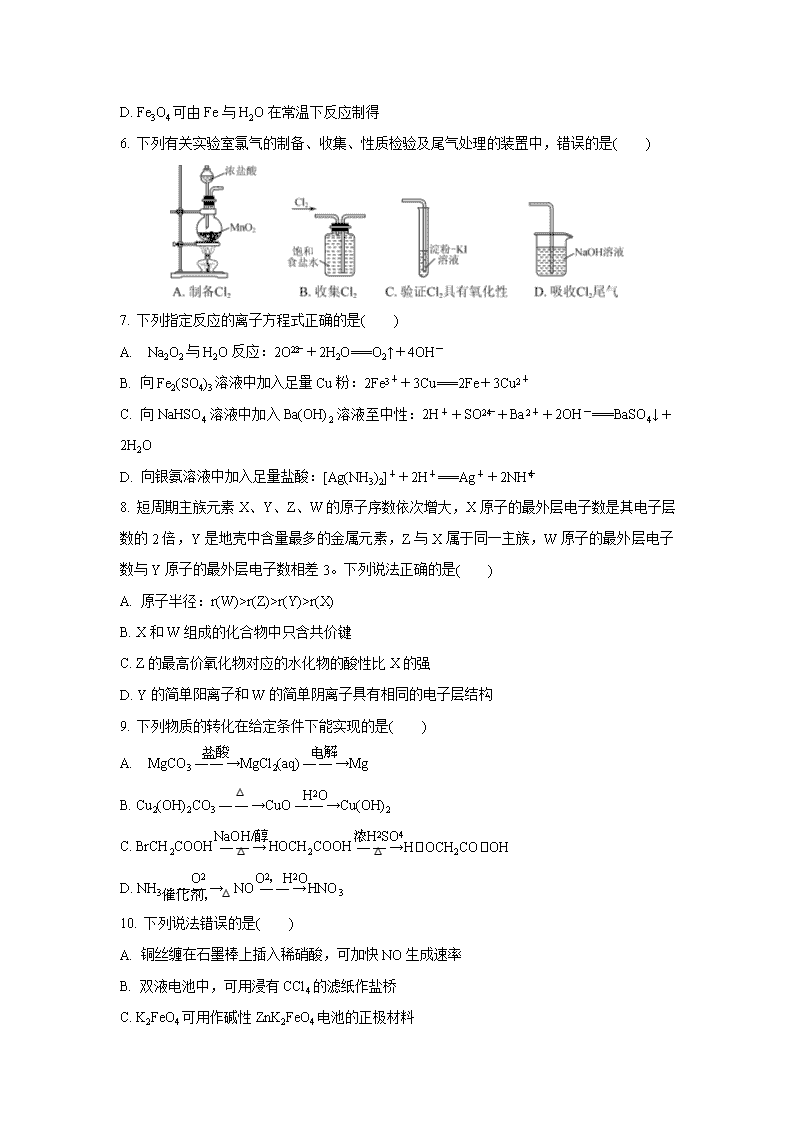
江苏省泰州市2020届高三第二次模拟考试(5月) 可能用到的相对原子质量:H—1 Li—7 C—12 N—14 O—16 S—32 Fe—56 第Ⅰ卷(选择题 共40分) 单项选择题:本题包括10小题,每小题2分,共20分。每小题只有一个选项符合题意。 1. 2020年4月20日,习近平总书记来到秦岭,关注山清水秀。下列做法正确的是( ) A. 集中深埋废旧电池 B. 远海排放工业污水 C. 减少冶炼含硫矿物 D. 推广使用一次性木筷 2. “新冠病毒”疫情让人们再次认识到化学的重要性。下列有关抗疫物资的化学用语表示正确的是( ) A. 碘酊中质量数为127的碘原子:I B. 供氧剂中过氧化钙(CaO2)的电子式:Ca2+[]2- C. 84消毒液中次氯酸钠的电离方程式:NaClONa++ClO- D. 口罩“熔喷层”原料中聚丙烯的结构简式: 3. 下列有关物质性质与用途具有对应关系的是 ( ) A. Al2O3难溶于水,可用作耐高温材料 B. 晶体Si具有半导体性能,可用作光导纤维 C. SO2具有漂白性,可用于漂白纸张 D. ClO2具有还原性,可用于自来水的杀菌消毒 4. 常温下,下列各组离子在指定溶液中能大量共存的是( ) A. 0.1 mol·L-1 NaHCO3溶液中:NH、H+、NO、SO B. 使酚酞变红色的溶液中:Mg2+、Fe2+、NO、Cl- C. 0.1 mol·L-1 FeCl3溶液中:K+、Na+、Br-、SCN- D. c(H+)=1×10-4 mol·L-1的溶液中:K+、Cu2+、Cl-、SO 5. 高温下,Fe2O3和H2反应可转化为Fe3O4,方程式为3Fe2O3+H22Fe3O4+H2O。下列说法正确的是( ) A. Fe2O3俗名磁性氧化铁 B. 该反应条件下H2的还原性强于Fe3O4的还原性 C. 每消耗160 g Fe2O3,反应中转移2×6.02×1023个电子 D. Fe3O4可由Fe与H2O在常温下反应制得 6. 下列有关实验室氯气的制备、收集、性质检验及尾气处理的装置中,错误的是( ) 7. 下列指定反应的离子方程式正确的是( ) A. Na2O2与H2O反应:2O+2H2O===O2↑+4OH- B. 向Fe2(SO4)3溶液中加入足量Cu粉:2Fe3++3Cu===2Fe+3Cu2+ C. 向NaHSO4溶液中加入Ba(OH)2溶液至中性:2H++SO+Ba2++2OH-===BaSO4↓+2H2O D. 向银氨溶液中加入足量盐酸:[Ag(NH3)2]++2H+===Ag++2NH 8. 短周期主族元素X、Y、Z、W的原子序数依次增大,X原子的最外层电子数是其电子层数的2倍,Y是地壳中含量最多的金属元素,Z与X属于同一主族,W原子的最外层电子数与Y原子的最外层电子数相差3。下列说法正确的是( ) A. 原子半径:r(W)>r(Z)>r(Y)>r(X) B. X和W组成的化合物中只含共价键 C. Z的最高价氧化物对应的水化物的酸性比X的强 D. Y的简单阳离子和W的简单阴离子具有相同的电子层结构 9. 下列物质的转化在给定条件下能实现的是( ) A. MgCO3MgCl2(aq)Mg B. Cu2(OH)2CO3CuOCu(OH)2 C. BrCH2COOHHOCH2COOHHOCH2COOH D. NH3NOHNO3 10. 下列说法错误的是( ) A. 铜丝缠在石墨棒上插入稀硝酸,可加快NO生成速率 B. 双液电池中,可用浸有CCl4的滤纸作盐桥 C. K2FeO4可用作碱性ZnK2FeO4电池的正极材料 D. 生铁发生吸氧腐蚀时的腐蚀速率与O2的浓度有关 不定项选择题:本题包括5小题,每小题4分,共20分。每小题只有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该小题得0分;若正确答案包括两个选项,只选一个且正确的得2分,选两个且都正确的得满分,但只要选错一个,该小题就得0分。 11. 下列判断正确的是( ) A. 图1可表示电解200 mL 0.1 mol·L-1 NaCl溶液过程中,产生氢气体积(标准状况)与转移电子物质的量的关系曲线 B. 图2可表示常温下0.1 mol·L-1盐酸滴加到40 mL 0.1 mol·L-1 NaOH溶液的滴定曲线 C. 高温下能自发进行的反应CO2(g)+H2(g)CO(g)+H2O(g)的能量变化如图3所示,则该反应的ΔS>0 D. 图4可表示反应N2(g)+3H2(g)2NH3(g)在t1时刻扩大容器体积时,v逆随时间的变化曲线 12. 化合物X是一种黄酮类化合物的中间体,其结构简式如图所示。下列有关化合物X的说法正确的是( ) A. 分子中所有碳原子共平面 B. 分子中存在1个手性碳原子 C. 化合物X不能使酸性KMnO4溶液褪色 D. 1 mol化合物X最多可与12 mol H2发生加成反应 13. 室温下进行下列实验,根据实验操作和现象所得到的结论正确的是( ) 选项 实验操作和现象 结论 A 向蛋白质溶液中加入醋酸铅溶液,产生白色沉淀 蛋白质发生了盐析 B SO2通入Ba(NO3)2溶液中,产生白色沉淀 沉淀为BaSO3 C 向蔗糖中加入适量浓硫酸并搅拌,蔗糖变黑,体积膨胀,并放出刺激性气味的气体 浓硫酸具有脱水性和强氧化性 D 分别向等物质的量浓度的苯酚钠溶液和碳酸钠溶液中滴加酚酞,后者红色更深 碳酸酸性强于苯酚 14. 已知:邻苯二甲酸(H2A)的Ka1=1.1×10-3,Ka2=3.9×10-6。室温下,用0.1 mol·L-1 NaOH溶液滴定20 mL 0.1 mol·L-1邻苯二甲酸氢钾(KHA)溶液。下列说法正确的是( ) A. 0.1 mol·L-1 KHA溶液中:c(K+)>c(HA-)+2c(A2-) B. 加入NaOH溶液至pH=8时:c(K+)>c(A2-)>c(HA-)>c(H2A) C. 加入20 mL NaOH溶液时:c(OH-)+c(A2-)=c(Na+)+c(H+)+c(H2A) D. 在滴定过程中,水的电离程度一直减小 15. 初始温度为t ℃,向三个密闭的容器中按不同方式投入反应物,发生反应:4HCl(g)+O2(g)2Cl2(g)+2H2O(g);ΔH=-116 kJ·mol-1,测得反应的相关数据如下: 容 器 容器类型 初始 体积 初始压 强/Pa 反应物投入量/mol 平衡时Cl2的 物质的量/mol HCl O2 Cl2 H2O Ⅰ 恒温恒容 1 L 2×105 4 1 0 0 1 Ⅱ 绝热恒容 1 L p2 0 0 2 2 a Ⅲ 恒温恒压 2 L p3 8 2 0 0 b 下列说法正确的是( ) A. 反应4HCl(g)+O2(g)2Cl2(g)+2H2O(l)的ΔH>-116 kJ·mol-1 B. a>1, b>2 C. p2=1.6×105 Pa, p3=4×105 Pa D. 若起始向容器Ⅰ中充入0.5 mol HCl、0.5 mol O2、0.5 mol Cl2和0.5 mol H2O,则反应向逆反应方向进行 第Ⅱ卷(非选择题 共80分) 16. (12分)一种固定烟气中CO2的工艺流程如下: (1) “反应Ⅰ”中,CO2与过量氨水反应的离子方程式为________________________________。 (2) “反应Ⅰ”中,提高烟气中CO2去除率的可行措施有________(填字母)。 a. 采用高温 b. 加快烟气流速 c. 增大氨水浓度 (3) 若测得滤液中c(CO)=10-2 mol·L-1,则Ca2+是否沉淀完全?________(填“是”或“否”)。[c(Ca2+)<10-5 mol·L-1时视为沉淀完全;Ksp(CaCO3)=4.96×10-9] (4) “反应Ⅱ”中,溶液的pH和导电能力变化如图1所示,导电能力初始时快速降低,后来逐渐上升的原因是____________________________________________。 (5) CaCO3可用于调节废水的pH,以除去其中的Fe3+。溶液pH对除铁效率影响如图2所示。 ①除铁时应控制溶液的pH为________(填字母)。 a. 0.5~1.5 b. 1.5~2.5 c. 2.5~3.5 ② 除铁时pH稍大会生成Fe(OH)3胶体,显著降低除铁效率,其原因是________________________________________________。 17. (15分)化合物F是一种非天然氨基酸,其合成路线如下: (1) C中官能团的名称为________。 (2) D→E的反应类型为____________。 (3) B的分子式为C7H6O,写出B的结构简式:____________。 (4) D的一种同分异构体X同时满足下列条件,写出X的结构简式:____________。 ①六元环状脂肪族化合物; ②能发生银镜反应,1 mol X反应能生成4 mol Ag; ③分子中只有4种不同化学环境的氢。 (5) 写出以、CH3NO2为原料制备的合成路线流程图(无机试剂和有机溶剂任用,合成路线流程图示例见本题题干)。 18. (12分)双氧水是重要的化学试剂。 (1) 一定条件下,O2得电子转化为超氧自由基(·O),并实现如下图所示的转化: ①是________(填“氧化”或“还原”)反应。 ②写出图示转化总反应的化学方程式:____________________________________________。 (2) K2Cr2O7酸性条件下与H2O2反应生成CrO5,反应为非氧化还原反应。据此分析,CrO5中-2价O与-1价O的数目比为________。 (3) H2O2可用于测定酒精饮料中乙醇的含量。现有20.00 mL某鸡尾酒,将其中CH3CH2OH蒸出并通入17.0 mL 0.200 0 mol·L-1 K2Cr2O7溶液(H2SO4酸化)中,发生反应: K2Cr2O7+C2H5OH+H2SO4―→Cr2(SO4)3+CH3COOH+K2SO4+H2O(未配平) 再用0.400 0 mol·L-1的双氧水滴定反应后所得的混合液,用去19.00 mL双氧水,滴定过程中发生如下反应: 反应1:4H2O2+K2Cr2O7+H2SO4===K2SO4+2CrO5+5H2O 反应2:H2O2+CH3COOH===CH3COOOH+H2O 则该鸡尾酒中CH3CH2OH的物质的量浓度为________mol·L-1(写出计算过程)。 19. (15分)Co3O4(Co为+2和+3价)可应用于磁性材料等领域。实验室利用乙酸钴晶体[Co(CH3COO)2·4H2O]制备Co3O4的实验步骤如下: Ⅰ. 将乙酸钴晶体配成溶液X,缓慢滴加(NH4)2CO3溶液,30 ℃水浴一段时间; Ⅱ. 将混合液高压密封加热到160 ℃,得到含碱式碳酸钴晶体[2CoCO3·3Co(OH)2·H2O]的浊液; Ⅲ. 制备碱式碳酸钴晶体; Ⅳ. 将碱式碳酸钴晶体在空气中煅烧得Co3O4产品。 已知:碱式碳酸钴晶体不溶于冷水和乙醇,可溶于温水,常压下高于30 ℃开始分解。 (1) 乙酸钻晶体中钴含量可用配位滴定法测定,下列说法正确的是________(填字母)。 a. 滴定前,锥形瓶和滴定管均须用标准溶液润洗 b. 读数前,需排除滴定管尖嘴处的气泡 c. 滴定时,眼睛注视锥形瓶中颜色变化 (2) “步骤Ⅰ”30 ℃水浴的装置如右图所示,温度计应置于________(填“a”或“b”)处。 (3) “步骤Ⅱ”采用高压密封加热的目的是________________________________。 (4) “步骤Ⅳ”中,在实验室煅烧碱式碳酸钴晶体所需的仪器除酒精灯、三脚架以外,还需要的硅酸盐质仪器有________________________________,煅烧时发生反应的化学方程式为____________________________________________________。 (5) “步骤Ⅲ”中,设计由“步骤Ⅱ”的浊液制备碱式碳酸钴晶体的实验方案:______________________________________________________________________________________________________________________。(实验须使用的试剂:蒸馏水、乙醇) 20. (14分)锂二次电池新正极材料的探索和研究对锂电池的发展非常关键。 (1) 锂硒电池具有优异的循环稳定性。 ①正极材料Se可由SO2通入亚硒酸(H2SeO3)溶液反应制得,则该反应的化学方程式为________________________________________。 ②一种锂硒电池放电时的工作原理如图1所示,写出正极的电极反应式:________________。充电时Li+向________(填“Se”或“Li”)极迁移。 ③ Li2Sex与正极碳基体结合时的能量变化如图2所示,图中3种Li2Sex与碳基体的结合能力由大到小的顺序是________。 (2) Li2S电池的理论能量密度高,其正极材料为碳包裹的硫化锂(Li2S@C)。 ① Li2S@C可由硫酸锂与壳聚糖高温下制得,其中壳聚糖的作用是____________________。 ②取一定量Li2S@C样品在空气中加热,测得样品固体残留率随温度的变化如图3所示。(固体残留率=×100%)分析300 ℃后,固体残留率变化的原因是 ____________________________________________________________。 21. (12分)工业上生产铬单质涉及的反应如下: Na2Cr2O7+2CCr2O3+Na2CO3+CO↑ Cr2O3+2Al2Cr+Al2O3 (1) Cr基态原子的核外电子排布式为____________________。 (2) Na、O、C的第一电离能从大到小的顺序为____________________。 (3) 与CO互为等电子体的一种分子为____________(填化学式)。 (4) Cr2O3具有两性,溶于NaOH溶液形成配合物Na[Cr(OH)4]。 Na[Cr(OH)4]中配体的化学式为________________,1 mol该配合物中含σ键数目为________。 (5) 合金CrAl晶体的晶胞如右图所示,写出该合金的化学式:________。 【参考答案】 1. C 2. B 3. C 4. D 5. B 6. A 7. C 8. B 9. D 10. B 11. CD 12. B 13. C 14. BC 15. BD 16. (12分) (1) CO2+2NH3·H2O===2NH+CO+H2O(2分) (2) c(2分) (3) 是(2分) (4) 初始时快速降低,是由于NH、CO(或HCO)等离子浓度因反应快速降低所致(1分); 后来由于氨水的电离及过量Ca(OH)2的电离导致离子浓度增大,导电能力逐渐上升(1分) (5) ① b(2分) ② Fe(OH)3胶粒小不易过滤(1分);Fe(OH)3胶粒吸附离子带相同电荷相互排斥,导致沉淀速率慢(1分) 17. (15分) (1) 碳碳双键、硝基(2分,少1个扣1分,有错别字不得分) (2) 加成反应(2分) (3) (3分,官能团原子连接方式错误不得分,C、H原子数目错误不得分) (4) 或 或其他合理答案(3分) (5) (5分) 18. (12分) (1) ① 氧化(2分) ②(2分) (2) 1∶4(2分) (3) 设鸡尾酒中含有C2H5OH的物质的量为x mol K2Cr2O7的总物质的量:n(K2Cr2O7)=17.00×10-3 L×0.200 0 mol·L-1=3.4×10-3 mol(1分) H2O2的总物质的量:n(H2O2)=19.00×10-3 L×0.400 0 mol·L-1=7.6×10-3 mol(1分) 根据2K2Cr2O7+3C2H5OH+8H2SO4===2Cr2(SO4)3+3CH3COOH+2K2SO4+11H2O x mol x mol x mol(1分) (K2Cr2O7、C2H5OH与CH3COOH的计量关系正确即得分) 滴定过程中 4H2O2 + K2Cr2O7 + H2SO4===2CrO5+5H2O+K2SO4 4×(3.4×10-3-x) mol (3.4×10-3-x) mol H2O2+CH3COOH===CH3COOOH+H2O x mol x mol 根据 4×(3.4×10-3-x)+x=7.6×10-3 解得x=3.6×10-3 mol(2分) c(C2H5OH)==3.6×10-3 mol÷0.02 L=0.18 mol·L-1(1分) 19. (15分) (1) bc(2分,少1个扣1分,多选或错选不得分) (2) b(2分) (3) 高压是防止生成的碱式碳酸钴分解(1分),密封是防止+2价钴被空气中O2氧化(1分) (4) 坩埚、泥三角(2分,少1个扣1分) 6[2CoCO3·3Co(OH)2·H2O]+5O210Co3O4+12CO2↑+24H2O(2分) (5) 冷却至室温(1分),过滤(1分),依次用蒸馏水(1分)和乙醇洗涤(1分),低温干燥(1分)得碱式碳酸钴晶体(前面步骤错误,不影响后续步骤得分) 20. (14分) (1) ① H2SeO3+2SO2+H2O===Se+2H2SO4(2分,不配平扣1分) ② 2Li++xSe+2e-===Li2Sex(2分) Li(2分) ③ Li2Se6>Li2Se4>Li2Se(2分) (2) ① 提供碳源(1分),将硫酸锂还原(作还原剂)(2分) ② 300 ℃后,样品主要发生两个反应过程:反应1为Li2S被O2氧化生成Li2SO4(写硫的含氧酸盐即给分),反应2为C被O2氧化生成CO2(写CO不扣分);前期固体残留率增加的原因是反应1为主,后期固体残留率减少的原因反应2为主(分析出两个反应同时发生且强调竞争得3分,未强调竞争关系得2分,只提及一个反应对固体残留率的影响得1分) 21. (12分,每空2分) (1) [Ar]3d54s1 (2) O>C>Na (3) SO3或BF3或COCl2或其他合理答案 (4) OH- 8×6.02×1023或8 mol (5) Cr2Al或AlCr2查看更多