- 2023-12-07 发布 |
- 37.5 KB |
- 8页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
广东省揭阳市揭西县2020届高三下学期综合测试(二)化学试题
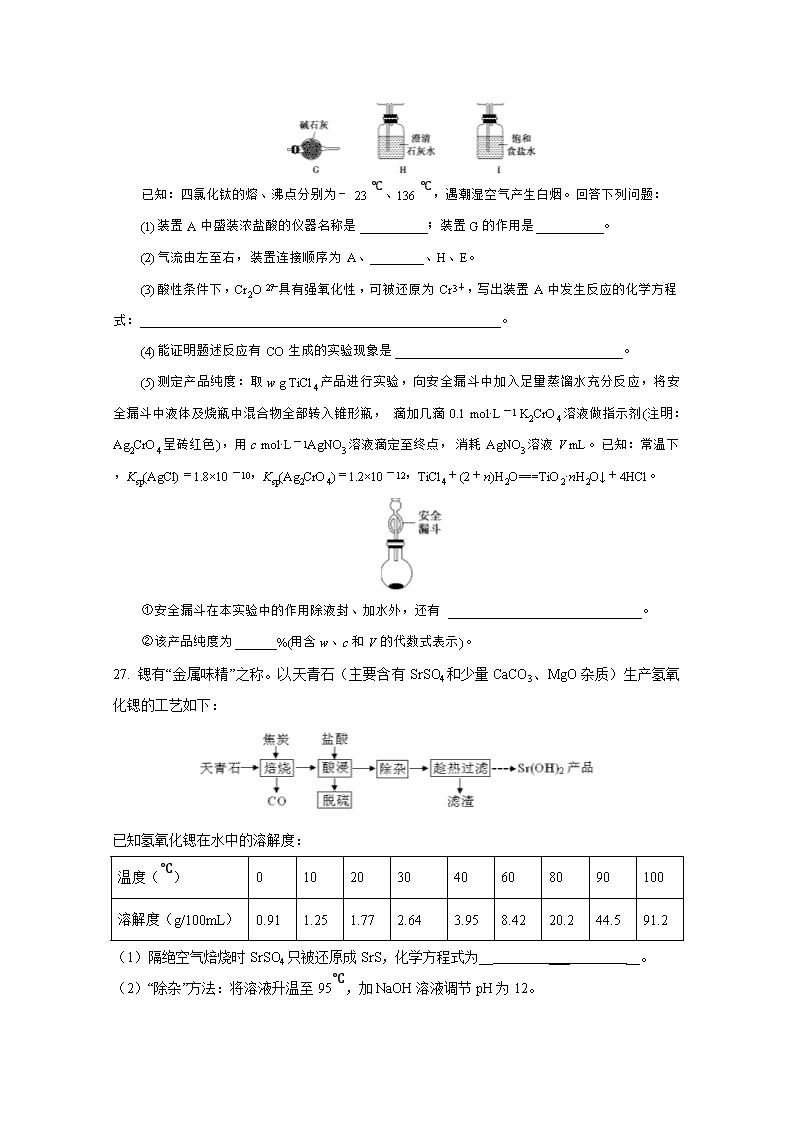
高三化学综合训练2 7. 化学与人类生产、生活密切相关,下列说法正确的是( ) A.有机玻璃受热软化,易于加工成型,是一种硅酸盐材料 B.煤的气化是物理变化,是高效、清洁地利用煤的重要途径 C.纯银器在空气中久置变黑是因为发生了电化学腐蚀 D.硫酸亚铁片和维生素C同时服用,能增强治疗缺铁性贫血的效果 8. 设NA为阿伏加德罗常数的值。下列说法正确的是( ) A.1 mol —CH3中含有的质子数为10NA B.25 ℃时,1 L pH=11的氨水中OH-的数目为0.001NA C.1 mol苯乙烯()中含有的碳碳双键数为4NA D.合成氨反应中投入28 g N2与足量H2,充分反应转移电子数为6NA 9. 茉莉醛具有浓郁的茉莉花香,其结构简式如图所示。关于茉莉醛的下列叙述错误的是( ) A.在加热和催化剂作用下,能被氢气还原 B.能被高锰酸钾酸性溶液氧化 C.在一定条件下能与溴发生取代反应 D.不能与氢溴酸发生加成反应 10. 锌—空气电池由活性炭(空气扩散极)、锌、苛性碱溶液构成,其中活性炭部分浸泡在苛性碱溶液中,其工作原理如图所示,负极产物是ZnO。下列有关锌—空气电池的说法正确的是( ) A.活性炭的作用是吸附空气,为电池提供氧化剂 B.原理图中的隔离膜为质子交换膜 C.负极反应式为Zn-2e-+H2O===ZnO+2H+ D.电池工作时,外电路中流过0.2 mol电子,消耗3.2 g O2 11. 已知草酸晶体(H2C2O4·2H2O)的熔点为101℃,170℃以上分解。下列选用的装置和药品能达到实验目的的是( ) 12. 主族元素W、X、Y、Z的原子序数依次递增,且均不大于20。W、X处于同周期,W、Y处于同主族,W、X、Z原子最外层电子数之和为13,Y的一种同素异形体容易自燃。下列说法正确的是( ) A.W、X、Y简单氢化物稳定性依次增强 B.Y的最高价氧化物可用作食品干燥剂 C.简单离子半径:Z>X>W D.Z的最高价氧化物对应水化物属于强碱 13. 已知金属离子M2+,25 ℃时在水中存在M2+(aq)、M(OH)+(aq)、M(OH)2(s)、M(OH)(aq)、M(OH)(aq)五种形态,该体系中各形态的物质的量分数(α)随pH的变化关系如图,下列叙述错误的是( ) A.P点的pH为12,则M(OH) ⇌ M(OH)2+OH-的平衡常数为10-2 B.M(OH)2完全沉淀后,增大溶液的pH,沉淀不会立即开始溶解 C.溶液pH达到14之前,沉淀M(OH)2已完全溶解 D.M(NO3)2溶液显酸性,其水解的离子方程式为M2++H2O⇌M(OH)++H+ 26. 钛被誉为“第三金属”,在航空航天领域有广泛应用。某小组利用TiO2(s)+2C(s)+2Cl2(g)TiCl4(g)+2CO(g)反应制备四氯化钛并验证产物CO,装置如图所示: 已知:四氯化钛的熔、沸点分别为-23 ℃、136 ℃,遇潮湿空气产生白烟。回答下列问题: (1)装置A中盛装浓盐酸的仪器名称是__________;装置G的作用是__________。 (2)气流由左至右,装置连接顺序为A、________、H、E。 (3)酸性条件下,Cr2O具有强氧化性,可被还原为Cr3+,写出装置A中发生反应的化学方程式:______________________________________________________。 (4)能证明题述反应有CO生成的实验现象是__________________________________。 (5)测定产品纯度:取w g TiCl4产品进行实验,向安全漏斗中加入足量蒸馏水充分反应,将安全漏斗中液体及烧瓶中混合物全部转入锥形瓶,滴加几滴0.1 mol·L-1 K2CrO4溶液做指示剂(注明:Ag2CrO4呈砖红色),用c mol·L-1AgNO3溶液滴定至终点,消耗AgNO3溶液V mL。已知:常温下,Ksp(AgCl)=1.8×10-10,Ksp(Ag2CrO4)=1.2×10-12,TiCl4+(2+n)H2O===TiO2·nH2O↓+4HCl。 ①安全漏斗在本实验中的作用除液封、加水外,还有_____________________________。 ②该产品纯度为______%(用含w、c和V的代数式表示)。 27. 锶有“金属味精”之称。以天青石(主要含有SrSO4和少量CaCO3、MgO杂质)生产氢氧化锶的工艺如下: 已知氢氧化锶在水中的溶解度: 温度(℃) 0 10 20 30 40 60 80 90 100 溶解度(g/100mL) 0.91 1.25 1.77 2.64 3.95 8.42 20.2 44.5 91.2 (1)隔绝空气焙烧时SrSO4只被还原成SrS,化学方程式为__ ___ __。 (2)“除杂”方法:将溶液升温至95℃,加NaOH溶液调节pH为12。 ①95℃时水的离子积KW=1.0×10-12,Ksp[Mg(OH)2]=1.2×10-10,则溶液中c(Mg2+)=______________。 ②若pH过大,将导致氢氧化锶的产率降低,请解释原因__ __。 (3)“趁热过滤”的目的是_______________________,“滤渣”的主要成分为_____________。 (4)从趁热过滤后的滤液中得到Sr(OH)2产品的步骤为___ _、过滤、洗涤、干燥。 (5)“脱硫”方法:用FeCl3溶液吸收酸浸产生的气体,请写出吸收时的离子方程式_ __;再用石墨电极电解吸收液,电解后可在“脱硫”中循环利用的物质是FeCl3溶液。请写出电解时阳极的电极反应:_ __。 28.(1)2017年中科院某研究团队通过设计一种新型Na-Fe3O4/HZSM-5多功能符合催化剂,成功实现了CO2直接加氢制取辛烷值汽油,该研究成果被评价为“CO2催化转化领域的突破性进展”。 已知:H2(g)+1/2O2(g)=H2O(l) ΔH1 = —a KJ/mol C8H18 (1)+25/2O2(g)=8CO2(g)+9H2O(1) ΔH2= —b KJ/mol 试写出25℃、101kPa条件下,CO2与H2反应生成汽油(以C8H18表示)的热化学方程式________________________________。 (2)利用CO2及H2为原料,在合适的催化剂(如Cu/ZnO催化剂)作用下,也可合成CH3OH,涉及的反应有: 甲:CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H= — 53.7 kJ·mol-1 平衡常数 K1 乙:CO2(g)+H2(g) CO(g)+H2O(g) △H= + 41.2 kJ·mol-1 平衡常数K2 ①CO(g)+2H2(g) CH3OH(g)的平衡常数K=______(用含K1、K2的表达式表示),该反应△H_____0(填“大于”或“小于”)。 ②提高CO2转化为CH3OH平衡转化率的措施有_______________________(填写两项)。 ③催化剂和反应体系的关系就像锁和钥匙的关系一样,具有高度的选择性。下列四组实验,控制CO2和H2初始投料比均为1:2.2,经过相同反应时间(t1min) 温度(K) 催化剂 CO2转化率(%) 甲醇选择性(%) 综合选项 543 Cu/ZnO纳米棒材料 12.3 42.3 A 543 11.9 72.7 B Cu/ZnO纳米片材料 553 Cu/ZnO纳米棒材料 15.3 39.1 C 553 Cu/ZnO纳米片材料 12.0 70.6 D 由表格中的数据可知,相同温度下不同的催化剂对CO2的转化为CH3OH的选择性有显著影响,根据上表所给数据结合反应原理,所得最优选项为___________(填字母符号)。 (3)以CO、H2为原料合成甲醇的反应为:CO(g)+2H2(g) CH3OH(g)。在体积均为2L的三个恒容密闭容器Ⅰ、Ⅱ、Ⅲ中,分别都充入1molCO和2molH2,三个容器的反应温度分别为T1、T2、T3且恒定不变。图1为三个容器中的反应均进行到5min时H2的体积分数示意图,其中有一个容器反应一定达到平衡状态。 ①0~5 min时间内容器Ⅱ中用CH3OH表示的化学反应速率为___ _______。 ②三个容器中一定达到平衡状态的是容器________ (填写容器代号)。 36. 盐酸利多卡因是局麻药及抗心律失常药,以芳香族化合物A和有机物D为主要原料,其合成路线如下: 请回答下列问题: (1)A属于芳香烃,其结构简式为________。C中所含官能团的名称为________。 (2)A→B、B→C的反应类型分别为________、________。 (3)写出C与D生成E的化学方程式:_____________________________________。 (4)C的同分异构体中属于芳香族化合物的有________种(不考虑立体异构);其中核磁共振氢谱为4组峰,峰面积之比为6∶2∶2∶1的结构简式为_________________________。 (5)已知:;②苯环上的甲基活化邻位和对位,硝基钝化邻位和对位。参照上述合成路线和信息,以为原料(无机试剂任选),设计制备对甲基乙酰苯胺的合成路线。 高三化学综合训练2参考答案 题号 7 8 9 10 11 12 13 答案 D B D A D D A 26.(1)分液漏斗 除去剩余的氯气 (2)I、D、B、C、G、F (3)K2Cr2O7+14HCl(浓)2KCl+2CrCl3+3Cl2↑+7H2O (4)装置F中黑色粉末变为红色、装置H中溶液变浑浊 (5)①吸收挥发的HCl ② 27. (1) SrSO4 + 4C SrS + 4CO↑ (2分) (2) ①1.2×10-10 mol•L-1 (2分)②OH-对氢氧化锶的溶解起抑制作用,OH-浓度过大,将使氢氧化锶沉淀析出 (2分) (3)防止温度降低使氢氧化锶析出而造成损失(2分); Ca(OH)2、Mg(OH)2 (1分) (4)降温结晶(1分) (5) 2Fe3+ + H2S == 2 Fe2+ + S↓ + 2H+ (2分) Fe2+— e- ==Fe3+ (2分) 28. (1)8CO2(g)+25H2(g)=C8H18(1)+16H2O(1) ΔH=—(25a-b)KJ/mol (2分) (2) ①K=K1/K2 (2分) ;小于(1分) ② 降低温度、减小产物浓度(2分) ③ B (2分) (3) ①0.0875mol/(L·min) (3分) ②Ⅲ (2分) 36. (1) 氨基 (2)硝化反应(或取代反应) 还原反应 (3) (4)19 (5)查看更多