- 2023-11-27 发布 |
- 37.5 KB |
- 26页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2019高考化学高分突破二轮复习专题十钠及其化合物课件(26张PPT)
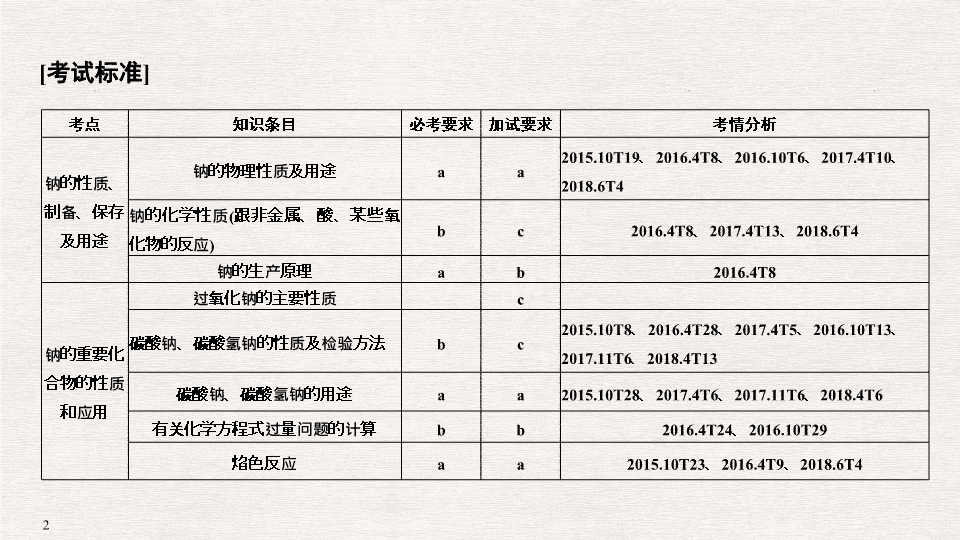
专题十 钠及其化合物 [ 考试标准 ] 考点 知识条目 必考要求 加试要求 考情分析 钠的性质、制备、保存及用途 钠的物理性质及用途 a a 2015.10T19 、 2016.4T8 、 2016.10T6 、 2017.4T10 、 2018.6T4 钠的化学性质 ( 跟非金属、酸、某些氧化物的反应 ) b c 2016.4T8 、 2017.4T13 、 2018.6T4 钠的生产原理 a b 2016.4T8 钠的重要化合物的性质和应用 过氧化钠的主要性质 c 碳酸钠、碳酸氢钠的性质及检验方法 b c 2015.10T8 、 2016.4T28 、 2017.4T5 、 2016.10T13 、 2017.11T6 、 2018.4T13 碳酸钠、碳酸氢钠的用途 a a 2015.10T28 、 2017.4T6 、 2017.11T6 、 2018.4T6 有关化学方程式过量问题的计算 b b 2016.4T24 、 2016.10T29 焰色反应 a a 2015.10T23 、 2016.4T9 、 2018.6T4 考点一:钠的取用和保存 1. (2017· 浙江嘉兴高一期末 ) 下列有关说法正确的是 ( ) A. 取用后剩余的金属钠不能放回原瓶 B. 将金属钠放置在空气中,最终转化为碳酸钠 C. 铁在氧气中燃烧,可以得到红色的三氧化二铁 D. 硫在过量的氧气中燃烧,可以得到产物 SO 3 解析 A. 剩余的钠需要放回原瓶,故 A 错误; B. 金属钠暴露在空气中:钠与空气中氧气极易反应生成氧化钠,致使钠表面变暗,氧化钠与空气中的水蒸气反应生成白色固体氢氧化钠,氢氧化钠易潮解表面变成溶液,氢氧化钠是强碱与空气中的 CO 2 气体反应,生成白色带结晶水的固体 Na 2 CO 3 ·10H 2 O ,十水碳酸钠易风化生成白色粉末碳酸钠,故 B 正确; C. 铁在氧气中燃烧,生成四氧化三铁,而不是氧化铁,故 C 错误; D. 硫在氧气中燃烧生成二氧化硫,而不是三氧化硫,故 D 错误。 答案 B 考点二:钠的用途 2. (2018· 金华一中高一 ) 下列说法不正确的是 ( ) A. 工业上可以用电解饱和食盐水制备氯气 B. 钠是一种强还原剂,可以把钛、锆、铌、钽等从其熔融盐中置换出来 C. 常温下钠和钾的合金为液态,可作快中子反应堆的导热剂 D.Cl 2 和 NaCl 中均含有氯元素,它们的化学性质相同 解析 A 项氯碱工业上用电解饱和食盐水制备氯气,正确, B 项置换熔融盐中的钛、锆、铌、钽等单质是金属钠强还原性的重要用途,正确, C 项常温下钠和钾的合金为液态,可作快中子反应堆的导热剂,正确, D 项单质氯气和氯离子化学性质完全不同,错误。 答案 D 考点三:钠的化学性质 3. (2017· 宁波北仑中学 ) 下列关于钠的说法中错误的是 ( ) A. 金属钠非常活泼 B. 钠可以从硫酸铜溶液中还原出铜单质 C. 钠在氯气中燃烧产生大量的白烟 D. 钠元素在自然界中都是以化合态存在 解析 金属钠是短周期金属中最活泼的金属, A 正确;硫酸铜溶液中投入钠,金属钠先跟水反应置换出氢气, B 项错误;钠在氯气中燃烧产生白烟生成氯化钠, C 项正确;钠元素非常活泼,游离态不存在于自然界中, D 项正确。 答案 B 考点四: Na 2 O 2 的性质 ( 加试 ) 4. (2018· 浙江桐乡一中高一模拟 ) 关于 Na 2 O 2 的叙述正确的是 ( N A 为阿伏加德罗常数的值 )( ) A.7.8 g Na 2 O 2 含有的共价键数为 0.2 N A B.7.8 g Na 2 S 与 Na 2 O 2 的混合物,含离子总数为 0.3 N A C.7.8 g Na 2 O 2 与足量的 CO 2 充分反应,转移的电子数为 0.2 N A D.0.2 mol Na 被完全氧化生成 7.8 g Na 2 O 2 ,转移电子的数目为 0.4 N A 答案 B 考点五: Na 2 CO 3 和 NaHCO 3 的鉴别 5. (2017· 杭州七县市期末 ) 下列有关 Na 2 CO 3 和 NaHCO 3 比较中,不正确的是 ( ) A. 热稳定性: Na 2 CO 3 > NaHCO 3 B. 相同温度下, 0.1 mol·L - 1 盐溶液的 pH : Na 2 CO 3 > NaHCO 3 C. 等质量的碳酸钠和碳酸氢钠分别与足量盐酸反应放出气体的量: Na 2 CO 3 < NaHCO 3 D. 相同温度下, 0.1 mol·L - 1 盐溶液分别与 0.1 mol·L - 1 HCl 反应的剧烈程度: Na 2 CO 3 > NaHCO 3 答案 D A. Oa 段反应的离子方程式与 ab 段反应的离子方程式相同 B. 该 Na 2 CO 3 溶液中含有 1 mol Na 2 CO 3 C. b 点的数值为 0.6 D. b 点时生成 CO 2 的物质的量为 0.3 mol 答案 C 考点七:焰色反应 7. (2018· 宁波慈溪实验中学 ) 用洁净的铂丝蘸取无色溶液,在无色灯焰上观察时看到黄色火焰,则下列有关叙述正确的是 ( ) A. 该溶液只含有 Na + B. 该溶液一定含有 Na + ,也可能含有 K + C. 该溶液不含 Na + ,可能含 K + D. 该溶液可能含 Na + 或 K + 中的一种 解析 在无色灯焰上观察时看到黄色火焰,能说明溶液中一定含有钠元素,但并没有用蓝色钴玻璃透过观察,不能判断钾元素是否存在,因此 B 项正确。 答案 B 易错点一 不能正确认识钠与盐的反应 钠与盐的反应分为两种情况: (1) 与熔融状态下的盐反应:因为钠的化学性质十分活泼,所以钠可以和熔融状态下某些金属盐反应,置换出其中的金属,如工业上用钠和 TiCl 4 反应制金属 Ti : [ 易错训练 1] (2018· 桐乡第一中学 ) 将 0.05 mol Na 分别投入到盛有 100 mL 水、 100 mL 盐酸、 100 mL 硫酸铜溶液的 X 、 Y 、 Z 三个烧杯中,下列有关说法错误的是 ( ) A. 三个烧杯中一定均会发生的离子反应有: 2Na + 2H 2 O===2Na + + 2OH - + H 2 ↑ B. 三个烧杯中钠均在液面上剧烈反应,相比而言, X 烧杯中的反应平缓些 C.Z 烧杯中一定会有沉淀生成,但沉淀不是单质铜 D. 三个烧杯中置换生成气体的物质的量一定相同 解析 钠与盐酸反应本质是 Na 与 H + 反应,当酸足量时钠只与酸反应, A 错;三种溶液中,水中氢离子浓度最小,故反应速率最小, B 对; Z 烧杯中的沉淀是 Cu(OH) 2 , C 对;三个烧杯中生成的气体均是 H 2 ,而且 H 2 物质的量相同, D 对。 答案 A 易错点二 分不清 Na 2 O 和 Na 2 O 2 的区别 名称 氧化钠 过氧化钠 化学式 Na 2 O Na 2 O 2 类别 碱性氧化物 过氧化物 颜色和状态 白色固体 淡黄色固体 与水反应 Na 2 O + H 2 O===2NaOH 2Na 2 O 2 + 2H 2 O===4NaOH + O 2 ↑ 与 CO 2 反应 Na 2 O + CO 2 ===Na 2 CO 3 2Na 2 O 2 + 2CO 2 ===2Na 2 CO 3 + O 2 与酸反应 Na 2 O + 2HCl===2NaCl + H 2 O 2Na 2 O 2 + 4HCl===4NaCl + O 2 ↑ + 2H 2 O 生成条件 钠常温下缓慢氧化 加热钠或氧化钠 特别提醒: Na 2 O 2 中,阴、阳离子个数比是 1 ∶ 2 。 [ 易错训练 2] ( 加试题 ) (2016· 浙江省东阳中学高三模拟 ) 现有一定量含有 Na 2 O 杂质的 Na 2 O 2 试样。请从下图中选用适当的实验装置,设计一个最简单的实验,测定 Na 2 O 2 试样的纯度 ( 可供选用的反应物只有 CaCO 3 固体, 6 mol·L - 1 盐酸和蒸馏水 ) 。 请填写下列空白: (1) 写出实验中 Na 2 O 2 和 Na 2 O 分别发生反应的化学方程式: ___________________________________________________________ 。 (2) 应选用的装置是 ________( 只要求写出图中装置的标号 ) 。 (3) 所选用装置的连接顺序应是 ( 填各接口的字母,连接胶管省略 ) : ___________________________________________________________ 。 解析 利用图中所示装置可知反应原理为: 2Na 2 O 2 + 2H 2 O===4NaOH + O 2 ↑ ,通过测量生成 O 2 的体积,确定 Na 2 O 2 的纯度。故可选装置为 ① 、 ④ 、 ⑤ 。实验时 ⑤ 中为 Na 2 O 2 与 H 2 O 反应, ① 为收集氧气装置, ④ 为测量氧气体积装置。 答案 (1)2Na 2 O 2 + 2H 2 O===4NaOH + O 2 ↑ , Na 2 O + H 2 O===2NaOH (2) ①④⑤ (3)GBAF 易错点三 不能正确认识 Na 2 O 2 的强氧化性和漂白性 [ 易错训练 3] (2018· 浙江金华外国语学校高一期中 ) 为了使宇航员在飞船中得到一个稳定的、良好的生存环境,一般在飞船内安装盛有 Na 2 O 2 或 K 2 O 2 颗粒的装置,它的用途是产生氧气。下列关于 Na 2 O 2 的叙述正确的是 ( ) A.Na 2 O 2 中阴、阳离子的个数比为 1 ∶ 1 B.Na 2 O 2 分别与水及 CO 2 反应产生相同量的 O 2 时,需要水和 CO 2 的质量相等 C.Na 2 O 2 分别与水及 CO 2 反应产生相同量的 O 2 时,转移电子的物质的量相等 D.Na 2 O 2 的漂白原理与 SO 2 的漂白原理相同 答案 C 易错点四 不会利用向溶液中滴加盐酸的实验现象的差别判断 CO 2 与 NaOH 反应的产物 将 CO 2 通入 NaOH 溶液中,充分反应后再向溶液中滴加盐酸,设产生的气体体积与加入盐酸的体积的关系如图所示,则依据 a 与 b 的关系可以判断溶液的组成并计算各组分的物质的量。 [ 易错训练 4] (2017· 浙江绍兴一中 ) 某学生用 Na 2 CO 3 和 KHCO 3 组成的某混合物进行实验,测得如表数据 ( 盐酸的物质的量浓度相等且不考虑 HCl 的挥发 ) 下列有关的说法中,正确的是 ( ) 实验序号 ① ② ③ ④ 盐酸体积 /mL 50 50 50 50 固体质量 /g 3.06 6.12 9.18 12.24 生成气体体积 /L( 标况 ) 0.672 1.344 1.568 1.344 A. 盐酸的物质的量浓度为 2 mol·L - 1 B. 原混合物样品中 n (Na 2 CO 3 ) ∶ n (KHCO 3 ) = 1 ∶ 1 C. 实验 ② 中,混合物过量 D. 实验 ④ 反应后,至少需继续加入 40 mL 的该盐酸溶液才能把 12.24 g 的混合物全部反应 答案 A查看更多