- 2023-11-17 发布 |
- 37.5 KB |
- 3页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
四川省绵阳市中考化学试题
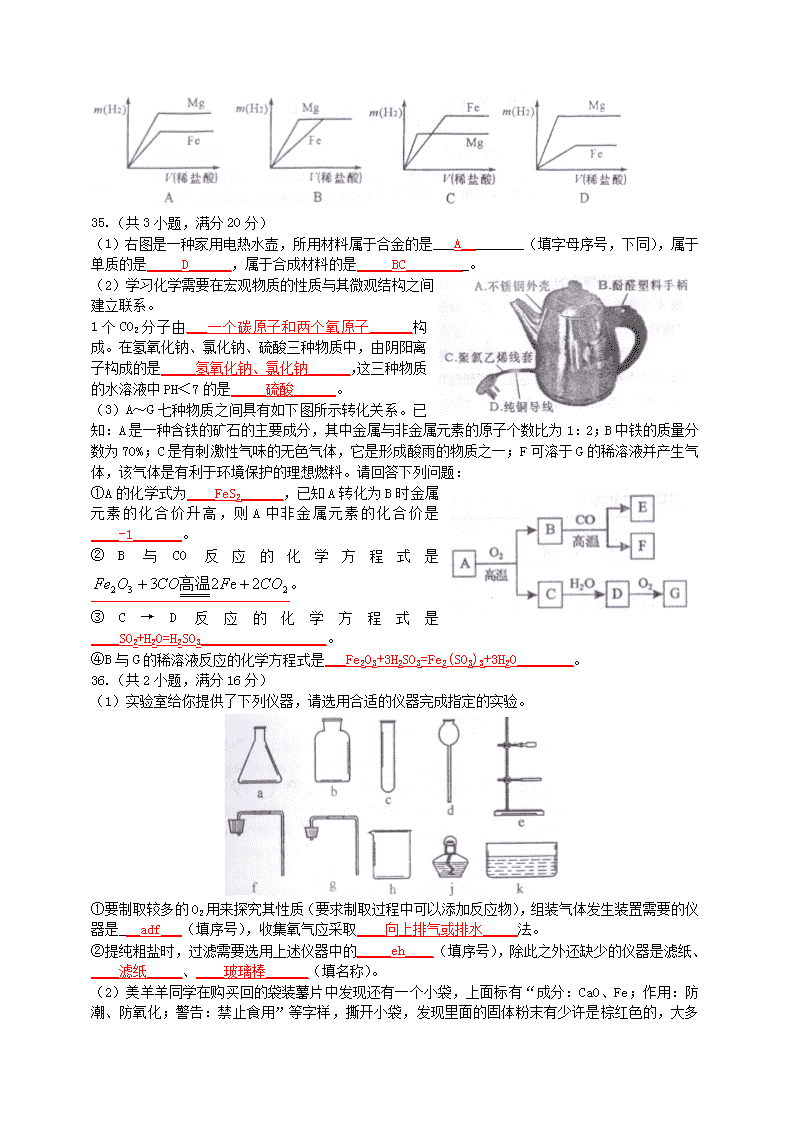
绵阳市初2011级学业考试暨高中阶段招生考试 化学试题 9.生活中下列做法利用了化学反应原理的是( ) A.自制简易净水器净化自来水 B.门锁不易打开时灌入铅笔芯粉末 C.用天然气作燃料煮饭 D.用活性炭除去冰箱中的异味 10.阳刚同学按教材中的家庭小实验自制汽水,可是家里没有冰箱,为了使自制的汽水变得冰凉可口,他想到可以从集镇上购煤一种商品来产生制冷效果,他应该购买的是( ) A.硝酸铵B.小苏打C.生石灰D.食盐 11.瘦肉精是一类对人体健康危害极大的化学物质,政府已严禁在猪饲料中添加瘦肉精。常见的瘦肉精化学式为C12H18OCl2N2,下列有关这种瘦肉精的说法正确的是( ) A.是一种无机化合物 B.分子中碳、氢、氧三种元素的质量比为72:9:8 C.相对分子质量为277g D.有C12H18O、Cl2、N2三种分子组成 12.人们常在可燃建筑材料中添加阻燃剂以防止火灾。Mg(OH)2是一种常见的阻燃剂,它在380℃时分解成水蒸气和耐高温的MgO,并吸收大量的热。下列说法错误的是( ) A.Mg(OH)2分解吸热能降低可燃物的着火点 B.Mg(OH)2分解吸热能降低可燃物的温度 C.Mg(OH)2分解的产物能使可燃物与氧气隔绝 D.Mg CO3 比CaCO3易分解,也可作阻燃剂 13.右图是甲、乙、丙三种物质的溶解度曲线,下列说法不正确的是( ) A.甲的溶解度受温度影响最大 B.10℃时,三种物质的溶解度大小顺序为丙>乙>甲 C.30℃时,乙、丙两种物质的饱和溶液溶质质量分数相等 D.50℃时,分别将40g甲、乙两种物质放入100g水中充分搅拌,均得到饱和溶液 14.下列实验操作不符合规范的是( ) A.点燃可燃性气体之前检验气体的纯度 B.蒸发滤液时用玻璃棒不断搅拌滤液 C.通过口尝来确定实验室中某种试剂的味道 D.用酒精灯加热试管里的固体时先预热 15.为除去下列物质中的杂质(括号内为杂质),下列操作方法不能达到目的的是( ) 选项 物质(杂质) 操作方法 A Cu(Fe) 加足量稀硫酸,充分反应后过滤 B CO(O2) 缓慢通过灼热铜网 C NaCl溶液(Na2CO3) 加盐酸至恰好不再产生气泡为止 D FeSO4溶液(CuSO4) 加入足量铁屑,充分反应后过滤 16.镍氢充电电池有着广泛应用,镍(Ni)及其化合物能发生下列反应: ①Ni+2HCl=NiCl2+H2↑ ②NiO+2HCl=NiCl2+H2O ③NiO2+4HCl=NiCl2+Cl2+2H2O 对上述反应的分析判断错误的是 A.镍能与氯化铜溶液发生置换反应 B.NiCl2能与NaOH溶液发生复分解反应 C.反应②和③都是复分解反应 D.反应①、③中Ni的化合价都发生了变化 17.相同质量的Mg、Fe分别与稀盐酸作用,产生H2的质量m(H2)与加入稀盐酸的体积V(稀盐酸)关系如下图所示,其中正确的是 D 35.(共3小题,满分20分) (1)右图是一种家用电热水壶,所用材料属于合金的是___A_________(填字母序号,下同),属于单质的是_____D______,属于合成材料的是_____BC_________。 (2)学习化学需要在宏观物质的性质与其微观结构之间建立联系。 1个CO2分子由___一个碳原子和两个氧原子______构成。在氢氧化钠、氯化钠、硫酸三种物质中,由阴阳离子构成的是_____氢氧化钠、氯化钠______,这三种物质的水溶液中PH<7的是_____硫酸______。 (3)A~G七种物质之间具有如下图所示转化关系。已知:A是一种含铁的矿石的主要成分,其中金属与非金属元素的原子个数比为1:2;B中铁的质量分数为70%;C是有刺激性气味的无色气体,它是形成酸雨的物质之一;F可溶于G的稀溶液并产生气体,该气体是有利于环境保护的理想燃料。请回答下列问题: ①A的化学式为____FeS2______,已知A转化为B时金属元素的化合价升高,则A中非金属元素的化合价是____-1_______。 ②B与CO反应的化学方程式是。 ③C→D反应的化学方程式是____SO2+H2O=H2SO3__________________。 ④B与G的稀溶液反应的化学方程式是___Fe2O3+3H2SO3=Fe2(SO3)3+3H2O________。 36.(共2小题,满分16分) (1)实验室给你提供了下列仪器,请选用合适的仪器完成指定的实验。 ①要制取较多的O2用来探究其性质(要求制取过程中可以添加反应物),组装气体发生装置需要的仪器是___adf___(填序号),收集氧气应采取____向上排气或排水_____法。 ②提纯粗盐时,过滤需要选用上述仪器中的_____eh____(填序号),除此之外还缺少的仪器是滤纸、____滤纸_____、____玻璃棒______(填名称)。 (2)美羊羊同学在购买回的袋装薯片中发现还有一个小袋,上面标有“成分:CaO、Fe;作用:防潮、防氧化;警告:禁止食用” 等字样,撕开小袋,发现里面的固体粉末有少许是棕红色的,大多数是灰白色的。经过分析,她认为棕红色粉末是Fe2O3,灰白色粉末应该含有CaCO3和Fe,为验证自己的判断,美羊羊同学打算进行实验探究,请你一同参与。 【实验目的】证实灰白色粉末中含有CaCO3和Fe。 【实验设计】装置如下图所示: 【实验预测与分析】 ①若要证实样品中含有CaCO3,观察到的实验现象是_______B中澄清石灰水变浑浊____________,B中发生反应的化学方程式为___Ca(OH)2+CO2=CaCO3↓+H2O_____。 ②若要证实样品中含有Fe,E中应观察到的现象是____无水硫酸铜变成蓝色_________,此时C装置的作用是____干燥____________。 ③看了美羊羊同学的分析结论,有同学认为小袋内灰白色粉末中还应该有别的物质,请你写出其中一种物质的化学式____ Ca(OH)2______。 37.(共1个题,满分7分) 我市有丰富的石灰石资源,为了测定某地石灰石中碳酸钙的质量分数,取7.5g样品放入烧杯,加入稀盐酸至恰好不再产生气体时消耗盐酸34.7g,放出的气体在常温下体积为1.1L。 (1)常温下CO2气体的密度为2.0g/L,则上述反应放出气体的质量为____2.2_____g。 (2)若石灰石中的杂质均不溶于水且不与盐酸反应,计算石灰石中CaCO3的质量分数和反应所得溶液中溶质的质量分数(计算最终结果保留1位小数)。 解:7.5g石灰石样品中含有CaCO3的质量为X,反应生成CaCl2的质量为Y CaCO3+2HCl=CaCl2+H2O+CO2↑ 100 111 44 X Y 2.2g X=5g Y=5.55g 石灰石中CaCO3的质量分数为: 反应所得溶液中溶质的质量分数为: 答:石灰石中CaCO3的质量分数为66.7%,反应所得溶液中溶质的质量分数为14.8%。查看更多