2018-2019学年云南省云天化中学高一下学期期中考试化学试题
2018-2019学年云南省云天化中学高一下学期期中考试化学试题
可能用到的相对原子质量:H-1 C-12 O-16 N-14 S-32 Fe-56 Al-27
第I卷(选择题,共40分)
一、 单项选择题:(本题共20小题,每小题2分,共40分)。
1.下列化学用语正确的是
A.Cl—离子的结构示意图: B.氯化氢的电子式为:
C.醋酸的电离方程式:CH3COOH=CH3COO-+H+ D.含10个中子的氧原子的核素符号:
2.分类法是一种行之有效、简单易行的科学方法。下列有关物质分类或归类正确的是
①混合物:漂白粉、王水、Fe(OH)3胶体、冰水混合物 ②化合物: CaCl2、NaOH、 HCl、HT
③同素异形体:C60、金刚石、石墨 ④电解质:胆矾、碳酸钡、冰醋酸、氧化钾
⑤硅酸盐:光导纤维、水晶、玻璃、水泥
A.①②④⑤ B.③④⑤ C.①③④ D.③④
3.下列说法中正确的是
A.物质发生化学反应时都伴随着能量变化,伴随能量变化的物质变化也一定是化学变化
B.需要加热的化学反应一定是吸热反应,不需要加热就能进行的反应一定是放热反应
C.吸热反应就是反应物的总能量比生成物的总能量高;也可以理解为化学键断裂时吸收的能量比化学键形成时放出的能量多
D.因为3O2=2O3是吸热反应,所以臭氧比氧气的化学性质更活泼
4.某原电池结构如图所示,下列有关该原电池的说法不正确的是
A.能将化学能转换成电能
B.电子从铁棒经外电路流向碳棒,再经稀硫酸流向铁棒,形成闭合回路
C.碳棒上发生还原反应
D.总反应为Fe+H2SO4= FeSO4+H2↑
5.对可逆反应4NH3(g)+5O2(g)4NO(g)+6H2O(g),下列叙述正确的是
A.达到化学平衡时,正逆反应速率为零
B.若单位时间内生成xmol NO的同时,生成xmol NH3,则反应达到平衡状态
C.达到化学平衡时,若增大容器容积,则正反应速率减小,逆反应速率增大
D.化学反应速率关系:2v(NH3)=3v(H2O)
6.下列能大量共存,且溶液为无色透明的离子组是
A.Fe3+、Na+、Cl-、NO3- B.H+、NH4+ 、NO3- 、I-
C.NH4+、K+、NO3- 、SO42- D.K+、NH4+ 、NO3- 、OH-
7.下列离子方程式书写正确的是
A.Na 与水反应:2Na+2H2O=2Na++2OH-+H2↑
B.FeCl3 腐蚀电路板:Fe3++Cu=Fe2++Cu2+
C.Cl2 与水反应:Cl2+H2O=2H++Cl-+ClO-
D.石灰石与醋酸反应:CaCO3+2H+=Ca2++H2O+CO2↑
8.已知5KCl + KClO3 +3H2SO4==3Cl2 ↑+ 3K2SO4 + 3H2O ,下列说法不正确的是
A.H2SO4 既不是氧化剂又不是还原剂 B.1mol KClO3 参加反应时有5mol电子转移
C.KClO3是氧化剂 D.被氧化与被还原的氯元素的质量比为1:5
9.设NA为阿伏加德罗常数的值,下列叙述正确的是
A.0.5mol 含中子数为8NA
B.常温下,1 mol NH4Cl含共价键数目为5NA
C.足量的Cu与含溶质1mol的浓H2SO4反应,转移的电子数为NA
D.11.2LH2和O2的混合气体中分子数目为0.5NA
10.金属钛无毒且有惰性,能与肌肉和骨骼生长在一起,因而有“生物金属”之称。下列有关和的说法中正确的
A.和中均含有 22 个中子 B.和的化学性质不同
C.和互称为同位素 D.和为同一核素
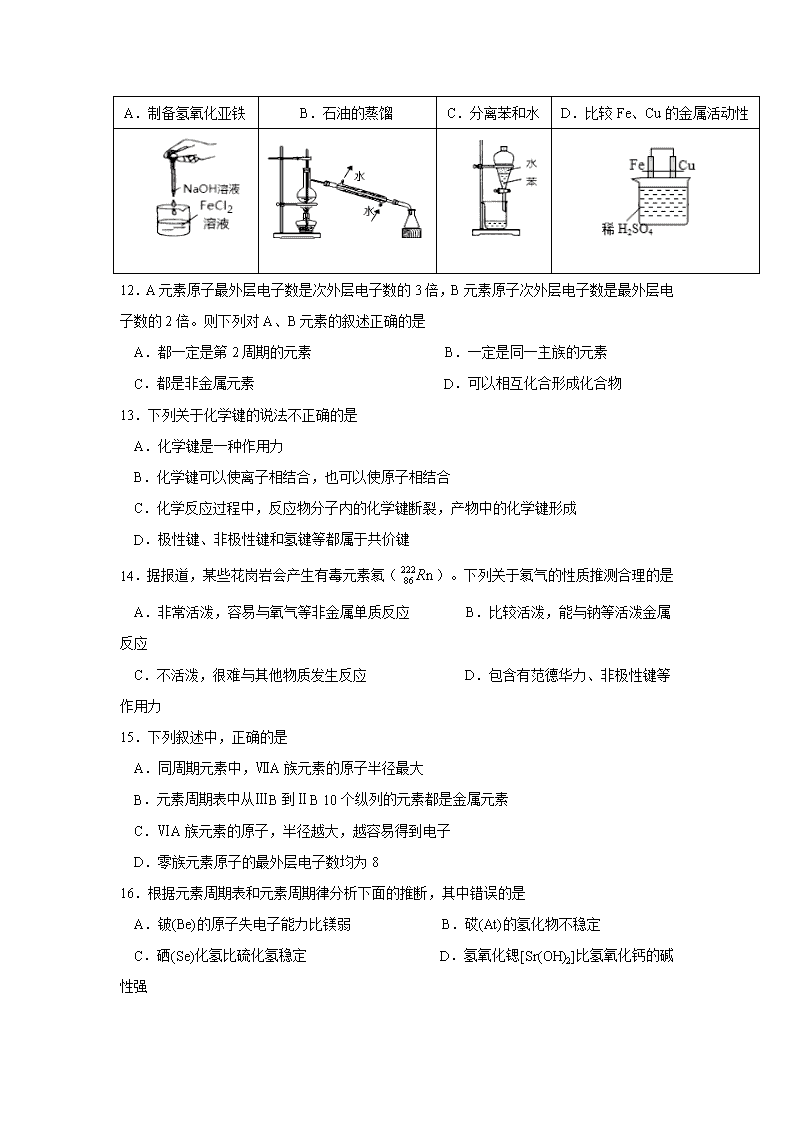
11.下列实验装置或操作正确且能达到实验目的的是
A.制备氢氧化亚铁
B.石油的蒸馏
C.分离苯和水
D.比较Fe、Cu的金属活动性
12.A元素原子最外层电子数是次外层电子数的3倍,B元素原子次外层电子数是最外层电子数的2倍。则下列对A、B元素的叙述正确的是
A.都一定是第2周期的元素 B.一定是同一主族的元素
C.都是非金属元素 D.可以相互化合形成化合物
13.下列关于化学键的说法不正确的是
A.化学键是一种作用力
B.化学键可以使离子相结合,也可以使原子相结合
C.化学反应过程中,反应物分子内的化学键断裂,产物中的化学键形成
D.极性键、非极性键和氢键等都属于共价键
14.据报道,某些花岗岩会产生有毒元素氡()。下列关于氡气的性质推测合理的是
A.非常活泼,容易与氧气等非金属单质反应 B.比较活泼,能与钠等活泼金属反应
C.不活泼,很难与其他物质发生反应 D.包含有范德华力、非极性键等作用力
15.下列叙述中,正确的是
A.同周期元素中,ⅦA族元素的原子半径最大
B.元素周期表中从ⅢB到ⅡB 10个纵列的元素都是金属元素
C.ⅥA族元素的原子,半径越大,越容易得到电子
D.零族元素原子的最外层电子数均为8
16.根据元素周期表和元素周期律分析下面的推断,其中错误的是
A.铍(Be)的原子失电子能力比镁弱 B.砹(At)的氢化物不稳定
C.硒(Se)化氢比硫化氢稳定 D.氢氧化锶[Sr(OH)2]比氢氧化钙的碱性强
17.联合国宣布2019年为“国际化学元素周期表年”。现有四种不同主族短周期元素X、Y、Z、W的原子序数依次递增,X与Y形成的化合物是光合作用的原料之一,Z、W处于同周期且族序数相差6。下列说法正确的是
A.元素非金属性:X>W B.Y和Z形成的化合物中只存在离子键
C.Z、W的简单离子半径:Z
W
B.X与Y可以形成原子个数比为1:1和1:2的两种离子化合物
C.由X、Y、Z、W、R五种元素形成的简单离子中半径最小的是X2-
D.Y和Z两者最高价氧化物对应的水化物能相互反应
19.W、X、Y、Z四种短周期元素在周期表中的相对位置如图所示。W、X、Y、Z原子的最外层电子数之和为21。下列说法中错误的是
A. 元素X的单质能与强酸、强碱反应
B.W的氢化物水溶液可以用于刻蚀玻璃
C.气态氢化物的稳定性:W>Y
D.简单阴离子的还原性:W>Z
20.某待测溶液中可能含有Na+、SO42-、SO32-、Cl-、Br-、CO32-、HCO3-中的一种或多种,进行如下图所示的实验,每次实验所加试剂均过量。下列说法不正确的是
A.SO42-、SO32-至少含有一种 B.沉淀B的化学式为 BaCO3
C.肯定存在的离子有 Na+、CO32-、HCO3-、Cl- D.肯定不存在Br—
第Ⅱ卷(非选择题,共60分)
二、填空题(本题共5小题,共60分)。
21.(14分)1869年俄国化学家门捷列夫制出第一张元素周期表,到现在形成的周期表经过了众多化学家的艰辛努力。元素周期表体现了元素位构性的关系,揭示了元素间的内在联系。下图是元素周期表的一部分,回答下列问题:
(1)元素Ga在元素周期表中的位置为: 。
(2)Sn的最高正价为________,Cl的最高价氧化物对应水化物的化学式为________,Bi的最高价氧化 物的化学式为________。
(3)根据元素周期律,推断:
①阴影部分元素形成的氢化物中沸点最高的是________。
②H3AsO4、H2SeO4的酸性强弱为:H3AsO4________H2SeO4(填“>”、“<”、“=”或“无法比较”)。
③氢化物的还原性:H2O________H2S(填“>”、“<”、“=”或“无法比较”)。
④原子半径比较:N________Si(填“>”、“<”、“=”或“无法比较”)。
(4)可在图中分界线(虚线部分)附近寻找________(填序号)。
A.优良的催化剂 B.半导体材料 C.合金材料 D.农药
(5) 若比较C、Si的非金属性强弱,请从下列试剂中选择最佳试剂组合进行实验, 请写出实验过程:
(可供选择的药品有:CaCO3固体、稀硫酸、盐酸、饱和NaHCO3溶液、饱和Na2CO3溶液、硅酸钠溶液)
22.(12分)A、X、W、D、E为短周期元素,且原子序数依次增大。A、D同主族,X、W同周期, X形成的气态氢化物可使湿润的红色石蕊试纸变蓝, A、W能形成两种液态化合物A2W和A2W2,E元素的周期序数与主族序数相等。
(1)W的原子结构示意图为________。
(2)A、W两种元素能形成含18电子的分子,请写出该分子的电子式:_______________。
用电子式表示化合物D2W的形成过程______________________________________。
(3)下列事实能说明W元素的非金属性比S元素的非金属性强的是________ (填字母)。
a.W单质与H2S溶液反应,溶液变浑浊
b.在氧化还原反应中,1 mol W单质比1 mol S得电子多
c.W和S两元素的简单氢化物受热分解,前者的分解温度高
(4)X的最高价氧化物对应水化物与其简单气态氢化物所形成的化合物中含有的化学键类型是_______
(5)废印刷电路板上含有铜,以往的回收方法是将其灼烧使铜转化为氧化铜,再用硫酸溶解。现在改用
A2W2和稀硫酸浸泡废印刷电路板既达到上述目的,又保护了环境,试写出反应的离子方程式
________________________________________________________________。
23.(12分)铝土矿(主要成分为Al2O3,还含有杂质SiO2、Fe2O3)是工业上制备氧化铝的主要原料。工业上提取氧化铝的工艺流程如下:
(1)沉淀 A、B的成分分别是____________、____________;步骤②中的试剂a是_________;(以上均 填化学式)。
(2)试写出步骤③中发生反应的离子方程式 、
。
(3)简述检验所得滤液甲中存在Fe3+的操作方法: 。
24.(10分)高铁酸钾(K2FeO4)是一新型、高效、无毒的多功能水处理剂。制备K2FeO4如下图:
查阅资料:K2FeO4为紫色固体,微溶于KOH溶液,具有强氧化性,在酸性或中性溶液中快速产生O2,在碱性溶液中较稳定。
(1)A为制取氯气发生装置,其中盛放浓盐酸的仪器名称为__________ _,A中化学反应的还原剂是 。
(2)装置B的作用是除杂,所用试剂为___________。
(3)C为制备K2FeO4装置,KOH溶液过量的原因是 。
(4)D为尾气处理装置,发生反应的离子方程式为__________________________________________。
25.(12分)某化学研究性学习小组探究与铜有关的物质的性质,过程设计如下:
(提出猜想)
问题1:在周期表中,铜与铝的位置很接近,氢氧化铝具有两性,氢氧化铜有两性码?
问题2:铁和铜都有变价,一般情况下,Fe2+的稳定性小于的Fe3+,Cu+的稳定性也小于Cu2+吗?
问题3:硫酸铜溶液呈蓝色,铜与浓硝酸常温下反应生成的溶液也是蓝色吗?
(实验探究)
I. 解决问题1:
(1)实验需配制100mL 0.50mol·L-1 CuSO4溶液,除了天平、烧杯、玻璃棒、胶头滴管以外必需的玻璃仪器是________________。
(2)为达到目的,某同学认为只要进行两次实验即可得出结论。请写出实验②的具体内容。
①向盛有CuSO4溶液的试管中滴加NaOH溶液至过量,观察生成的Cu(OH)2沉淀是否溶解;
② 。
II. 解决问题2的实验步骤和现象如下:
①取一定量制得的氢氧化铜固体,于坩埚中灼烧,当温度达到80ºC~100ºC得到黑色固体粉末;继续加热至1000ºC以上,黑色粉末全部变成红色粉末氧化亚铜(Cu2O);
②取适量红色氧化亚铜粉末于洁净试管中,加入过量的稀硫酸,得到蓝色溶液,同时观察到试管底部还有红色固体存在。根据以上实验及现象:
(3)写出氧化亚铜与稀硫酸反应的离子方程式 。
(4)从实验中可得出的结论是:当温度在1000ºC以上时________(填:Cu2+或Cu+,下同)稳定,在酸性溶液中________稳定。
III. 解决问题3,某同学设计的实验如下:
取一铜片装入试管,加入适量的浓硝酸,观察溶液的颜色变化。
(5)另一同学认为此同学设计的实验有缺陷,原因是 。
(6)铜与浓硝酸反应溶液呈绿色,有同学认为这是生成的NO2溶于其中的原因,并试图设计实验排除这种干扰。提出实验方案:向反应后的溶液中通入足量空气。试用化学反应方程式解释其原理:
。
云天化中学2018~2019学年度下学期期中测试
高一年级化学试题答案
一、单项选择题(本题共20小题,每小题2分,共40分)
1—5 DDDBB 6—10 CADAC
11—15 DDDCB 16—20 CCCDC
二、填空题(本题共5小题,共60分)
21、(14分)
(1)第四周期 ⅢA族 (2分)
(2)+4 HClO4 Bi2O5 (每空1分)
(3)HF < < < (每空1分)
(4)B (2分)
(5)在试管中加入CaCO3固体,再加入盐酸,将生成气体通过NaHCO3溶液洗气后,通入Na2SiO3溶液;生成白色胶状沉淀,则碳酸酸性强于硅酸,即C的非金属性强于Si。(3分,合理答案均可得分)
22、(12分)(每空2分)
(1)
(2)
(3) a、c
(4) 离子键和共价键(或极性键)
(5)Cu+H2O2+2H+=Cu2+ +2H2O
23、(12分)(每空2分)
(1)SiO2 Fe(OH)3 NaOH
(2) CO2 +OH- =HCO3- CO2 +AlO2- +2H2O=Al(OH)3 ↓+HCO3-
(3) 取少量溶液于试管中,滴入几滴KSCN溶液,观察溶液颜色,如果溶液颜色变为血红色,说明溶液中含有Fe3+,否则不含Fe3+
24、(10分)(每空2分)
(1)分液漏斗 浓盐酸
(2)饱和食盐水
(3)K2FeO4微溶于KOH溶液,在碱性溶液中较稳定(或有利于生成K2FeO4)
(4)Cl2+2OH-===Cl-+ClO-+H2O
25、(12分)
(1)100mL容量瓶(2分)
(2) 另取实验①中所得沉淀,滴加稀硫酸(或稀盐酸等)至过量,观察沉淀是否溶解(2分)
(3)Cu2O + 2H+ =Cu + Cu2+ + H2O (2分)
(4)Cu+ (1分) Cu2+ (1分)
(5)产生NO2气体,污染环境 (2分)
(6)4NO2+O2+2H2O=4HNO3 (2分)